Materia
Tutto ciò che possiede massa e occupa spazio
Elemento
Sostanza costituita da un’unica specie di atomi.
Atomo
La più piccola
particella di un
elemento
PROTONI: carica +, m = 1,673 x 10-24 g
NEUTRONI: carica 0, m = 1,675 x 10-24 g
ELETTRONI: carica -, m = 9.109 x 10-28 g
Composto
Una sostanza
composta da due o più
elementi uniti mediante
legami chimici secondo
proporzioni definite
MOLECOLE: carica neutra (H2O, CO2)
IONI : Cationi, carica +(Na+)
Anioni, carica - (Cl-)
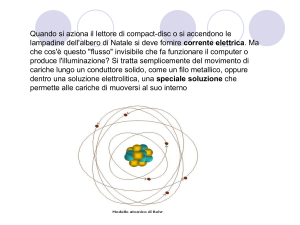
•Protoni (p) e neutroni (n)
compongono il nucleo dell’atomo
10-14 m = diametro del nucleo
• Gli elettroni (e-) sono distribuiti
intorno al nucleo e sono in continuo
movimento
•n° protoni = n° elettroni, quindi la
carica netta dell’atomo è neutra
10-9 m = spazio occupato da e-
Per ciascun atomo (elemento) possiamo definire:
n° atomico (Z) = n° protoni
(ZE)
n° massa (A) = n° protoni + n° neutroni
Isotopi
elementi con stesso Z,
e quindi con stesso n°
di e-, ma con diverso A
(AE)
PESO ATOMICO
Rapporto tra la massa dell’atomo e 1/12 della massa
dell’atomo di Carbonio
PESO MOLECOLARE
Somma dei singoli pesi atomici degli atomi che costituiscono
la molecola
MOLE
Unità utilizzata in chimica per rappresentare
quantitativamente grandi numeri di atomi, ioni e molecole
E’ la quantità in grammi corrispondente alla massa
Una mole di molecole contiene un numero di Avogadro
(N= 6,023x1023) di molecole
grammi di sostanza = numero di moli x peso molecolare
•Gli elettroni si dispongono intorno al nucleo occupando delle
regioni dello spazio denominate orbitali
•Orbitale: regione dello spazio in cui è più probabile trovare
l’elettrone
•Ogni orbitale corrisponde ad un livello energetico
•Gli elettroni tendono a disporsi intorno al nucleo occupando
l’orbitale a minor contenuto energetico
• Il numero quantico principale n identifica i livelli energetici
n=4
n=3
n=2
n=1
n =1
Es.:
idrogeno, n°
e- = 1
Energia
crescente
Elementi con n° e- >1 occupano livelli
energetici diversi
• Ogni livello energetico n è a sua volta costituito da sottolivelli
che differiscono tra loro per forma ed arrangiamento spaziale
•I sottolivelli vengono identificati dal n° quantico azimutale l e
contengono orbitali di tipo s, p, d, f
•Ciascun orbitale può contenere al massimo 2 elettroni
•2 elettroni nello stesso orbitale ruotano in senso opposto
Livello
n=1
n=2
n=3
Sottolivello Tipo di
orbitale
l=0
1s
l=0
1s
l=1
1s 2p
l=0
1s
l=1
1s 2p
l=2
1s 3p 5d
n° elettroni
2
2
6
2
6
10
Configurazione elettronica:
disposizione degli elettroni negli orbitali
•Le proprietà chimiche degli elementi sono determinate dagli
elettroni esterni (elettroni di valenza)
•Gli elettroni collocati nell’orbitale più esterno sono quelli che
partecipano ai legami chimici
•Nella formazione dei legami gli atomi tendono a raggiungere la
configurazione energeticamente più stabile, ossia quella
corrispondente al contenuto di energia più basso
•La configurazione più stabile (a minor contenuto energetico)
corrisponde alla presenza di 8 elettroni sull’orbitale esterno
(ottetto)
•Gli atomi che non hanno 8 elettroni sull’orbitale esterno
possono perderli, acquistarli o scambiarli per raggiungere
l’ottetto
Gli elementi sono stati ordinati secondo il n° atomico e disposti in
una tavola periodica dalla quale si possono ricavare tutte le
proprietà
•Periodi: righe orizzontali, contengono una successione di
elementi a n° atomico Z crescente con proprietà chimiche che
cambiano periodicamente
•Gruppi: colonne, contengono elementi che hanno gli elettroni
esterni nello stesso livello energetico e con proprietà chimiche
simili
Gruppi (stessa configurazione
elettronica esterna)
Periodi
(n° atomico
crescente)
Gli elettroni esterni determinano le proprietà chimiche dell’atomo
n=1
n=2
n=3
H
He
(Z=1)
1s
(Z=2)
1s2
odyssey 9, 10
Li
Be
B
C
N
O
F
Ne
(Z=3)
1s2
2s
(Z=4)
1s2
2s2
(Z=5)
1s2
2s22p
(Z=6)
1s2
2s22p2
(Z=7)
1s2
2s22p3
(Z=8)
1s2
2s22p4
(Z=9)
1s2
2s22p5
(Z=10)
1s2
2s22p6
Na
Mg
Al
Si
P
S
Cl
Ar
(Z=13)
1s2
2s22p6
3s23p
(Z=14)
1s2
2s22p6
3s23p2
(Z=15)
1s2
2s22p6
3s23p3
(Z=16)
1s2
2s22p6
3s23p4
(Z=17)
1s2
2s22p6
3s23p5
(Z=18)
1s2
2s22p6
3s23p6
(Z=11) (Z=12)
1s2
1s2
2s22p6 2s22p6
3s
3s2
K
(Z=19)
1s2
n=4 2s22p6
3s23p6
4s
Ca
(Z=20)
1s2
2s22p6
3s23p6
4s2
Le struttura elettronica esterna si ripete
periodicamente;
le proprietà chimiche -determinate dalla
struttura elettronica esternaseguono la stessa periodicità
Gruppo IA
Li
VI A
VII A
VIII A
O2
F2
Ne
Gli elementi dello stesso gruppo hanno la
stessa configurazione elettronica esterna e
proprietà chimiche simili
Gruppi IA-IIIA: metalli
Na
Gruppi IVA-VIA:
crescenti
proprietà
non
Gruppo VIIA: non metalli, alogeni
Gruppo VIIIA: gas nobili, inerti
metalliche