L'atomo è la parte più piccola della
materia che ne conserva tutte le
caratteristiche.
Esso è formato da particelle più
piccole:
PROTONI
NEUTRONI
ELETTRONI
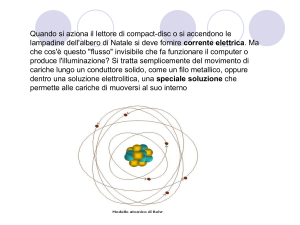
I protoni e i neutroni si trovano
nella parte centrale dell’atomo
a formare il NUCLEO.
Essi hanno una massa del tutto simile ma
mentre il neutrone non presenta carica
elettrica, il protone ha una carica positiva
Gli elettroni, hanno
carica elettrica negativa
e ruotano intorno al
nucleo
La loro massa è circa 1836 volte inferiore a quella dei
protoni quindi del tutto trascurabile rispetto a quella
delle particelle contenute nel nucleo
Tutti gli atomi, in condizioni
normali, tendono ad essere
NEUTRI.
Questo è possibile quando il
numero di elettroni che
ruotano intorno al nucleo è
uguale al numero di protoni
contenuti al suo interno.
Rappresenta il numero di protoni (e quindi anche di
elettroni) presenti in un atomo.
L’atomo
più
piccolo
è
l’idrogeno (H) che ha 1 protone
L’atomo più grande è l’uranio (U)
che ha 92 protoni
È stata ideata dal chimico russo Dmitrij Mendeleev
nel 1869 e raccoglie tutti gli elementi chimici
conosciuti
Gli elementi sono disposti in ordine crescente
rispetto al numero atomico e la tavola è suddivisa in:
8 Colonne
GRUPPI
7 Righe
PERIODI
Gli elementi di uno stesso gruppo hanno lo stesso
numero di ELETTRONI DI VALENZA (nel guscio più
esterno) e quindi proprietà simili
Ogni elemento è rappresentato da un simbolo e
riporta il numero atomico e il peso atomico
La tavola periodica suddivide gli elementi in:
METALLI
Solidi (eccetto il Hg)
Aspetto lucente
Duttili
Elastici
Malleabili
Conducono il calore
Conducono l’elettricità
NON METALLI
Solidi, gassosi o liquidi (Br)
Opachi
Non duttili
Non elastici
Non malleabili
Non conducono calore
Non conducono l’elettricità
Gli atomi hanno la tendenza a legarsi tra loro e
formare delle particelle chiamate MOLECOLE definite
come «la più piccola parte di materia che ne conserva
tutte le proprietà»
Per indicare le molecole si usano segni convenzionali:
si scrivono i simboli degli atomi che le costituiscono e
in basso a destra di ogni simbolo si indica un numero,
che corrisponde al numero di atomi di
quell'elemento presenti nella molecola stessa.
ES.
ACQUA H2O
METANO CH4
ANIDRIDE CARBONICA CO2
In natura esistono sostanze che hanno la tendenza a restare
da sole ed altre che invece tendono a legarsi ad altre. In
generale possiamo riconoscere:
1.
ELEMENTI MONOATOMICI He
2. MOLECOLE POLIATOMICHE O2
3. MOLECOLE DI COMPOSTI CO2
Ma cos’è che determina la propensione di un elemento a legarsi
con altri elementi?
Dipende dal numero di elettroni presenti sul guscio più esterno o
NUMERO DI VALENZA
Lo strato più esterno può contenere al massimo 2
c’è un solo strato ) o 8 ELETTRONI
(se
Neon
Elio
Un elemento si dice chimicamente
completo
ELETTRONI
STABILE
se lo strato esterno è
Un atomo si dice chimicamente INSTABILE o REATTIVO se lo strato
più esterno non è completo. Esso tenderà spontaneamente a
reagire con altri atomi per completare l’ottetto (o il duetto)
Questa regola prende il nome di REGOLA DELL’OTTETTO
OSSIGENO
CARBONIO
Il legame ionico si realizza quando tra due elementi si ha la
perdita o l’acquisto di un elettrone. L’elemento che perde
l’elettrone si carica positivamente e si chiama IONE POSITIVO.
L’elemento che acquista l’elettrone si carica negativamente e si
chiama IONE NEGATIVO
Il legame covalente si verifica quando gli elementi coinvolti
METTONO IN COMUNE i loro elettroni dello strato più esterno
HCl
Acido Cloridrico
H2O
Acqua
N3
Azoto
A seconda delle coppie di elettroni che gli elementi mettono in
comune si parla di legame covalente SEMPLICE, DOPPIO e TRIPLO