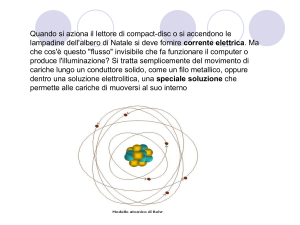
Struttura dell'atomo
• L'atomo è costituito da:
• nucleo
– quasi tutta la massa, volume trascurabile
– carica positiva
– costituito di protoni e neutroni
• elettroni
– quasi tutto il volume, massa trascurabile
– carica negativa
Particelle subatomiche
• protone
– massa 1,673•10-27 kg
– carica +1,60•10-19 C
1 u.m.a.
+1
• neutrone
– massa 1,675•10-27 kg
– carica 0
1 u.m.a.
• elettrone
– massa 9,11•10-31 kg
– carica -1,60•10-19 C
0 u.m.a.
-1
Nucleo e elettroni
• nucleo
– n. atomico Z = n. di protoni
– n. di massa A = n. di protoni + n. di neutroni
– n. di neutroni = A - Z
– carica elettrica +Z
• elettroni
– Z elettroni
– carica elettrica -Z
• massa totale
• carica totale
A u.m.a.
0
La Fisica classica è insufficiente
• La Terra e i pianeti girano intorno al Sole
– il moto inerziale li allontana
– l'attrazione gravitazionale li spinge sul Sole
– i due effetti si bilanciano
• Gli elettroni girano intorno al nucleo?
NO !
– gli elettroni hanno carica elettrica: se girassero
emetterebbero energia
Secondo la Fisica classica
l'atomo non può esistere
La meccanica quantistica
• gli oggetti non hanno posizione e
velocità misurabile
• non possono avere energia qualsiasi
ma solo valori determinati
• non sono regolati dalle leggi di Newton
come F = m a
• onde e particelle non sono cose
diverse
QUANTIZZAZIONE DELL’ ENERGIA
Ep
Variazione discreta
di energia
Variazione continua
di energia
La meccanica quantistica
descrizione ultrasemplificata
• l'elettrone è descritto da una funzione
matematica ψ (psi) definita in ogni
punto dello spazio (funzione d'onda)
• ψ è calcolabile teoricamente, ma in
pratica la matematica è complicata e si
usano funzioni approssimate
• l'elettrone è distribuito in tutto lo spazio
con densità proporzionale a ψ2, in
pratica solo dove ψ2 è grande
L'atomo di idrogeno
•
•
•
•
•
L'atomo di Idrogeno H è il più semplice
il nucleo è un protone, niente neutroni
Z=1 A=1
intorno al nucleo c'è un solo elettrone
è l'unico atomo per cui sappiamo
calcolare esattamente le possibili
funzioni d'onda dell'elettrone
• si usano le ψ esatte dell'idrogeno per
fare modelli ragionevoli per gli elettroni
degli altri atomi
Orbitali
• Le funzioni d'onda si calcolano sempre a
coppie, chiamate orbitali
• Le due ψ di un orbitale sono identiche
per la distribuzione nello spazio
• Si dice che un orbitale può contenere 1 o
2 elettroni, o essere vuoto (0 elettroni)
• L'orbitale è una funzione matematica
• L'orbitale definisce l'energia e la forma
(disposizione nello spazio) dell'elettrone
a
X = c
c = velocità di propagazione nel vuoto
delle radiazioni elettromagnetiche
2,998 x 108 m x s-1
300 000 km x s-1
Luce e elettroni
• La luce è fatta di fotoni
E = hν
costante di Planck
h = 6,6310-34 Js
• Gli elettroni occupano gli orbitali a
energia più bassa
• Se e- assorbe un fotone passa a un
orbitale di energia maggiore di hν
• Se e- passa a un orbitale a energia più
bassa di E, emette un fotone a
frequenza ν