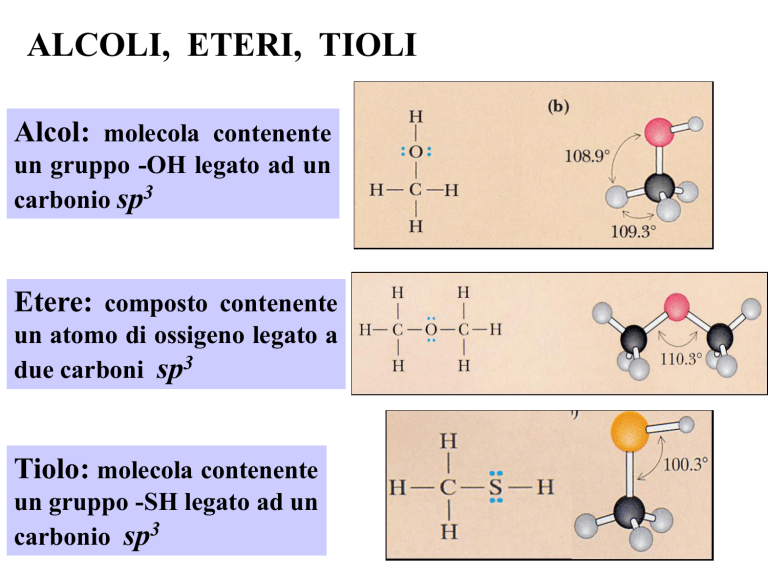
ALCOLI, ETERI, TIOLI
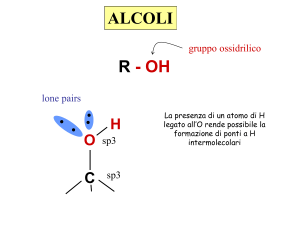
Alcol: molecola contenente
un gruppo -OH legato ad un
carbonio sp3
Etere: composto contenente
un atomo di ossigeno legato a
due carboni sp3
Tiolo: molecola contenente
un gruppo -SH legato ad un
carbonio sp3
Alcoli
Etanolo
(alcol etilico)
1-propanolo
(alcol propilico
2-butanolo
2-metil-1-propanolo
(alcol isobutilico)
Primario
2-propanolo
(alcol isopropilico)
secondario
2-metil-2-propanolo
alcol terz-butilico
terziario
1-butanolo
cicloesanolo
Diolo:
Composto con due gruppi ossidrilici su carboni ibridati
sp3. Nella nomenclatura comune sono chiamati glicoli i
dioli con gli OH legati a carboni adiacenti.
1,2-etandiolo
1,2-propandiolo
1,2,3-propantriolo
(glicole etilenico)
(glicole propilenico)
(glicerina)
Eteri
Etossietano
(etere etilico)
2-metossi-2-metilpropano
(etere terz-butilmetilico)
trans-2-etossicicloesanolo
--OR : alcossile (OCH3: metossile)
Eteri ciclici
Ossido di etilene Tetraidrofurano
Tetraidropirano
1,4-Diossano
Tioli (mercaptani)
Etantiolo
2-metil-1-propantiolo
2-mercaptoetanolo
Solfuri: sono gli analoghi solforati degli eteri.
CH3-S-CH3
dimetilsolfuro
dietilsolfuro
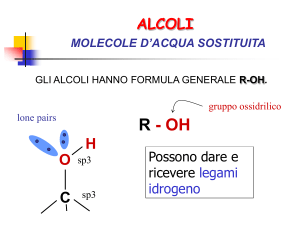
Alcoli - Proprietà fisiche
Gli alcoli sono composti con punti di ebollizione molto più alti
degli alcani di pari peso molecolare.
Ciò dipende dal fatto che sono composti polari e possono
formare legami idrogeno intermolecolari.
Gli alcoli sono spesso
utilizzati come solventi e
come
intermedi
di
reazione
L’ossigeno è sia
accettore
che
donatore
di
legame idrogeno
Eteri - Proprietà fisiche
Gli eteri sono composti polari ma non possono donare legami
idrogeno. Hanno dei punti di ebollizione più bassi rispetto agli
alcoli.
Deboli interazioni
dipolo-dipolo
Legame
idrogeno
Possono accettare un legame
idrogeno. Ciò facilita la loro
solubilità in acqua.
Tioli - Proprietà fisiche
Sono composti polari, donatori ed accettori di legami
idrogeno. I legami idrogeno sono però molto deboli.
CH3CH2-SH
p.e. 35 °C
I tioli hanno un odore
sgradevolissimo.
La moffetta (puzzola)
usa
il
3-metil-1butantiolo come arma di
difesa
CH3CH2-OH
p.e. 78 °C
Reazioni degli Alcoli
Proprietà acido-base
Acido debole
Sono acidi deboli
(più deboli dell’acqua)
Base di poco più
forte di OH-
Eq. spostato
a sinistra
Gli alcoli (come l’acqua) possono anche accettare un protone,
comportandosi da basi
Alcol protonato
Come ottenere gli alcossidi (alcolati) R O- ?
+ H2O
+
Acido più
Base più
Base più
Acido più
debole
debole
forte
forte
Si usa una reazione RED-OX con metalli alcalini:
2 CH3CH2-OH + 2Na
2 CH3CH2-O-Na+ + H2
Etossido di sodio
(Etilato di sodio)
Conversione in Alogenuri Alchilici: reaz. con HCl, HBr, HI
Reaz. di un alcol 3° con HCl: SN1
Stadio 1
veloce
Stadio 2
lento
Stadio 3
veloce
Reaz. di un alcol 1° con HBr: SN2
Stadio 1
Stadio 2
Velocità di reazione
Alcol
3°
2°
Velocità di reazione
1°
governata da
fattori sterici
Governata da
fattori
elettronici
Gli alcol 1° e 2° reagiscono con SOCl2 (cloruro di tionile)
per dare cloruri alchilici
Disidratazione
di
alcoli
formazione di alcheni
CH3
CH3COH
H3 C
C
CH2
CH3
Alcol 1°
2°
catalizzata:
È la reazione inversa
alla idratazione degli
alcheni
CH3
H2SO4
50°C
acido
3°
Facilità di disidratazione
L’alchene che si forma (principale) è quello più stabile
(Regola di Zaitsev).
80%
20%
La disidratazione degli alcoli è la reazione inversa
all’ idratazione degli alcheni.
idratazione
disidratazione
Disidratazione acido catalizzata; meccanismo E1
Stadio 1
Stadio 2
Stadio 3
lento
Disidratazione acido catalizzata; meccanismo E2
veloce
Stadio 1
Stadio 2
lento
Ossidazione degli alcoli
Un alcol 1° si ossida ad aldeide e successivamente ad acido
carbossilico
alcol 1°
aldeide
[O]
Un alcol 2° si ossida
a chetone
alcol 2°
Un alcol 3° non si ossida
acido carbossilico
chetone
Ossidazione degli alcoli
alcol 1°
aldeide
acido carbossilico
Il reagente più utilizzato per queste ossidazioni è
H2CrO4 (acido cromico)
Per fermare l’ossidazione ad aldeide si usa come ossidante il
clorocromato di piridinio (PCC)
geraniolo
geraniale
Controllo dell’alcol nel sangue: “Test del palloncino”
Si basa su un test colorimetrico dovuto alla reazione di ossidazione
dell’etanolo con dicromato:
CH3CH2-OH + Cr2O72-
CH3COH + Cr3+
verde
arancio
Gel di silice con
dicromato
Si soffia
Cr3+
Cr2O72Il palloncino
si gonfia
Epossidi
sp3
sp3
Si ottengono dagli alcheni per ossidazione con peracidi.
peracido
Epossidi: apertura dell’anello (per idrolisi acido catalizzata)
Meccanismo
1
2
3
E’ un modo per ottenere dioli
trans
Sintesi di dioli cis e dioli trans
H
RCO3H
O
H
OH
+
H2O
OH
H
trans
OH
OsO4
OH
cis
Tioli
I tioli sono più acidi degli alcoli e dell’acqua
Quindi si può usare OH- per ottenere un alchilsolfuro
Etilsolfuro di sodio
Acido più forte
base più forte
base più debole
acido più debole
Per Ossidazione dei tioli si ottengono i disolfuri
OX
RED
tiolo
Disolfuro
L’ossidazione avviene facilmente (basta l’ossigeno dell’aria).
I tioli e i disolfuri sono dei gruppi funzionali
molto importanti nei sistemi biologici.