ESERCIZI SECONDE IPSIA MECCANICHE
Modulo 1: Ripasso dello scorso anno
1.
Ripassa la tavola periodica: cosa sono i periodi e i gruppi (principali e secondari), i nome dei
gruppi principali, come si distinguono i non metalli dai metalli.
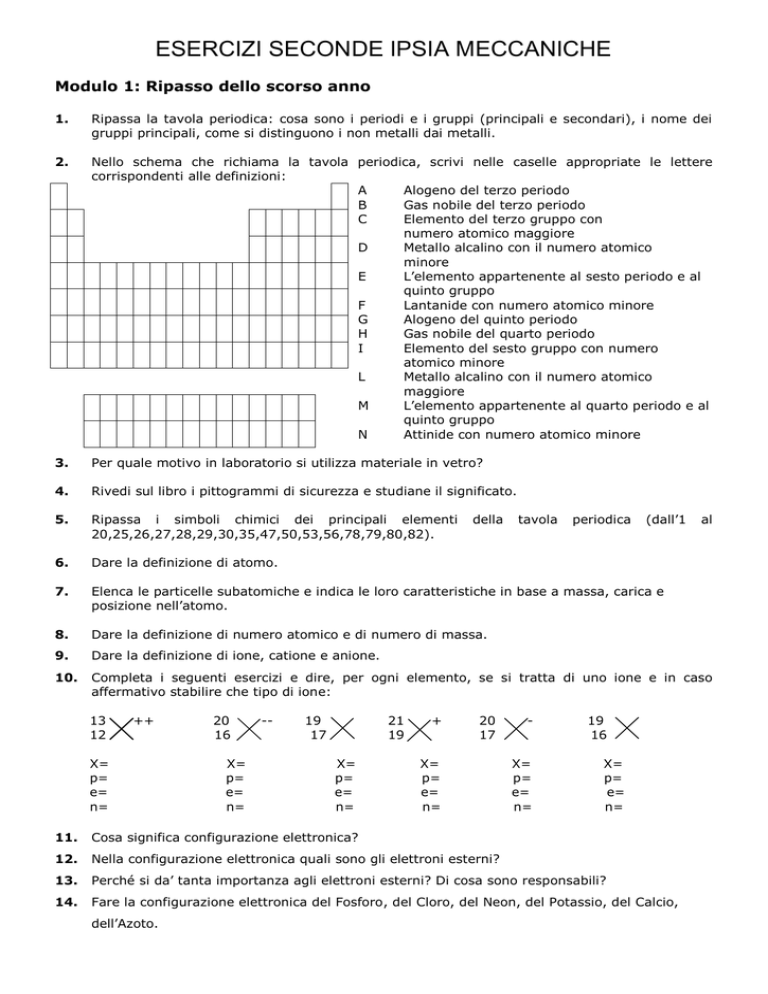
2.
Nello schema che richiama la tavola periodica, scrivi nelle caselle appropriate le lettere
corrispondenti alle definizioni:
A
Alogeno del terzo periodo
B
Gas nobile del terzo periodo
C
Elemento del terzo gruppo con
numero atomico maggiore
D
Metallo alcalino con il numero atomico
minore
E
L’elemento appartenente al sesto periodo e al
quinto gruppo
F
Lantanide con numero atomico minore
G
Alogeno del quinto periodo
H
Gas nobile del quarto periodo
I
Elemento del sesto gruppo con numero
atomico minore
L
Metallo alcalino con il numero atomico
maggiore
M
L’elemento appartenente al quarto periodo e al
quinto gruppo
N
Attinide con numero atomico minore
3.
Per quale motivo in laboratorio si utilizza materiale in vetro?
4.
Rivedi sul libro i pittogrammi di sicurezza e studiane il significato.
5.
Ripassa i simboli chimici dei principali elementi
20,25,26,27,28,29,30,35,47,50,53,56,78,79,80,82).
6.
Dare la definizione di atomo.
7.
Elenca le particelle subatomiche e indica le loro caratteristiche in base a massa, carica e
posizione nell’atomo.
8.
Dare la definizione di numero atomico e di numero di massa.
9.
Dare la definizione di ione, catione e anione.
10.
Completa i seguenti esercizi e dire, per ogni elemento, se si tratta di uno ione e in caso
affermativo stabilire che tipo di ione:
13
12
++
X=
p=
e=
n=
20
16
X=
p=
e=
n=
--
19
17
21
19
X=
p=
e=
n=
+
della
20
17
X=
p=
e=
n=
tavola
X=
p=
e=
n=
periodica
(dall’1
19
16
X=
p=
e=
n=
11.
Cosa significa configurazione elettronica?
12.
Nella configurazione elettronica quali sono gli elettroni esterni?
13.
Perché si da’ tanta importanza agli elettroni esterni? Di cosa sono responsabili?
14.
Fare la configurazione elettronica del Fosforo, del Cloro, del Neon, del Potassio, del Calcio,
dell’Azoto.
al
15.
Individua nell’esercizio precedente il periodo e il gruppo dell’elemento osservando la
configurazione elettronica e assicurati della corrispondenza con la tavola periodica.
16.
Dare la definizione di elettronegatività, di come varia nella tavola periodica e di ∆e.
17.
Dare la definizione di legame covalente e legame ionico.
18.
Schematizza come si classificano i legami in base al ∆e.
19.
Individua la relazione tra elettroni esterni, legami ed elettronegatività.
20.
Quale legame è presente nelle seguenti molecole? Motivare la risposta (con i calcoli) e definire
tale legame.
KBr
NO2
Na2S SO3
Li2O
Fe2O3 NaCl K2S
21.
Scrivere e bilanciare la reazione di combustione completa e incompleta delle seguenti
molecole: esano C6H14, del butano C4H10, dell’ottano C8H18, del decano C10H22.
22.
Bilancia le seguenti reazioni chimiche:
Ca +
H3PO4
SbCl3 +
Li
Ca3(PO4)2 +
H2S
+
Sb2S3
HCl
Mg +
LiCl +
H3PO4
FeCl3 +
H2O
CO
Fe2O3
+
K3PO4 +
Fe2S3
Co2S3
Na2O +
H2O
NaOH
Ba +
Ni2O3
K
H2S
NiCl2
CO2
+
NiO
LiNO3
+
H2
HCl
H2
H2
Fe
+
Ca(NO3)2
ZnS + O2
Cl2O5
Ca3(PO4)2 +
ZnO + SO2
H2O2
H2O
+
SiCl4 + H2O
Mg3N2 +
Ni
Be3(PO4)2 +
O2
Na3PO4 +
KNO3
HCl
+
KBr +
Fe2O3
+
+
Co2S3
H3PO4
+
Fe
Ba3(PO4)2 +
HBr
Be +
+
Ca3(PO4)2 +
H3PO4
+
CO
CO2
Ca(NO3)2
CoCl3 +
H2
HCl
Mg3(PO4)2 +
H2S
Li3PO4 +
+
CO2
Mg(NO3)2
+
H2
KOH
CoCl3 +
CO
HCl
Mg3(PO4)2 +
H2S
K2O +
+
H2
H4SiO4 + HCl
H2O
KClO3
O2
Mg(OH)2 +
NH3
KCl + O2
Modulo 2: La quantità chimica
23.
Dare la definizione di mole.
24.
Calcola la massa molare di Ni(OH)3
25.
Quanti grammi sono contenuti in 7,7 · 1023 molecole di CoBr2.
26.
Calcola quante molecole sono presenti in 122g di Au(OH)3.
NaNO3
27.
A quante moli corrispondono 9,3 · 10
28.
A quante moli corrispondono 54g di Na3PO4.
29.
Quanti grammi sono contenuti in 11,7 moli di Cr2O3.
30.
Calcola quante molecole sono presenti in 5,3 moli di AlCl 3.
31.
Calcola quante molecole sono presenti in 4,3 moli di Ni(OH) 3?
32.
A quante moli corrispondono 6,4 · 10
33.
Quanti grammi sono contenuti in 9,1 · 1023 molecole di Co2S3?
34.
Calcola quante molecole sono presenti in 87g di Mn(OH)3?
35.
Dare la definizione di mole.
36.
Calcola la massa molare di Ca(OH)2
37.
A quante moli corrispondono 120g di BeSO4?
38.
Quanti grammi sono contenuti in 11.7 moli di Fe2O3?
23
24
atomi di zolfo.
atomi di ferro?
Modulo 3: Legge di Lavoisier
39.
Calcola quanti grammi di HCl, BeCl2 e H2O sono necessari per far reagire 135 g di Be(OH)2?
Be(OH)2
40.
+
+
H3PO4
+
Ca3(PO4)2
H2S
H2O
+
H2
Sb2S3
+
HCl
Calcola quanti grammi di K3PO4, H3PO4 e H2O sono necessari di per far reagire 160 g di KOH
KOH +
43.
BeCl2
Calcola quanti grammi di H2S, Sb2S3 e HCl sono necessari per far reagire 85 g di SbCl3?
SbCl3
42.
HCl
Calcola quanti grammi di H3PO4, H2 e Ca3(PO4)2 sono necessari per far reagire 120 g di Ca?
Ca
41.
+
H3PO4
K3PO4
+
H2O
Enuncia la legge di Lavoisier e verifica che negli esercizi sopra sia approssimativamente
rispettata.
Modulo 3: Conducibilità delle soluzioni
44.
Quali sono le caratteristiche che deve avere una soluzione per condurre l’elettricità?
45.
Quali sono i fattori che aumentano la conducibilità di una soluzione?
46.
Nell’esperienza sulle ossido riduzioni abbiamo visto in un becher le seguenti reazioni:
Fe + Cu2+
2Ag+ + Pb
Fe2+ + Cu,
2Ag + Pb2+
dire qual è la specie che si riduce e quale si ossida.
Modulo 4: Classificazione delle sostanze
47.
Come si ottengono formalmente i sali binari?
48.
Qual è la differenza tra ossidi basici e ossidi acidi?
49.
Indica, per ogni classe di composti, gli elementi che lo costituiscono (metallo, non metallo, H,
O), nell’ordine corretto:
Ossiacidi
Ossidi acidi
Idruri metallici
Sali binari
Idracidi
Ossidi basici
Idruri non metallici
Sali ternari
Idrossidi
50.
Completa la seguente tabella:
Composto
binario/ternario
sostanza
Formula generale
Tipo di composto
Cl2O3
H2SO3
Ca(ClO3)2
NaNO3
CuH2
NH3
FeCl2
Ni2O3
Ni2O3
H2SO4
N2O3
NaOH
NH3
Ca(OH)2
FeCl2
Mg(ClO5)2
Modulo 5: Nomenclatura degli ossidi e numeri di ossidazione
51.
52.
Indicare il numero di ossidazione di tutti gli elementi nei seguenti composti:
MnO2
Ti2O3
CrO3
Mn2O7
I2O
MnO
Co2O3
Cr2O3
Li2O
MnO
Co2O3
Cr2O3
Mn2O5
Br2O
Un composto binario tra un metallo X e l’ossigeno ha formula X2O.
Qual è il numero di ossidazione di X?
Qual è la formula del composto che lo stesso elemento forma con l’idrogeno (tieni
conto che negli idracidi l’idrogeno ha numero di ossidazione +1 mentre negli idruri ha
numero di ossidazione -1)?
Escludendo che X sia un elemento di transizione, puoi decidere qual è il gruppo di
appartenenza di X?
53.
Scrivi la formula del composto binario tra fosforo e ossigeno sapendo che il fosforo ha numero
di ossidazione 5.
54.
Nel diossido di manganese qual è il numero di ossidazione del metallo?
55.
Nel triossido di dimanganese qual è il numero di ossidazione del metallo?
56.
Scrivi la formula del composto binario tra zolfo e ossigeno sapendo che lo zolfo ha numero di
ossidazione 6.
57.
Scrivi la formula del composto binario tra azoto e ossigeno sapendo che l’azoto ha numero di
ossidazione +3.
58.
Perché secondo le regole della nomenclatura tradizionale il nome degli ossidi dei metalli alcalini
non ha desinenze?
59.
Completa la seguente tabella:
Formula
Nome IUPAC
Triossido di dicloro
Nome tradizionale
SO2
Ossido rameoso
Triossido di difosforo
Ossido nichelico
Au2O3
Ossido di disodio
Ossido di litio
Ag2O
eptaossido di dicloro
SO3
Ossido auroso
Monoossido di carbonio
Ossido cobaltoso
NiO
Ossido di diargento
Ossido di magnesio
Cl2O5
triossido di dicloro
Fe2O3
Ossido rameico
pentaossido di difosforo
Ossido nicheloso
P2O5
Ossido di dipotassio
Ossido di berillio
SnO2