SINTESI DELL’INTERVENTO
DEL DOTT. MAURICE PETITOU
Nel 1978, Jean Choay, proprietario dei "Laboratori Choay" decise di lanciare un
programma di ricerca sull’eparina. Il “Laboratorio Choay” era leader nel mercato delle
eparine, grazie al successo di Calciparina, la prima eparina a basse dosi venduta in
siringhe monouso. Jean Choay mi chiamò allora per completare in qualità di chimico
l’“Heparin Choay Team", l'équipe di ricerca da lui diretta, che contava anche sulla
presenza del biochimico Jean-Claude Lormeau.
Jean Choay aveva in mente di ottenere, a partire da complessi eterogenei di
polisaccaridi eparinici, delle specie più pure che avrebbero potuto costituire il principio
attivo di nuovi farmaci più efficaci e/o meglio tollerati. Aveva persino anticipato che i
composti ultimi avrebbero potuto essere ottenuti interamente tramite sintesi chimica,
permettendo così di affrancarsi dall’origine animale del prodotto. Quest’ultimo aspetto
rappresentava la principale ragione della mia assunzione.
Molto rapidamente iniziai a lavorare sulla caratterizzazione chimica di frazioni di
eparina a basso peso molecolare già ottenute da Jean-Claude Lormeau e Jean Choay,
tramite estrazione a partire dall’eparina. Successivamente abbiamo messo a punto un
metodo chimico che permettesse di ottenere tali prodotti in grandi quantità. Questo
segnò la nascita delle eparine a basso peso molecolare, per noi la Fraxiparina.
Parallelamente, stavamo conducendo altri esperimenti che ci permisero di mostrare che
una sequenza pentasaccaridica particolare giocava un ruolo critico nell’espressione
dell’attività anticoagulante dell’eparina. Questa sequenza è stata caratterizzata in parte
dal nostro gruppo, in parte grazie all’aiuto essenziale dell’équipe del Professor Casu,
della sua NMR e, in parte, anche da altre équipe in Svezia e negli Stati Uniti. Qualche
anno prima era stato dimostrato che l’effetto anticoagulante dell'eparina veniva mediato
da una proteina plasmatica, l'antitrombina che, attivata dall’eparina, inibiva diversi
fattori della coagulazione. Avevamo allora scoperto che la sequenza pentassaccaridica
evocata in precedenza era capace di attivare l’antitrombina verso l’inibizione selettiva di
un unico fattore della coagulazione, il fattore Xa.
La tappa successiva fu la riproduzione tramite sintesi chimica della sequenza
pentasaccaridica. La prima sintesi fu realizzata nel 1983, presso l’Istituto Choay, con la
collaborazione del Professor Sinaÿ, chiamato come consulente da Jean Choay. Abbiamo
così ottenuto qualche milligrammo di prodotto, sufficiente per verificare nei modelli
animali che possedesse le attese proprietà antitrombotiche. Il nostro compito è consistito
poi nell’ottimizzarne la struttura, in modo da farne un principio attivo da farmaco.
3
Infine, le nostre équipe di sviluppo, in collaborazione con quelle di Organon, hanno
effettuato un enorme lavoro per mettere a punto la produzione di uno dei principi attivi
più sofisticati nell’industria farmaceutica.
Tuttavia, c’era un altro ostacolo da superare, bisognava dimostrare la validità
dell’ipotesi farmacologica di partenza, in altri termini, dimostrare che un inibitore
selettivo del fattore Xa era un efficace agente antitrombotico anche nell’uomo. Le
nostre équipe di sviluppo clinico hanno realizzato questo progetto attraverso studi
clinici che hanno reclutato circa 10.000 pazienti in chirurgia ortopedica, una chirurgia
ad alto rischio di trombosi. In questi studi, fondaparinux sodico (Arixtra) ha
dimostrato una notevole efficacia: l'iniezione quotidiana in un’unica dose di 2,5
milligrammi produceva un effetto antitrombotico superiore a quello del prodotto di
riferimento, l'enoxaparina, iniettato con una dose di 40 milligrammi una volta al giorno
o con una dose di 30 milligrammi due volte al giorno.
Diversi altri studi hanno ora dimostrato che fondaparinux è superiore, o almeno
altrettanto efficace, a qualsiasi altro trattamento antitrombotico utilizzato oggi in diverse
situazioni cliniche. Disponiamo quindi ora di un nuovo potente antitrombotico, ben
tollerato e di facile utilizzo (un unico dosaggio per la prevenzione della trombosi, una
sola iniezione quotidiana indipendentemente dall'indicazione). L'origine sintetica di
questo prodotto e il fatto che si leghi esclusivamente ad una proteina del plasma bene
definita, l'antitrombina, ne fanno un prodotto più sicuro, che non dovrebbe presentare
gli effetti secondari tipici dell’eparinoterapia come l’osteoporosi e le trombosi associate
alle trombocitopenie.
Jean Choay non è più tra noi per contemplare il frutto delle sue anticipazioni. Questo
frutto è potuto maturare grazie allo sforzo di tutte le persone – e sono numerose – che
un giorno sono state legate a questo progetto. In questa sede, voglio ringraziare
sinceramente tutti i presenti che vi hanno contribuito.
IL DOTT. PETITOU E’ RESPONSABILE DELL’UNITA’ DI EMIOBIOLOGIA DEL
CENTRO RICERCHE SANOFI-SYNTHELABO DI TOLOSA
4
SINTESI DELL’INTERVENTO
DEL PROF. BENITO CASU
Collaborazione italiana alla progettazione ed allo studio delle basi molecolari
dell’attività antitrombotica del pentasaccaride fondaparinux
Il gruppo di ricerca “Carbohydrate Sciences” dell’Istituto Ronzoni ha collaborato
strettamente con il gruppo francese sin dalla fase di progettazione del pentasaccaride
che avrebbe dovuto riprodurre la struttura del sito attivo dell’eparina per l’antitrombina.
Il confronto degli spettri di risonanza magnetica di frazioni e frammenti di eparina con
alta affinità per l’antitrombina ha permesso di evidenziare segnali NMR correlabili al
sito attivo, ed in seguito di confermare la struttura del pentasaccaride naturale e di sue
varianti. La collaborazione è continuata per diversi anni con la caratterizzazione
strutturale di intermedi e del prodotto finale di sintesi.
Con l’apporto di calcoli teorici di ricercatori del Laboratorio di Chimica delle
Macromolecole del Consiglio Nazionale delle Ricerche, lo studio NMR di numerosi
frammenti sintetici contenenti diverse varianti della sequenza del pentasaccaride ha
permesso di determinare la struttura tridimensionale di detti frammenti e di evidenziare
una caratteristica unica delle unità componenti di acido iduronico. Essendo in grado di
assumere diverse forme indipendentemente dal loro dintorno molecolare, queste unità
conferiscono alle sequenze che li contengono una grande versatilità di interazione, che
facilita la formazione di complessi con proteine, in particolare con l’antitrombina.
I suddetti studi in collaborazione sono stati recentemente ripresi, portando per la prima
volta alla determinazione della struttura tridimensionale assunta dal pentasaccaride
combinandosi all’antitrombina (conformazione “attiva”). Detti studi hanno anche
permesso di razionalizzare il ruolo di altri gruppi del pentasaccaride non direttamente
coinvolti nell’interazione con l’antitrombina, ma importanti nel determinare l’attività
antitrombotica del complesso.
IL PROF. BENITO CASU È COORDINATORE SCIENTIFICO ALL’ISTITUTO DI
RICERCHE CHIMICHE E BIOCHIMICHE “G. RONZONI” DI MILANO
5
SINTESI DELL’INTERVENTO
DEL PROF. FRANCO PIOVELLA
Il premio Galeno viene quest’anno meritatamente assegnato al fondaparinux per gli
importanti risultati ottenuti sia nella prevenzione che nella terapia della malattia
Tromboembolica venosa (Tev). La molecola è stata studiata chimicamente in Francia,
ma è l’Italia in particolare ad aver svolto un ruolo rilevante dal punto di vista della
ricerca clinica. A partire dagli anni ’90 i contributi italiani nel settore della prevenzione
e della terapia della trombosi venosa sono numerosi e determinanti: nel ’96 il New
England Journal of Medicine (NEJM) pubblica i risultati dello studio Tasman che ha
confrontato una molecola ‘progenitrice’ del fondaparinux cioè l’eparina a basso peso
molecolare (nadroparina) con l’eparina non frazionata nella terapia della Trombosi
venosa profonda (Tvp). Lo studio è rilevante, almeno per due motivi: dimostra per la
prima volta che i pazienti con trombosi venosa profonda possono essere trattati a casa,
evitando così lunghi ricoveri e che si possono ridurre notevolmente i costi ospedalieri
dovuti alla Tev. L’Italia contribuisce in modo sostanziale a questo studio: più di un
terzo dei pazienti sono arruolati nei centri di Padova e Pavia, i rimanenti in Australia,
Nuova Zelanda e altri Paesi europei.
Nel ’97 viene pubblicato un secondo studio (Columbus, sempre su NEJM), con un’altra
eparina a basso peso molecolare, che dimostra che non solo la trombosi venosa
profonda ma anche l’embolia polmonare - malattia considerata in genere di gravità
superiore - può essere trattata con le stesse dosi di eparina utilizzate per la Tev. Anche
in questo studio i due centri che hanno arruolato più pazienti sono risultati Padova e
Pavia.
Questi importanti risultati hanno portato i ricercatori italiani ad essere cooptati nel
disegno di studi multicentrici internazionali o invitati a partecipare al comitato di
gestione di tali ricerche.
Gli studi sulla prevenzione della trombosi con fondaparinux sono l’espressione di uno
sforzo notevole con pochi precedenti confrontabili: più di 7mila pazienti arruolati in 4
studi dall’identico disegno per valutare l’efficacia del fondaparinux nel prevenire le Tev
e l’embolia polmonare nelle tre circostanze più importanti della chirurgia ortopedica:
chirurgia del ginocchio, dell’anca e nella frattura di femore. In questi 4 studi - che
hanno confrontato l’eparina a basso peso molecolare più impiegata al mondo
(enoxaparina) col fondaparinux - è stato dimostrato che il fondaparinux ha ridotto
l’incidenza di trombosi venosa profonda del 55%. Si tratta di un risultato straordinario
che ha pochi confronti in medicina. Con l’enoxaparina le persone sottoposte a protesi di
ginocchio hanno il 27% di rischio di trombosi, mentre con il fondaparinux il rischio
scende al 12%; per la protesi d’anca il rischio con l’eparina è attorno al 10% e con il
nuovo farmaco è meno del 5%. Inoltre, lo studio Penthifra Plus ha confermato come la
6
profilassi prolungata, cioè proseguita dopo la dimissione ospedaliera in seguito ad
intervento di chirurgia maggiore, per un periodo di circa 20 giorni, riduce del 94% il
rischio di trombosi.
Infine è giusto ricordare che è attualmente in corso uno studio (Expert) - di cui sono il
coordinatore assieme ai colleghi Fanelli e Cherubino - che mira a valutare il
fondaparinux in chirurgia ortopedica nei pazienti sottoposti ad anestesia epidurale, in
genere considerata una controindicazione all’uso di farmaci anticoagulanti.
Passando poi dalla prevenzione - in cui il nuovo farmaco si è dimostrato così efficace –
alla terapia di Tev ed embolia polmonare, va anche in questo caso ricordato che l’Italia
ha partecipato fin dall’inizio agli studi dello sviluppo del farmaco: lo studio Rembrandt,
pubblicato nel 2000 su Circulation, di fase II, è servito a trovare il dosaggio ideale,
mentre gli ultimi due in ordine di tempo, Matisse PE e Matisse DVT, ne hanno
dimostrato l’efficacia clinica. Il primo, pubblicato il 30 ottobre 2003 su NEJM, ha
dimostrato che il fondaparinux è altrettanto efficace (sfiorando la superiorità) rispetto
all’eparina a basso peso molecolare nel trattamento dell’embolia polmonare. Il secondo,
che ha dimostrato la stessa efficacia del fondaparinux rispetto alla enoxaparina nel
trattamento della trombosi venosa profonda, verrà pubblicato nelle prossime settimane.
A dimostrazione ulteriore dell’importanza che ormai i ricercatori italiani hanno assunto
in questo settore, 7 Paesi asiatici (Cina, Taiwan, Malesia, Indonesia, Filippine, Corea
del Sud e Thailandia) hanno chiesto al Policlinico S. Matteo di Pavia di condurre uno
studio che valutasse l’incidenza della trombosi in chirurgia ortopedica nei rispettivi
Paesi. Dopo un periodo di “training”, i centri coinvolti hanno inviato a Pavia le
flebografie post-operatorie da sottoporre al giudizio del comitato responsabile della
registrazione del numero di eventi. Questo studio ha dimostrato che in questi Paesi,
dove la profilassi non viene attuata per la scarsa comprensione del rischio trombotico, la
Tev ha un’incidenza superiore al 40%, confermando quindi, se ci fossero dubbi residui,
che nonostante le procedure chirurgiche più avanzate, i tempi ridotti, la mobilizzazione
precoce, la trombosi venosa profonda è un serio problema e la profilassi va non solo
applicata ma migliorata, possibilmente con nuovi farmaci.
IL PROF. PIOVELLA E’ DIRETTORE DEL SERVIZIO
TROMBOEMBOLICHE DEL POLICLINICO S. MATTEO DI PAVIA
MALATTIE
7
IL PREMIO GALENO
Il ‘Prix Galien’ è nato in Francia nel 1970, per iniziativa del farmacista Roland Mehl,
per promuovere lo sviluppo e la ricerca nel campo farmaceutico, premiando ogni anno
le molecole più innovative cioè quelle di recente introduzione che hanno rappresentato
una decisa innovazione nel campo terapeutico per il quale sono state approvate.
LE EDIZIONI NAZIONALI
Dopo le prime edizioni limitate alla Francia, si sono aggiunti i riconoscimenti nazionali
assegnati ogni anno da apposite giurie di esperti in Germania, Spagna, Olanda,
Portogallo, Regno Unito, Belgio, Svizzera, Italia, Irlanda, Stati Uniti, Canada, Messico
e Argentina.
GALENO IN ITALIA
In Italia la prima edizione del Galeno è stata indetta nel 1992. In quell’occasione il
premio fu assegnato alla CICLOSPORINA prodotta da Novartis (allora Sandoz). Ecco i
vincitori di tutte le edizioni successive da allora ad oggi:
1993, alla LACIDIPINA, calcioantagonista di terza generazione di Glaxo Wellcome;
nel 1994, alla RIFABUTINA di Pharmacia, antimicotico specifico per il M.
tuberculosis, ma attivo anche sui micobatteri atipici;
nel 1995 e nel 1996 non è stato attribuito
nel 1997, alla FOLLITROPINA BETA, preparato ricombinante di origine biotecnologica
della Organon per il trattamento ormonale della sterilità femminile;
nel 1998, al LOSARTAN, capostipite dei sartani, nuova classe di antipertensivi della
Merck, Sharp & Dohme;
nel 1999, al BASILIXIMAB, anticorpo monoclonale della Novartis che ha fatto
registrare significativi passi avanti nel controllo del rigetto post-trapianto;
nel 2000, al ROFECOXIB, farmaco antinfiammatorio non steroideo inibitore selettivo
della COX 2, dalla ricerca Merck Sharp&Dohme
nel 2001, a MOXIFLOXACINA, antibiotico di III generazione della classe dei
fluorochinoloni, specifico per le infezioni gravi dell’apparato respiratorio, polmoniti
in primis, sviluppato da Bayer
nel 2002, a IMATINIB (Glivec), frutto della ricerca Novartis e capostipite di una
nuova classe di agenti antiproliferativi per il trattamento della leucemia mieloide
cronica (LMC) e dei tumori GIST (Gastrointestinal Stromal Tumors)
nel 2003 a FONDAPARINUX di Sanofi-Synthélabo, primo anticoagulante
completamente di sintesi per la trombosi venosa profonda.
Oltre al riconoscimento al farmaco e all’azienda che ha sviluppato la molecola
vincitrice (quest’anno Sanofi-Synthélabo), vengono assegnati anche:
8
premio al giovane ricercatore nell’università (in denaro)
premio al giovane ricercatore nell’industria (in denaro)
premio alla carriera nell’università (medaglia e diploma)
premio alla carriera nell’industria (medaglia e diploma)
Sanofi-Synthélabo è tra le aziende che hanno ricevuto più premi Galeno. Tra tutti
ricordiamo i riconoscimenti:
alle molecole:
1988,1994: fraxiparina
2000: clopidogrel
2003: fondaparinux
alla ricerca:
1986: premio Galeno a 3 ricercatori per la definizione del meccanismo molecolare
dell’eparina nella prevenzione della malattia tromboembolitica
1987: premio Galeno ad altri 3 ricercatori per la scoperta e lo sviluppo della ticlopidina
1996: premio Galeno a 2 ricercatori per i lavori sui recettori dei neuropeptidi
2001: premio Galeno a Luciano Manara, direttore del centro Ricerche Sanofi-Midy di
Milano.
LA GIURIA ITALIANA
A conferire il premio italiano è una giuria altamente qualificata, presieduta da
Rodolfo Paoletti, direttore dell’Istituto di Scienze Farmacologiche dell’Università di
Milano e preside della facoltà di Farmacia composta da 12 autorevoli personalità,
prestigiosi esponenti della ricerca e della clinica italiana.
LE EDIZIONI INTERNAZIONALI
Nel 1990 il Prix Galien è diventato internazionale: ogni due anni la giuria assegna un
ulteriore riconoscimento, il Galien International, ad un farmaco selezionato tra i
vincitori dei vari Paesi. Il premio può anche essere assegnato ex-aequo. E’ tuttavia solo
dal 1996 che al Galeno viene riconosciuta ufficialmente la valenza internazionale.
9
Le ultime due edizioni del Galeno International sono state conferite:
nel 2000, all’INFLIXIMAB di Schering Plough, primo anticorpo monoclonale anti –
Tnf alfa per la malattia di Crohn
nel 2002, a IMATINIB (Glivec)
L’edizione del 2004 sarà assegnata a Lisbona nell’ottobre di quest’anno. Uno dei
maggiori candidati è il fondaparinux vincitore dell’edizione italiana.
PERCHE’ GALENO
Claudio Galeno è stato, insieme ad Ippocrate, il più celebre medico del mondo antico.
Nato nel 129 d.C. a Pergamo (Asia Minore), studiò ad Alessandria, per poi far ritorno
nella città d'origine, dove cominciò ad esercitare la professione. Successivamente si
trasferì a Roma, come medico alla corte di Marco Aurelio e dei suoi successori.
Fondatore della fisiologia sperimentale e della medicina sistematica, sino al
Rinascimento ebbe considerazione pari a quella di Aristotele in filosofia. Nelle malattie,
a differenza di Ippocrate, valorizzò la perturbazione locale, cioè quella dei singoli
organi.
A Galeno vengono attribuiti oltre quattrocento scritti suddivisibili in sette gruppi:
anatomia, patologia, terapia, diagnostica e prognostica, commentari agli scritti
ippocratici, filosofia e grammatica. A noi ne sono pervenuti 108. Il più noto è il
Methodus medendi, che riassume il metodo galenico e per lungo tempo costituì il testo
fondamentale dell'insegnamento medico. Morì a Roma nel 199.
Claudio Galeno ha legato il proprio nome a una categoria di preparati farmaceutici – i
galenici, appunto - e viene correttamente considerato il padre della farmacologia
moderna. Come detto è stato il primo a impostare il ragionamento clinico, suggerendo
di formulare la diagnosi soltanto dopo un’attenta e sistematica osservazione del
paziente.
Nell’enorme mole di lavori che ha lasciato ai posteri, Galeno ha sottolineato
l’importanza della posologia, affermando: «Il metodo terapeutico si basa sulla qualità
delle droghe, il modo e il tempo della somministrazione, che sono specifici per ogni
malato. E’ importante anche determinare la quantità esatta rispetto alla robustezza del
paziente». L’opera più specifica di Galeno si intitola “De simplicium medicamentorum
temperamentis et facultatibus”; per la prima volta si elencano 473 rimedi di origine
vegetale, minerale e animale, alcuni dei quali sono medicamenti sorprendentemente
articolati e composti, come per esempio la triaca, che contiene ben 73 principi attivi.
Una figura insomma in grande anticipo sui tempi, che coincide perfettamente con gli
intenti del premio che le è stato intitolato.
10
FONDAPARINUX, MOLECOLA CAPOSTIPITE
DI UNA NUOVA CLASSE TERAPEUTICA
La nuova classe di antitrombotici inaugurata da fondaparinux è quella degli inibitori
selettivi del fattore Xa.
Differenze con i farmaci tradizionali
I farmaci antitrombotici tradizionali (eparina, eparina a basso peso molecolare e
antagonisti della vitamina K) agiscono contemporaneamente a differenti livelli della
cosiddetta ‘cascata coagulativa’, l’insieme dei complessi meccanismi che grazie
all’intervento in successione di diversi fattori (noti come “fattori della coagulazione”)
portano alla formazione di un coagulo piastrinico e fibrinico in risposta a stimoli quali:
la lesione della parete di un vaso sanguigno, infezioni, infiammazioni e aterosclerosi.
Ciò significa che in pratica i farmaci tradizionali non hanno un effetto mirato, ma
influenzano numerosi fattori della coagulazione.
Meccanismo d’azione altamente selettivo
Il fondaparinux invece è il primo farmaco in grado di bloccare selettivamente
(legandosi con l’antitrombina III, il più potente inibitore naturale della coagulazione) un
unico fattore della coagulazione, il fattore Xa situato nella fase centrale e cruciale della
‘cascata coagulativa’ e che costituisce pertanto un target chiave della terapia
antitrombotica e antiembolica.
Perché è più efficace
L’inibizione di una sola molecola di fattore Xa impedisce la formazione di ben 50
molecole di trombina, il precursore della coagulazione. Il fondaparinux potenzia di 300
volte l’effetto inibitorio naturale dell’antitrombina III nei confronti del fattore Xa.
Questa inibizione selettiva del fattore Xa consente un’efficace interruzione della cascata
coagulativa, evitando così la formazione e l’estendersi dei trombi. L’efficacia
antitrombotica del fondaparinux, dimostrata in 4 studi clinici condotti sugli interventi di
chirurgia ortopedica dell’anca e del ginocchio, supera di oltre il 50% quella dell’ultima
generazione di farmaci costituiti da eparina.
Una sostanza interamente di sintesi
Fondaparinux è una molecola di piccole dimensioni, pura ed originale, formata da
cinque unità di saccaridi (zucchero), ottenuta interamente per sintesi chimica.
Essendo sintetica, offre molti vantaggi rispetto alle eparine tradizionali (non frazionate e
a basso peso molecolare) di origine animale. Con il fondaparinux non esiste infatti la
possibilità di contagio da eventuali agenti patogeni di origine animale, come i prioni.
11
Come agisce
Grazie alla sua rapida insorgenza d’azione, fondaparinux va somministrato per via
sottocutanea dopo almeno 6 ore dall’intervento chirurgico. Ciò costituisce un enorme
vantaggio rispetto all’eparina che, in Europa, viene somministrata prima dell’intervento,
fattore che può creare problemi di sanguinamenti intraoperatori al chirurgo, soprattutto
in caso di pazienti che devono essere operati d’urgenza (ad esempio per frattura
dell’anca) o che hanno maggiore tendenza alle emorragie a seguito di terapie
anticoagulanti.
La somministrazione postoperatoria di una dose di 2,5 mg di fondaparinux una volta al
giorno, invece, indipendentemente dalle caratteristiche del paziente (età, sesso, peso,
tipo di anestesia, durata dell’intervento chirurgico), consente di standardizzare e
pertanto di semplificare la profilassi a livello globale, per ogni tipo di paziente.
La sua prolungata emivita assicura una protezione antitrombotica di 24 ore, per cui è
necessaria una sola iniezione al giorno, in qualsiasi situazione clinica.
La siringa di sicurezza del fondaparinux
Gli operatori sanitari sono spesso soggetti a punture accidentali da aghi. Secondo dati
recenti, 1 infermiere su 5 riferisce una lesione all’anno da puntura accidentale d’ago,
circa il 20% delle quali dovute ad aghi utilizzati per somministrazioni sottocutanee. I
potenziali rischi di contaminazione sono oggi evidenti e tanto preoccupanti che i
governi di tutto il mondo hanno attuato misure legislative per la limitazione delle
punture accidentali da aghi.
Grazie alla dose unica da 2,5 mg per tutti i pazienti, fondaparinux può essere messo a
disposizione in siringhe monouso, pre-riempite e dotate di un esclusivo sistema di
protezione dell’ago specificamente progettato per ridurre il rischio di puntura
accidentale dopo l’uso: una volta iniettato il liquido sottocute l’ago si ritrae
automaticamente all’interno della siringa grazie ad una capsula sotto pressione.
Queste caratteristiche, unite alla maggiore efficacia dimostrata nei 4 studi clinici che
hanno portato alla sua approvazione in chirurgia ortopedica maggiore, rappresentano
vantaggi importanti e significativi rispetto agli altri antitrombotici attualmente
disponibili.
Fondaparinux sodico è stato scoperto dal dottor Maurice Petitou, responsabile
dell’Unità di Emobiologia del Centro Ricerche Sanofi-Synthélabo di Tolosa, ed è stato
sviluppato congiuntamente da Sanofi-Synthélabo e Organon.
12
I PUNTI DI FORZA DI FONDAPARINUX
1. E’ la prima molecola di una nuova classe terapeutica: gli inibitori selettivi del fattore
della coagulazione Xa
2. Offre un miglioramento significativo dell’efficacia rispetto alle eparine a basso peso
molecolare
3. Analogamente alle eparine, è ben tollerato
4. Viene somministrato una volta al giorno con iniezione sottocutanea, a partire da 6-8
ore dall’intervento chirurgico di ortopedia maggiore
5. E’ totalmente di sintesi
6. Non ha interazioni con le piastrine
7. E’ somministrato con una siringa monouso dotata di un sistema automatico di
protezione dell’ago
8. E’ economicamente conveniente
13
LE TAPPE SIGNIFICATIVE DELLA RICERCA
SULL’INIBIZIONE DEL FATTORE XA
1990
Inizio dello sviluppo preclinico
Luglio 1994
Risultati di Fase IIa:
l’inibitore specifico del fattore Xattivato (Xa) è un efficace
agente antitrombotico
Settembre 2000
Presentazione dei risultati preliminari degli studi di Fase III
Dicembre 2000
Presentazione dei risultati degli studi di Fase III nella
prevenzione del tromboembolismo venoso dopo chirurgia
ortopedica maggiore, in occasione della sessione plenaria del
congresso dell’American Society of Hematology (ASH) a San
Francisco
Febbraio 2001
Presentazione del dossier per la registrazione di fondaparinux in
Europa e negli Stati Uniti
Aprile 2001
Ottenimento di una «Procedura Prioritaria» di 6 mesi per
fondaparinux da parte della Food and Drug Administration
(FDA) negli Stati Uniti
Agosto 2001
Ottenimento di una « Approvable Letter » per fondaparinux da
parte della Food and Drug Administration (FDA) negli Stati
Uniti
Dicembre 2001
Approvazione della Food and Drug Administration (FDA) negli
Stati Uniti
Parere favorevole del Committee for Proprietary Medicinal
Products (CPMP) in Europa
Marzo 2002
Fondaparinux ottiene l’Autorizzazione
Commercio nell’Unione Europea
Aprile 2003
Fondaparinux è disponibile anche in Italia
all’Immissione
in
14
GLI 8 MAGGIORI STUDI CLINICI SUL FONDAPARINUX
L’efficacia di fondaparinux (disponibile dal 2002 sia negli Stati Uniti che in Europa) è
stata dimostrata da ben 8 studi clinici internazionali multicentrici.
I 4 studi di Fase III per lo sviluppo di fondaparinux in chirurgia ortopedica maggiore
(sostituzione protesica d’anca e ginocchio) costituiscono il più ampio programma di
sviluppo, mai messo in atto fino ad oggi, per un farmaco antitrombotico nella profilassi
del TEV in chirurgia ortopedica. Inoltre, fondaparinux è l’unico farmaco antitrombotico
sviluppato per la profilassi del TEV nella chirurgia per frattura d’anca, una condizione a
rischio elevatissimo di TEV. I risultati di questo programma hanno dimostrato che
fondaparinux è inequivocabilmente più efficace dell’eparina a basso peso molecolare
(enoxaparina) nella profilassi del TEV in pazienti sottoposti a chirurgia ortopedica
maggiore, con una riduzione globale del rischio altamente significativa del 55.2% in
favore di fondaparinux (p=10-17), dal 13.7% al 6.8%. La maggior efficacia di questo
farmaco non ha comportato un aumento del rischio di emorragie clinicamente
significative. Di fatto, in tutti gli studi l’incidenza di sanguinamenti fatali, in organi
critici o che richiedevano un reintervento, è risultata sovrapponibile nei due gruppi.
I 4 studi - pubblicati su Lancet e New England Journal of Medicine, le due principali
riviste mediche internazionali, condotti in 24 Paesi e in 300 centri di tutto il mondo hanno reclutato complessivamente 7.344 pazienti, di cui la metà circa negli Stati Uniti e
in Canada, i rimanenti in Europa, America Latina, Sudafrica e Australia, con una
rappresentanza di ogni gruppo etnico, di tutti i tipi di tecnica chirurgica anche su
pazienti anziani con moderata insufficienza renale. La dose somministrata è stata per
tutti i pazienti di 2,5 mg di fondaparinux una volta al giorno per via sottocutanea.
I 4 studi sono stati svolti su tre gruppi complementari di pazienti: sottoposti a interventi
chirurgici per protesi totale dell’anca (studio PENTATHLON 2000 ed EPHESUS), a
interventi di chirurgia maggiore al ginocchio (studio PENTAMAKS) e operati per
frattura dell’anca (studio PENTHIFRA).
Il parametro primario di efficacia era rappresentato dal TEV (definito come trombosi
venosa profonda o embolia polmonare, o entrambe) valutato mediante flebografia
ascendente bilaterale delle gambe con mezzo di contrasto, l’esame raccomandato dalle
linee guida internazionali per la valutazione di nuovi farmaci antitrombotici nei pazienti
sottoposti a chirurgia ortopedica maggiore. I criteri per la valutazione della tollerabilità
sono stati le emorragie e i decessi. I pazienti sono stati seguiti fino al 49° giorno.
15
Il PENTHIFRA PLUS, un trial clinico pubblicato recentemente, ha evidenziato come
fondaparinux, nella profilassi prolungata dopo frattura d’anca ha mostrato una
significativa riduzione (p<0.001) degli eventi tromboembolici clinici (sintomatici) e
l’incidenza di tali eventi registrata dopo 4 settimane di profilassi con fondaparinux è
stata dello 0.3%, la più bassa mai vista in trials clinici.
Lo studio PEGASUS (concluso nel 2003) ha dimostrato che fondaparinux
somministrato post-operatoriamente (a 6 ore dall’intervento) è efficace almeno quanto
l’eparina a basso peso molecolare (dalteparina) somministrata pre-operatoriamente (2
ore) nella prevenzione del tromboembolismo venoso (TEV) in pazienti sottoposti a
chirurgia addominale ad alto rischio (percentuale di TEV registrate: 4.6% vs 6.1%
rispettivamente, p=0.1). Nel sottogruppo di pazienti a più alto rischio di TEV, quali
quelli oncologici (circa il 70% dei pazienti arruolati), fondaparinux ha
significativamente ridotto tale rischio (dal 7.7% al 4.7%, p=0.02). La tollerabilità dei
due farmaci è stata sovrapponibile. L’anestesia loco-regionale con cateteri peridurali a
permanenza per l’analgesia postoperatoria è stata utilizzata nel 32% dei pazienti: nessun
caso di ematoma spinale è stato riportato.
Lo studio MATISSE è la più importante ricerca mai realizzata sul trattamento
dell’embolia polmonare che ha coinvolto 2.213 pazienti in 214 centri in tutto il mondo.
I risultati, pubblicati sul New England Journal of Medicine nel 2003, dimostrano che il
fondaparinux è efficace e ben tollerato almeno quanto l’eparina somministrata per via
endovenosa nel trattamento iniziale dei pazienti affetti da embolia polmonare (EP)
sintomatica. In base ai risultati di questo studio, dunque, con fondaparinux è possibile
trattare l’embolia polmonare con un farmaco somministrabile per via sottocutanea non
appena viene diagnosticata la malattia, senza bisogno di monitoraggi o aggiustamenti
della dose.
Lo studio ARTEMIS, ricerca multicentrica internazionale su 849 pazienti, ha messo a
confronto il fondaparinux con il placebo. Concluso nel 2003, ha dimostrato che in
pazienti con patologie mediche in fase acuta (insufficienza cardiaca, patologie
respiratorie, patologie infettive/infiammatorie), il fondaparinux riduce in maniera
significativa gli eventi tromboembolici del 49.5% (p=0.029) e, soprattutto, l’incidenza
delle embolie polmonari fatali (0% vs 1.5%, p=0.029).
16
FONDAPARINUX: INDICAZIONI ATTUALI,
LINEE GUIDA ITALIANE E SVILUPPI FUTURI
Indicazioni attuali
Nell’Unione Europea fondaparinux è indicato nella “Prevenzione degli eventi
tromboembolici venosi in pazienti sottoposti a interventi di chirurgia ortopedica
maggiore degli arti inferiori, come frattura dell’anca, protesi totale dell'anca o
chirurgia maggiore del ginocchio”.
Nel novembre del 2003 fondaparinux ha ottenuto dalla Commissione Europea
l’autorizzazione all’“estensione per ulteriori 24 giorni della durata del trattamento
nella profilassi degli eventi tromboembolici venosi (TEV) in pazienti sottoposti a
interventi di chirurgia ortopedica per frattura dell’anca”.
Alla luce della nuova autorizzazione, in tutte queste indicazioni il trattamento deve
essere proseguito finché il rischio di eventi tromboembolici venosi non diminuisce,
normalmente finché il paziente non viene dimesso dall’ospedale, vale a dire almeno 5-9
giorni dopo l’intervento chirurgico.
Quest’estensione della durata della profilassi con fondaparinux permetterà ai medici di
prescrivere questa terapia fino a quattro settimane, schema terapeutico che è risultato
essere il più efficace nella prevenzione degli eventi tromboembolici venosi in pazienti
sottoposti ad interventi chirurgici per frattura dell’anca, pazienti che risultano essere a
più altro rischio di TEV. Questo fatto è stato riconosciuto dalle recenti raccomandazioni
emesse dalle principali società scientifiche di numerosi paesi europei.
Linee guida italiane
La Siset (Società Italiana per lo Studio dell’Emostasi e della Trombosi) ha appena
pubblicato (dicembre 2003 – sulla rivista Haematologica) l’aggiornamento delle linee
guida in seguito ai risultati degli ultimi studi clinici su fondaparinux. Il documento è
consultabile al sito www.siset.org.
Sviluppo clinico e nuove indicazioni
Fondaparinux è attualmente al centro dell’attenzione e in corso di studio per
ulteriori, nuove indicazioni:
Tromboembolismo Venoso (terapia della trombosi venosa profonda e dell’embolia
polmonare). A seguito dei risultati dello studio MATISSE con fondaparinux è possibile
trattare l’embolia polmonare con un farmaco somministrabile per via sottocutanea non
appena viene diagnosticata la malattia, senza bisogno di monitoraggi o aggiustamenti
della dose.
trombosi arteriosa (terapia della sindrome coronarica acuta). Attualmente sono
in corso altri studi clinici per estendere l’uso di fondaparinux nel trattamento dei
pazienti a più elevato rischio di infarto (senza sovraslivellamento) e angina instabile.
17
COS’E’ LA MALATTIA TROMBOEMBOLICA VENOSA (TEV)
La malattia tromboembolica venosa o tromboembolismo venoso (TEV) è una delle
patologie più comuni del sistema circolatorio. Nei paesi occidentali si calcola sia la
terza malattia cardiovascolare più comune, dopo la cardiopatia ischemica e l’ictus, con
un caso ogni 1.000 abitanti. Spesso è clinicamente silente e la morte improvvisa per
embolia polmonare è la prima ed unica manifestazione. È una malattia legata anche
all’età: l’invecchiamento della popolazione è perciò destinato a incrementare nei
prossimi anni il numero di casi di tromboembolismo venoso.
Le manifestazioni di questa malattia sono la trombosi venosa profonda e l’embolia
polmonare.
LA TROMBOSI VENOSA PROFONDA (TVP)
Si ha trombosi venosa profonda (TVP) quando all’interno di una vena profonda,
generalmente del polpaccio, si forma un trombo, cioè un coagulo di sangue. Questa
condizione è molto pericolosa perché può frequentemente portare all’embolia
polmonare (EP) causata dal distacco del trombo che raggiunge i polmoni, ostacola la
circolazione e può causare la morte. Nella stragrande maggioranza dei casi (90%)
l’embolia polmonare è causata dalla trombosi venosa profonda.
La diffusione
E' difficile avere dati precisi sull'incidenza della TVP nella popolazione, poiché, come
detto, nella maggior parte dei casi non dà sintomi e rimane silente per anni. Secondo
alcuni recenti studi europei il 2-3% della popolazione va incontro, nel corso della vita,
ad un episodio di TVP.
Dati più precisi sono disponibili sull’incidenza della TVP in alcune condizioni cliniche
ad alto rischio, come gli interventi di chirurgia ortopedica maggiore: protesi d’anca,
frattura d’anca, protesi del ginocchio.
Terapia
Non trattati
Antagonisti vitamina k
Eparine a basso peso
molecolare
fondaparinux
Percentuale di casi di TVP nei pazienti sottoposti a:
Chirurgia d’anca Frattura d’anca
Protesi ginocchio
54%
48%
64%
22%
24%
47%
16%
27%
31%
4%
8,3%
12,5%
Il trattamento preventivo tradizionale con antagonisti della vitamina k ed eparine a
basso peso molecolare (EBPM) abbassano sensibilmente l’incidenza di TVP, ma il
rischio rimane elevato, soprattutto per una patologia che potrebbe essere prevenuta. Per
18
questo i ricercatori hanno messo a punto un nuovo antitrombotico, fondaparinux,
completamente di sintesi, più efficace di oltre il 50% rispetto alle EBPM e con la stessa
tollerabilità, da somministrare 6 ore dopo l’intervento chirurgico.
In questo modo si può ridurre sensibilmente il rischio di emorragie e addirittura
dimezzare il rischio di trombosi venosa nei pazienti sottoposti a chirurgia ortopedica
maggiore.
Altre conseguenze della TVP
Oltre a rappresentare di gran lunga la maggiore minaccia di embolia polmonare, la TVP
determina altre manifestazioni rilevanti. Il trombo responsabile della TVP, restringendo
il flusso sanguigno all’interno della vena, causa infatti un accumulo di sangue al di sotto
del coagulo. Questo accumulo, se non curato, danneggia le valvole venose, deputate a
pompare il sangue venoso ai polmoni per la riossigenazione; in oltre il 25% dei casi può
provocare altri seri disturbi, come ulcerazioni alle gambe e sindrome post-trombotica,
una persistenza dei sintomi dovuta ai danni provocati dal coagulo alla struttura del vaso
sanguigno.
Fattori di rischio per la TVP
Sovrappeso
Familiarità
Età avanzata
Ricoveri ospedalieri
Immobilità prolungata: apparecchi gessati, ‘sindrome da classe turistica’ o da
computer (trombosi legate a lunghi viaggi aerei, o dovute alla permanenza in spazi
ridotti senza effettuare alcun movimento)
Per le donne sono importanti fattori di rischio l’assunzione della pillola
anticoncezionale e la gravidanza (in particolar modo il secondo trimestre e il
puerperio)
Interventi chirurgici
- pazienti di oltre 40 anni che subiscono un intervento di chirurgia addominale
- pazienti sottoposti ad intervento di protesi all'anca
- politraumatizzati (incidenti stradali)
- pazienti con fratture agli arti inferiori
- pazienti sottoposti a interventi chirurgici di ortopedia
Malattie
- chi soffre (o è a rischio) di altri eventi cardiovascolari gravi quali ictus cerebrale e
infarto
- chi ha problemi di stasi del sangue, che tende a non scorrere normalmente
- ipercoagulabilità (anomalie dei fattori di coagulazione)
- neoplasie maligne
19
COS’E’ L’EMBOLIA POLMONARE (EP)
L'embolia polmonare è causata dal distacco di un trombo (coagulo di sangue) a livello
venoso che raggiunge, insediandosi, i polmoni dove interrompe parzialmente l’afflusso
di sangue. Si tratta di un evento potenzialmente fatale e nel migliore dei casi
estremamente debilitante. Dopo un’embolia polmonare, oltre il 15% dei pazienti muore
entro 3 mesi. Fino al 90% dei casi di embolia polmonare è conseguenza di una trombosi
venosa profonda (TVP) e l’82% dei pazienti con EP presenta al momento della diagnosi
anche una TVP.
Incidenza
Sebbene secondo l’ISTAT non figuri attualmente fra le prime 10 cause di morte, recenti
studi internazionali pongono l’embolia polmonare al terzo posto fra le cause di morte
fra la popolazione generale, al primo nei pazienti ospedalizzati. E’ la terza causa più
comune di complicanze cardiovascolari, dopo la sindrome ischemica e l'ictus cerebrale.
In Italia si stima che l'incidenza di embolia polmonare sia di circa 69 nuovi casi per
anno su 100.000 abitanti e il tasso di mortalità precoce (entro 30 giorni dall'episodio) è
di circa 11,4% e raggiunge il 25,2% nei pazienti non trattati.
Chi è più a rischio
La frequenza di comparsa di embolia polmonare varia in relazione al trauma subìto,
all'immobilizzazione e all'età del paziente, risultando molto più alta nei pazienti anziani
con frattura dell'anca, costretti al letto per lunghi periodi di tempo e con trombosi
venosa profonda (TVP).
In questi pazienti il rischio di embolia polmonare fatale risulta pari al 25%, vale a dire
che una TVP su 4 va incontro alla grave complicanza rappresentata dall’embolia.
Per quanto riguarda la relazione tra embolia polmonare, sesso ed età, si osserva un
incremento dell'incidenza di malattia dalla seconda alla settima decade di vita con una
lieve prevalenza del sesso maschile particolarmente evidente dopo i 40 anni di età.
Dopo i 70 anni l'incidenza di malattia non si riduce realmente ma rispecchia la maggiore
difficoltà nel porre diagnosi di malattia in questa fascia di età.
20
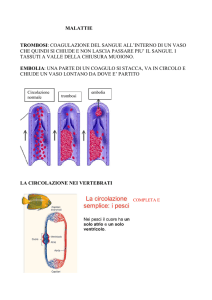
COAGULAZIONE E TROMBOSI
Quando i vasi sanguigni sono sostanzialmente sani, la complessa interazione dei
meccanismi che determinano la coagulazione si verifica solo quando necessario e cioè
in risposta a lesioni vascolari. In circostanze anomale, invece, i coaguli possono
formarsi anche spontaneamente all’interno dei vasi ostruendoli e determinando una
condizione nota come trombosi.
Differenza tra trombosi arteriosa e venosa
Mentre la trombosi arteriosa è collegata principalmente ad un aumento
dell’aggregazione piastrinica, la trombosi venosa deriva prevalentemente da
un’alterazione dei meccanismi ‘a cascata’ della coagulazione.
Nelle arterie l’ostruzione trombotica può avere conseguenze disastrose, in quanto
provoca l’infarto dei tessuti alimentati dall’arteria, come l’infarto cardiaco (occlusione
dell’arteria coronarica) o l’ictus (occlusione di arteria cerebrale).
La trombosi venosa deriva generalmente da stasi ematica (il sangue non scorre
normalmente e ristagna), lesione delle pareti vascolari (intervento chirurgico) o
ipercoagulabilità (maggiore tendenza alla coagulazione). Ciò spiega perché i trombi
venosi si formano soprattutto in zone di flusso sanguigno lento o alterato come nelle
vene profonde delle gambe.
Se non trattato, il trombo generalmente si estende lungo la vena. Si tratta della trombosi
venosa profonda (TVP). La gamba si presenta arrossata, gonfia e dolente. Dopo la
TVP – anche dopo la dissoluzione del trombo – i sintomi possono permanere a causa
del danno provocato dal coagulo alla struttura vascolare. Questa patologia è chiamata
sindrome post-trombotica ed è caratterizzata da gonfiore, dolore dell’arto, qualche
volta iperpigmentazione (la pelle appare più scura) o insorgenza di ulcerazioni alla
caviglia.
La cura della TVP si fonda su una terapia a base di anticoagulanti.
Il rischio principale è che il trombo possa anche parzialmente distaccarsi dal
rivestimento vascolare interno, formare un embolo che entrando in circolo venga portato
all’interno dell’arteria polmonare, provocando un infarto polmonare. Questa è l’embolia
polmonare (EP). Emboli di grossa entità possono provocare una massiccia occlusione
della circolazione polmonare e condurre rapidamente a sintomi gravi e al decesso. Una
volta che l’embolo si è formato, è di importanza cruciale una terapia immediata a base
di anticoagulanti.
21
Il meccanismo della coagulazione
Qualsiasi lesione della superficie interna di un vaso comporta la liberazione nel sangue
del fattore tissutale e di altre sostanze che facilitano l'adesione delle piastrine alla zona
lesionata. Si forma così un primo coagulo che ha il compito di arrestare l'eventuale
emorragia. Il fattore tissutale attiva il fattore VII, che a sua volta attiva il fattore X,
punto cruciale della ‘cascata coagulativa’ alla fine della quale, si ha la trasformazione
del fibrinogeno in fibrina, ad opera del fattore II o protrombina. La fibrina stabilizza e
rinforza il coagulo iniziale consolidandolo così in modo definitivo.
22
LA CHIRURGIA ORTOPEDICA
GLI INTERVENTI ALL’ANCA E AL GINOCCHIO
Negli Stati Uniti e in Europa, quasi due milioni di pazienti l’anno si sottopongono a
interventi di chirurgia ortopedica agli arti inferiori (anca e ginocchio). Secondo l’ultima
rilevazione negli Usa (1999, fonte AAOS - American Association of Orthopedic
Surgeons) i chirurghi hanno eseguito quasi un milione di interventi: 309.000 protesi
totale dell’anca, 340.000 protesi totale del ginocchio, 320.000 pazienti ricoverati per
frattura dell’anca. In Europa, il numero di interventi è analogo. Questa cifra aumenta
ogni anno del 4% in conseguenza dell’invecchiamento della popolazione e del
miglioramento della tecnica chirurgica. La durata di una protesi è attualmente tra 10 e
15 anni.
In Italia
L’anca è l'articolazione più fragile e quella più diffusamente sostituita con una protesi.
Nel nostro paese vengono impiantate ogni anno circa 80.000 protesi d’anca, nel 90%
dei casi in persone ultrasessantenni. Una grande percentuale del danno articolare è
dovuto alla frattura del collo del femore prevalentemente per caduta o per fragilità da
osteoporosi. La protesi inoltre è destinata a usurarsi per il continuo movimento:
ultimamente sono state realizzate protesi che possono essere sostituite senza
danneggiare l'osso una volta esaurito il loro compito. La domanda per questo tipo di
intervento è inevitabilmente destinata ad aumentare con l’invecchiamento della
popolazione.
Le protesi del ginocchio vengono impiantate in Italia dagli inizi degli anni '80. Ogni
anno nel nostro Paese si impiantano circa 85.000 protesi al ginocchio. Le cause di
usura dell'articolazione del ginocchio sono rappresentate in primo luogo dall'artrosi e
dagli esiti traumatici (molto diffusi gli incidenti stradali, in particolare da moto). Mentre
per l'anca l'età media delle persone sulle quali si interviene si sta abbassando, per il
ginocchio l'età più frequente è tra 65 e 75 anni.
I rischi di queste operazioni
Nonostante i costanti progressi e miglioramenti della tecnica e delle attrezzature
chirurgiche, non esistono operazioni prive di rischi: il principale rischio di questo tipo
di interventi chirurgici è il tromboembolismo venoso (TEV) postoperatorio. Senza
profilassi, quasi l’80% dei pazienti sottoposti a questi interventi può essere colpito dal
TEV, a seconda del tipo di intervento (come diretta conseguenza dell’intervento e della
successiva permanenza a letto). Il TEV resta infatti la causa più frequente di
riospedalizzazione e di decesso a seguito di intervento chirurgico per l’applicazione di
protesi d’anca e ginocchio. Quasi un paziente su quattro dopo un intervento chirurgico
per frattura d’anca sviluppa un episodio di TEV, nonostante la profilassi antitrombotica.
23
GLOSSARIO
Antagonista
Sostanza che tende ad annullare l'azione di un'altra sostanza, come ad esempio un
medicinale che si lega ad un recettore cellulare senza provocare alcuna risposta
biologica.
Antitrombina III (ATIII)
Inibitore naturale, lento e progressivo della trombina e di altri enzimi della
coagulazione. Circa un terzo delle eparine somministrate si legano all'ATIII, la quale
subisce allora una modificazione della propria conformazione e diventa un inibitore più
rapido della trombina, del fattore X e di vari altri enzimi della coagulazione (IX, XI e
XII). Le molecole di eparina che comprendono più di 18 saccaridi possono inibire la
trombina. I frammenti di eparina di dimensioni minori, costituiti da un numero più
basso di saccaridi, possono catalizzare l'inibizione del fattore Xa da parte dell'ATIII. Il
peso molecolare delle eparine può variare da 3.000 a 30.000 dalton. Le molecole di
grosse dimensioni vengono eliminate più rapidamente, mentre quelle di piccole
dimensioni presentano un ridotto rapporto di attività antitrombina/anti-fattore X.
Coagulazione
In fisiologia, è il processo che porta alla formazione di un coagulo di sangue. La
formazione del coagulo di sangue impedisce l'emorragia in caso di rottura della
continuità della parete vascolare.
La coagulazione è un processo sequenziale, che implica l'interazione di numerose
componenti del sangue, che vengono chiamate fattori di coagulazione. Tra i fattori
meglio conosciuti vi sono il fibrinogeno e la protrombina (fattori I e II) e la globulina
anti-emofilica (fattore VIII).
Embolia polmonare
Ostruzione dell'arteria polmonare o di una delle sue ramificazioni, provocata, il più
delle volte, da un embolo proveniente da una trombosi degli arti inferiori.
Eparina non frazionata
Un farmaco anticoagulante usato per prevenire la costituzione di trombi durante o dopo
un intervento chirurgico, in presenza di patologie cardiache, embolia polmonare o
malattie circolatorie, che comportano un aumento del rischio di formazione di trombi.
L'eparina è un gruppo eterogeneo naturale di mucopolisaccaridi ed è stata scoperta nel
1922 da W.H. Howell. È presente nei tessuti del fegato e dei polmoni dell'organismo
umano.
L'attività biologica dell'eparina dipende dalla presenza di antitrombina naturale, una
24
sostanza del plasma sanguigno che si lega ai fattori della coagulazione del siero e li
disattiva.
La maggior parte delle eparine attualmente commercializzate viene ottenuta
dall'intestino del maiale.
Eparina a basso peso molecolare (EBPM)
Le EBPM si legano alle proteine plasmatiche in misura molto minore di quanto non
faccia l'eparina non frazionata. Ciò le rende più attive sul piano biologico, anche a dosi
meno elevate e conferisce loro un'attività terapeutica maggiormente prevedibile.
Possono essere somministrate mediante un'iniezione quotidiana unica e non richiedono
alcun monitoraggio biologico. Gli studi clinici dimostrano che in varie situazioni
cliniche le eparine a basso peso molecolare sono almeno altrettanto efficaci quanto
l'eparina non frazionata, se non addirittura più efficaci.
Farmacocinetica
Studio del metabolismo e dell'azione di un farmaco, con particolare attenzione prestata
al tempo di assorbimento, alla durata dell'effetto, alla distribuzione nell'organismo ed
alla via di eliminazione del farmaco medesimo.
Fattore II
Prototrombina (proteina della cascata della coagulazione).
Fattore IIa
Fattore II attivato. Trombina (proteina della cascata della coagulazione).
Fattore X
Proteina della cascata della coagulazione.
Fattore Xa
Fattore X attivato. Proteina della cascata della coagulazione.
Fibrina
Prodotto derivante dall'attivazione del sistema di coagulazione. Si forma nello spazio
extravascolare per scissione del fibrinogeno. La fibrina è un elemento fondamentale sia
del coagulo che del trombo.
La fibrina può costituire una parte consistente dell'essudato che interviene quando una
permeabilità/lesione vascolare è sufficientemente rilevante da consentire il passaggio
nello spazio extravascolare di una molecola di grosse dimensioni, come il fibrinogeno.
Il fibrinogeno si scinde nello spazio extravascolare per formare la fibrina.
25
Incidenza
Frequenza con la quale un evento o una patologia si verificano nel corso di un
determinato periodo, in relazione alla popolazione in seno alla quale è stato/a
osservato/a tale evento o tale patologia (per es. incidenza di una malattia).
Sindromi coronariche acute
Termine che indica una serie di patologie cardiovascolari, tra cui l'infarto acuto del
miocardio, l'infarto del miocardio non Q e l'angina instabile, condizioni di cui la
trombosi coronarica costituisce la principale caratteristica comune.
Studio di fase I
Studio nel corso del quale un nuovo farmaco viene somministrato per la prima volta
all'uomo, per ottenere informazioni sulla sicurezza e sulla farmacocinetica, e per
determinare la dose tollerata.
Studio di fase IIa
Ha lo scopo di definire l’attività farmacologica del farmaco, di verificare la sua efficacia
per la patologia sulla quale dovrebbe agire il prodotto stesso e di determinare la dose
massima senza effetti collaterali e la dose attiva minima.
Studio di fase IIb
Ha lo scopo di determinare la dose ottimale in termini di efficacia e sicurezza.
Studio di fase III
Studio per valutare un nuovo trattamento su una vasta popolazione di pazienti, la sua
efficacia ed i suoi effetti secondari, di solito in comparazione con un altro farmaco.
Questo studio è finalizzato all’ottenimento dell’autorizzazione di commercializzazione.
Studio preclinico
Studio destinato a valutare un prodotto, un metodo o una qualsiasi altra terapia medica
in vitro o in vivo prima dei test sull’uomo. Lo scopo di uno studio preclinico consiste
nel raccogliere dati che consentano di valutare la tollerabilità del prodotto stesso. Gli
studi preclinici costituiscono una fase preliminare della realizzazione dei test clinici.
Trombina
Enzima che si forma nel sangue a partire dalla protrombina, reagisce con il fibrinogeno
solubile, trasformandolo in fibrina, che costituisce l'elemento base del coagulo.
Trombo
Formazione di un grumo di sangue nel lume vascolare, con ostruzione parziale o totale
della circolazione sanguigna.
26
Tromboembolismo venoso (TEV)
Patologia che consiste nella formazione di un coagulo a livello venoso, con conseguente
sopraggiungere di trombosi venosa profonda (TVP) e/o di embolia polmonare (EP). È
uno dei disturbi circolatori più frequenti, la cui incidenza nei paesi sviluppati è di un
caso su 1.000. È inoltre una causa rilevante di morbidità e di mortalità.
Trombosi arteriosa
Formazione di trombi a livello delle arterie, si verifica di solito nei vasi sanguigni
lesionati.
Trombosi venosa profonda
La trombosi venosa profonda (TVP) si verifica quando si formano dei trombi nelle vene
profonde degli arti inferiori e dell'inguine (parte inferiore dell'addome, lato interno delle
cosce). I grumi possono bloccare il flusso sanguigno diretto dagli arti inferiori verso il
cuore; è inoltre possibile che un frammento del grumo si stacchi e crei un embolo nella
circolazione sanguigna, fino ad obliterare il lume di un vaso sanguigno, bloccandone
così il flusso. I grumi di sangue che migrano fino ai polmoni (chiamati emboli
polmonari) possono risultare fatali.
27