Cuore
Prof. Loperfido
18/04/2007
11:30-13:30
Le cardiomiopatie sono malattie strettamente legate all’insufficienza cardiaca, tant’è che oggi i
pazienti che vanno incontro allo scompenso cardiaco sono sempre meno pazienti che hanno delle
valvulopatie o malattie cardiache congenite, ma sono sempre più affetti invece da malattie del
miocardio appunto.
Quando si è capito che molte condizioni patologiche cardiache dipendevano prevalentemente o
esclusivamente dal miocardio, esse hanno portato la necessità di escludere dalla definizione di
cardiomiopatie tutte le malattie per le quali era facilmente riconoscibile una causa non miocardica
iniziale di malattia. Questo durante gli anni Sessanta, quando erano per lo più prevalenti malattie
valvolari o quelle congenite; nacque l’interesse di definire a parte queste malattie nelle quali c’era
un interesse prevalente od esclusivo del muscolo cardiaco.
Definizione di “cardiomiopatie” (risalente agli anni ’60-’70): malattie che hanno come caratteristica
dominante il coinvolgimento del muscolo cardiaco. Non dovrebbero essere risultato di: malattia
ischemica, ipertensione arteriosa, malattie congenite del cuore, malattie del pericardio.
Venivano perciò escluse le malattie ischemiche; però noi sappiamo che, quando vi è un difetto di
irrorazione del cuore in acuto od in cronico, il muscolo cardiaco soffre. Quindi , alcune delle
malattie, che per definizione erano escluse all’inizio, pian piano vengono incluse nell’ambito delle
cardiomiopatie. Allora le cardiomiopatie, e soprattutto quella dilatativa, derivano da due possibili
ordini di cause: non ischemica (sempre più frequente) ed ischemica.
Fu necessario allora porre questa distinzione innanzitutto perché si iniziava proprio allora a
conoscerle e farne diagnosi tramite cateterismo cardiaco e ECOcardiografia anche in vita, mentre
prima ciò era solo appannaggio dell’anatomopatologo; e si osservava che comprendevano diverse
patologie.
Si aggiungeva, poi, già da allora, e lo si fa tuttora, al termine di “cardiomiopatia” l’attributo
“primaria” o “secondaria”, rispettivamente: condizioni in cui la causa è ignota (o non del tutto
chiara) e condizioni in cui una specifica malattia muscolare cardiaca (ben identificata) clinicamente
simula una forma primaria.
In realtà, oggi tutto questo sforzo di classificazione è stato, almeno in parte, vanificato
dall’osservazione, grazie alle nuove potenti tecniche diagnostiche, che molte forme, prima ritenute
primarie, sono in realtà secondarie ad una causa nota.
I principali tipi di cardiomiopatie, a cui si fa riferimento sono: dilatativa, che è la più frequente, in
cui il cuore si dilata, la parete muscolare si assottiglia e la funzione contrattile si riduce
notevolmente; ipertrofica, in cui il cuore ha pareti ispessite e una cavità cardiaca piccola, con un
difetto di riempimento; restrittiva, in cui c’è pure un difetto di riempimento, ma spesso associato ad
uno di svuotamento.
In ordine di frequenza si pongono: la cardiomiopatia dilatativa (92-93%); ipertrofica (6-7%);
restrittiva (1-2%).
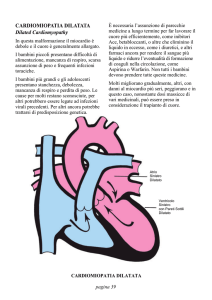
CARDIOMIOPATIA DILATATIVA
È una forma in evidente crescita, soprattutto negli anziani, e non è solo legata a cause facilmente
riconoscibili, base della cardiopatia ischemica, come l’ipertensione, il fumo o l’alcool; ci sono
invece tanti fattori che intervengono e portano, per lo più nell’anziano, allo sviluppo di questa
condizione. Possiamo definirla come un quadro anatomo-funzionale, espressione del danno
avvenuto a carico del cuore in rapporto a molti fattori, non sempre facilmente identificabili, come
fattori citotossici, come farmaci chemioterapici; fattori metabolici, come il diabete; fattori
immunologici (malattia autoimmune o importante reazione immunologia ad altro processo); fattori
familiari; fattori infettivi.
Oggi sappiamo che circa il 20% della forme di cardiomiopatia dilatativa, soprattutto giovanili,
hanno una base eredo-familiare e si cominciano a riconoscere delle alterazioni genetiche che sono la
loro causa; la trasmissione è di tipo AR e X-linked. Fino a 15 anni fa si parlava di forme familiari
solo per la cardiomiopatia ipertrofica.
Il fattore infettivo, anche se non perfettamente individuato, è possibile che sia alla base di una
cospicua porzione di forme di cardiomiopatia dilatativa non ischemica. Infine, difetti del sistema
immunitario (cellulare, umorale, HLA?) possono essere importanti elementi causali.
Il corrispettivo istologico comprende diversi tipi, ma fondamentalmente è caratterizzato, nelle
forme non ischemiche, da un danno dei miociti, piccole aree di necrosi; fibrosi interstiziale e
perivascolare (specie subendocardica); in presenza di flogosi, un’infiltrazione interstiziale di cellule
linfocitarie, macrofagiche, plasmacelluare o altre; e ipertrofia ed atrofia dei miociti.
Nell’ambito dell’eziologia della cardiomiopatia dilatativa, quindi, rientrano fattori genetici, virali,
alterazioni del sistema immunitario, iniziali o determinate e guidate da alterazioni genetiche, che
comportano la comparsa di vari epifenomeni (per le infezioni virali la miocardite, per i fattori
genetici le mutazioni del DNA) che esitano in un’alterata funzione del muscolo cardiaco e,
clinicamente, in un quadro di cardiomiopatia dilatativi non ischemica.
Questa è una malattia severa, che, qualora non sia curabile, accorcia in maniera significativa le
prospettive e la qualità di vita del paziente colpito; può anche non dare grossa sintomatologia per
lungo tempo, perciò la prognosi non è determinata solo dalla presenza della malattia, ma dalla
gravità e dalla sua evoluzione. Ci sono casi con lieve compromissione del cuore e con prospettive di
vita anche piuttosto lunghe; ci sono invece casi con gravi compromissioni del cuore, sin dall’inizio,
con prospettive di vita pessime, per i quali si deve ricorrere, se in età giovane ed in assenza di
comorbidità, al trapianto cardiaco od altre terapie sostitutive ad esso.
La biopsia endomiocardica serve per definire la situazione anatomica in questo tipo di patologie,
per confermare la diagnosi, per fare delle valutazioni di tipo prognostico o che possano indirizzare
la terapia.
Gli aspetti clinici della malattia sono quelli dello scompenso cardiaco, perciò approfonditi nelle
successive lezioni.
Con l’ECOcardiografia posso prendere un’immagine del cuore in fase finale di sistole, quando si è
contratto massimamente, ed una precedente alla sistole, cioè in fase presistolica, e confrontare i
volumi delle cavità nei due momenti e stabilire la percentuale di accorciamento del cuore, e quindi
la frazione di eiezione.
CARDIOMIOPATIA IPERTROFICA
Non è una forma di riscontro frequente; è caratterizzata da ipertrofia parietale circoscritta o diffusa
ed alterazione del rilasciamento diastolico (per lo più solo del ventricolo sx)e, in alcuni casi, da
ostruzione fissa o labile dell’efflusso ventricolare sx. E’stata riconosciuta negli anni ’60, quando,
attraverso il cateterismo cardiaco, si è visto che molti pazienti, osservati in quanto possibili portatori
di una stenosi valvolare aortica, mostravano che un gradiente di pressione sistolica significativo non
era tra ventricolo sx ed aorta, bensì nel passaggio dalla cavità centrale all’infundibolo del ventricolo
sx, cioè sotto la valvola. Perciò inizialmente questa patologia fu definita come stenosi subaortica
ipertrofica, a dire che l’alterazione era nel muscolo a livello dell’infundibolo, non nella valvola
aortica. Oggi si conosce tantissimo di più rispetto ad allora, e che non è vero che la cardiomiopatia
ipertrofica comporta un ispessimento muscolare solo subartico, ma può essere molto variabile nella
localizzazione e nella percentuale di muscolo interessata.
Ci sono forme distrettuali e, tra queste, ci sono forme sottoaortiche settali; apicali; in sedi rare,
come nella parete laterale o inferiore del ventricolo sx. Ci sono, poi, forme diffuse, univentricolari o
boventricolari, e con o senza dilatazione ventricolare. Inoltre tutte sono geneticamente trasmesse e
nel 50% dei casi in forma AD; le forme sporadiche esistono, ma sono rare e spesso dovute a
mutazioni spontanee. Sono stati riconosciuti almeno 9 geni su vari cromosomi, con 120 mutazioni
(2001) responsabili della patologia; i prodotti dei geni colpiti sono soprattutto la catena pesante
della miosina (-MyHC), la proteina C legante la miosina (My-BPC) e la troponina T cardiaca (cTnT). È importante conoscerle perché può essere molto elevato il rischio della morte improvvisa,
soprattutto nei bambini; spesso ce ne sono forme prognosticamente benevole, ma anche casi in cui
tutti i figli affetti, non solo lo sono gravemente già all’età di 1,2 o 3 anni, ma vanno anche incontro
a morte improvvisa. Si è evidenziata una stretta associazione tra il tipo genetico e l’evoluzione e la
prognosi della cardiomiopatia.
La caratteristica fondamentale della malattia non è l’ostruzione dell’efflusso, ma la difficoltà del
cuore ad accogliere il sangue e riempirsi in diastole. Perché io possa parlare di cardiomiopatia
ipertrofica in un paziente occorre escludere possibili condizioni che causano ipertrofia ventricolare
sx, come la stenosi valvolare aortica, la coartazione aortica, una grave ipertensione arteriosa, tutte
condizioni che differiscono dalla cardiomiopatia ipertrofica geneticamente trasmessa.
Dal punto di vista istologico c’è un’alterazione della struttura miofibrillare nei miociti con disordine
assoluto anche del loro orientamento e rapporto reciproco, ciò che in inglese è definito “disarray”
del tessuto muscolare; c’è poi un vario grado di fibrosi.
Quindi, sostanzialmente la cardiomiopatia ipertrofica è un ispessimento delle pareti cardiache a
vario livello e di varia entità, non giustificato da altra causa nota e riconoscibile, ma per lo più
geneticamente determinato (familiare o sporadico).
I sintomi principali sono l’angina, la sincope e la morte improvvisa, che è il problema più grande.
CARDIOMIOPATIA RESTRITTIVA (INFILTRATIVA)
La caratteristica principale è che il cuore non riesce a dilatarsi, come se fosse ristretta la cavità del
cuore, cioè non ha quel movimento di rilasciamento diastolico che permette il normale
accoglimento del sangue. Questo quadro si ha quando il muscolo cardiaco o è fortemente colpito da
processi patologici e quindi sostituito da tessuto fibrotico, o comunque è irrigidito per motivi
inerenti la sua struttura. Questa situazione perciò va differenziata sul piano diagnostico dalla
pericardite costrittiva, che comporta le stesse conseguenze, soltanto che il processo non riguarda il
miocardio, ma il pericardio.
Le possibili forme di cardiomiopatia restrittiva sono:
Miocardica: non infiltrativa (idiopatica; scleroderma)
Infiltrativa (amiloidosi; sarcoidosi)
Da deposito (emocromatosi)
Endomiocardica: Fibrosi endomiocardica
Sindrome ipereosinofila
Da tumori metastatici
Carcinoide
Terapia radiante
L’amiloidosi cardiaca è una malattia complessa, risultante dalla deposizione di proteine anomale;
dell’amiloidosi è possibile distinguere forme primarie, non infrequenti ed in qualche modo trattabili,
e forme secondarie, per produzione di proteine non immunoglobuliniche, come nell’infiammazione
cronica (tbc non trattata, forma reumatoide prolungata, etc).
Un altro quadro restrittivo sono le sindromi di endomiocardite o endomiocardiofibrosi, con
interessamento prevalentemente dell’endocardio, in cui per processi immunologico-infiammatori
una grande infiltrazione eosinofila del tessuto, associata o no ad ipereosinofilia nel sangue, porta
alla rigidità dell’endomiocardio.
L’ultimo quadro, più recentemente conosciuto, totalmente avulso dagli altri dilatativi, ipertrofici e
restrittivi, è la displasia aritmogena del ventricolo dx, ignota fino a qualche anno fa. Appariva
segnalata soprattutto in alcune regioni in Italia, cioè Puglia e Veneto; e infatti è l’Università di
Padova ad aver sviluppato la cultura di questa patologia. È caratterizzata da un muscolo ventricolare
dx sostanzialmente sostituito da adipociti o fibrocellule, perciò detta “displasia”; ciò determina
aritmie caratteristiche, anch’esse possibilmente correlate a morte improvvisa. In 1/3 dei casi è
trasmessa geneticamente con eredità AD.
MIOCARDITI
Definizione: affezioni del miocardio colpito da un processo infiammatorio spesso, ma non sempre,
di origine infettiva. L’infiammazione è caratterizzata dalla infiltrazione perivascolare ed
interstiziale di cellule immuno-competenti, e può riguardare miociti, interstizio, elementi vascolari e
spesso il pericardio. Molte miocarditi, soprattutto quelle virali, si accompagnano a pericardite,
quindi sono delle miocardio-pericarditi. Gli agenti infettivi, ma non solo, causano danno miocardico
attraverso l’invasione diretta di miociti e con conseguente miocitolisi diretta; con meccanismo
tossinfettivo, cioè con produzione di tossine dannose per i miociti; e con meccanismi immunomediati, che sono di solito i più importanti.
Soprattutto nel contesto delle malattie sistemiche, anche gli agenti non virali, o infettivi in genere,
sfruttano gli stessi meccanismi; contano soprattutto le collagenopatie.
Anche in questi casi la biopsia ha una grande importanza, con cui si possono ricavare non solo
informazioni dirette su entità ed estensione del danno (necrosi ed apoptosi), che confermano la
diagnosi e permettono di fare una prognosi; ma anche informazioni sul tipo di infiammazione in
atto, sul tipo di infiltrato. Ovviamente si fa solo in presenza di valide ragioni e non su tutti i pazienti
con sospetto di miocardite; per cui, in parte per questo, e poi per altri fattori, bisogna dire che le
miocarditi sono spesso misconosciute: o le si individua in un quadro clinico acuto e manifesto, che
desta il dubbio diagnostico di miocardite, oppure, se è una forma leggera, essa può non essere
riconosciuta o sottovalutata, per dare poi origine ad un danno serio molti anni o decadi più tardi, che
è fondamentalmente una cardiomiopatia dilatativa. Indagini elaborate, a questo punto,
eventualmente comprendenti una biopsia cardiaca, dimostrano alterazioni patognomoniche di una
datata miocardite. Le miocarditi possono essere classificate sulla base delle caratteristiche
istologiche osservabili nel miocardio, secondo i cosiddetti “Criteri di Dallas” (1987):
Miocardite attiva: miocitolisi + infiltrazione istologica
Miocardite borderline: infiltrazione cellulare senza miocitolisi
Non miocardite
Tuttavia, oggi la classificazione è più complessa; inoltre abbiamo a disposizione delle tecniche di
biologia molecolare, in particolare la PCR, con cui più facilmente si arriva alla diagnosi ed alla
tipizzazione delle miocarditi.
Le eziologie più comuni di miocardite sono: DNA e RNA virus, batteri, funghi, spirochete,
rickettsie, altre (Mycoplasma, Legionella); protozoi, alcol, sostanze varie (antracicline,
catecolamine, IF, IL2).
Le miocarditi virali sono le più frequenti, in forme sia cliniche sia subcliniche. Una forma, che più
correttamente dovrebbe essere chiamata cardiomiopatia, è quella alcolica. Oggi , sempre più
frequenti sono le forme dovute alla somministrazione delle antracicline, potenti anti-tumorali.
C’è una grande quantità di virus cardiotropi che sono alla base delle miocarditi: Enterovirus,
Herpesvirus, Coxsackievirus, ECHOvirus, Adenovirus, HIV, HCV, EBV, Mycoplasma
pneumonite, virus influenzali. Questi ultimi hanno recentemente assunto maggiore rilevanza, perché
ci sono forme di influenza annuale che danno miocarditi in misura rilevante.
Epidemiologicamente parlando, facendo un confronto con le coronaropatie, fino a qualche anno fa
le miocarditi erano considerate avere un’incidenza alquanto modesta; il quadro però ora sta
cambiando, per le novità diagnostiche e i successi terapeutici, per cui alcune forme sospette si
svelano non essere di tipo coronario, soprattutto nei giovani, quando l’inizio è improvviso, quando
la persona è apparentemente in buona salute e non ha familiarità in questo senso. In circa il 5-10%
delle persone giovani, morte per altra causa (es. trauma), ci sono dei segni all’autopsia del cuore
compatibili con la diagnosi di una precedente miocardite. Spesso in molti pazienti adulto-anziani,
che giungono con un’insuficienza cardiaca dovuta a cardiomiopatia dilatativa, eseguendo una
biopsia, si evidenziano i segni di una pregressa miocardite (c.ca 10%).
I fattori predisponenti a miocarditi virali sono riguardanti: l’ospite (caratteristiche genetiche,
immunologiche; età); l’agente infettante (cardiotropismo; virulenza); condizioni fisiologiche
(esercizio fisico; gravidanza); condizioni climatiche e stagionali.
MODELLO PATOGENETICO
Replicazione in miocardiociti
ed endotelio
Risposta immunitaria
cellulare-umorale
Guarigione
Infezione virale
Interazione genomica
Stato quiescente
Risposta cellulare
immunitaria persistente
Replicazione in miocardiociti
ed endotelio
Cardiomiopatia
Si parte dall’infezione, che porta alla replicazione dell’agente nei miocardiociti e nell’endotelio e,
sulla base dell’interazione col menoma dell’ospite, si possono avere varie evoluzioni. Una
possibilità è una reazione immunitaria immediata ed efficace cellulare e forse umorale, che porta a
guarigione; il paziente ha avuto una miocardite, anche grave, e può non essersene accorto, oppure
può essere stata riconosciuta, ma comunque guarita completamente, o con danno residuo. Ci può
essere, sempre attraverso l’interazione genomica, una replicazione persistente, che potrà portare alla
persistenza della malattia, in stato quiescente, ma che può ripresentarsi ad una nuova invasione;
oppure aversi una risposta immunitaria, soprattutto cellulare, persistente, che porta alla cardiopatia
dilatativa.
Questo si traduce in aspetti di evoluzione clinica molto diversi: possono aversi delle forme
asintomatiche, in cui non c’è stata mai alcuna evidenza che facesse sospettare di miocardite, e che si
risolvono del tutto, oppure esitano in cardiomiopatia dilatativa, soprattutto dopo anni o decadi. La
seconda possibilità sono le forme sintomatiche, che dall’inizio possono dare un’insufficienza
cardiaca, dei dolori toracici, una sincope; anche queste forme possono guarire, con adeguata terapia,
oppure esitare in una cardiomiopatia dilatativa. Poi c’è una terza forma più rara, che è quella della
miocardite fulminante, in cui il paziente va incontro a morte improvvisa.
EVOLUZIONE
Risoluzione
Asintomatica
Cardiomiopatia (miocardite cronica
con disfunzione Vsx)
Infezione
Fulminante
virale
Guarigione
Sintomatica
Cardiomiopatia (miocardite cronica
con disfunzione Vsx)
La sintomatologia è altrettanto variabile: il paziente può essere totalmente asintomatico, oppure i
sintomi in fase acuta, quando presenti, possono essere dolori, lo scompenso, le aritmie o la morte.
Visitando il paziente, chiediamo come conferme diagnostiche, di effettuare alcuni esami di
laboratorio; se un paziente ha una malattia infiammatoria, probabilmente virale, dei segni di
compromissione del cuore e, in più, dei valori alterati, tipo la VES, una sierologia per anticorpiantivirali alterata, troponine e gli altri markers di danno miocardico alti, si sostiene fortemente il
sospetto diagnostico di miocardite. Quindi le indagini di laboratorio comprendono gli indici di
flogosi (VES, proteina C reattiva, leucocitosi) e markers di miocitolisi ( CPK, CK-MB, SGOT,
LDH), tra i più specifici.
Per completezza, si ricordano le sostanze potenzialmente cardiotossiche, tra cui alcuni medicinali,
che bisogna somministrare con molta cura, soprattutto le antracicline, come la doxorubicina, ed
alcuni antibiotici.
Nell’ambito delle forme autoimmunitarie che danno un coinvolgimento cardiaco, sono rilevanti
soprattutto le collagenopatie: febbre reumatica, lupus eritematoso, artrite reumatoide, poliartrite
nodosa, granulomatosi di Wegener.
Un’aritmia frequentemente incidente in corso di miocardite è il flutter atriale (aritmia ipercinetica)
con blocco atrio-ventricolare variabile.
Si ribadisca l’utilità diagnostica dell’ECOcardiogramma in questi casi; infine la RM è un sistema
adeguato, molto efficace e a grande prospettiva attuale per fare un’analisi tissutale, anche e
soprattutto nei casi di sospetta miocardite. L’immagine fornita è simile a quella data
dall’ECOcardiografia, ma richiede l’iniezione di un mezzo di contrasto, il quale tende a
concentrarsi maggiormente in determinate aree tissutali, che poi sono quelle di necrosi o in via di
necrosi. Quindi, oggi, presumendo seriamente una miocardite, l’uso di tecniche di imaging
avanzate, come la RM, porta alla diagnosi; non lo farà né l’ECG, né la clinica con certezza, né
l’ECOcardiogramma.
Diletta Contaldo