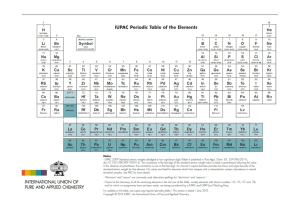
LA TAVOLA PERIODICA E IL NUOVO ORDINAMENTO
Dimitrij Ivanovich Mendeleev e Henry Gwyn Jeffreys Moseley
Mendeleev e la Tavola Periodica
Introduzione
I numerosi studi necessari per la definizione delle leggi ponderali, avevano permesso, sin dal XIX secolo, di
conoscere le molteplici proprietà e caratteristiche degli elementi. Nel 1817 il chimico tedesco J. W.
Dobereiner individuò gruppi di tre elementi, le cosiddette triadi. Nel 1860, si tenne il primo ufficiale
convegno internazionale sulla chimica, a Karlsruhe, Germania, nel quale Stanislao Cannizzaro, propose un
innovativo e preciso metodo per calcolare il peso atomico degli elementi secondo la densità del vapore.
Questa teoria raccolse numerosi consensi e si dimostrò valida. Proprio da questa, il chimico russo Dmitrij
Ivanovich Mendeleev sviluppò il pensiero che lo portò alla formulazione della legge periodica.
Biografia
Dmitrij Ivanovich Mendeleev nasce l' 8 febbraio del 1834 a Tobolsk in una antica città di provincia del
Bassopiano Siberiano Occidentale. Egli era il diciassettesimo e ultimo figlio della famiglia Mendeleev. Il
padre Ivan Pavlovic Mendeleev ricopre l'incarico di Preside del Ginnasio, mentre la madre Maria Dmitrie
vna Cornilskaja proveniva da una ricca famiglia di mercanti che impoverì all’inizio del XIX secolo. . L’anno
1834 quando il piccolo Dmitrij Mendeleev venne al mondo fu un anno molto
sfortunato per la famiglia Mendeleev. Il padre perse la vista a causa di una
cateratta e la madre, dovette sostenere tutte le difficoltà del mantenimento e
dell’educazione dei figli. Dmitrij a cinque anni sapeva leggere e scrivere bene e
all'età di 7 anni, anticipando di un anno rispetto alla consuetudine russa, si
iscrisse prima alla scuola elementare e media e successivamente al ginnasio. Gli
ultimi anni '40 furono i più drammatici nella vita famigliare di Mendeleev. Il 12
ottobre del 1847 muore il padre e nel 1849 Dimitrij completò gli studi al
ginnasio e la famiglia si trasferì a Mosca. Nel settembre dell’anno 1850 egli,che
aveva 16 anni, viene iscritto all'Istituto Pedagogico di S. Pietroburgo presso la
Facoltà di Fisica e Matematica. Più tardi dichiarò “sono molto grato all’Istituto
Pedagogico per la mia crescita scientifica e culturale”. Nel giugno del 1854
D.I.Mendeleev pubblicò in tedesco il suo primo importante lavoro dal titolo:
“Analisi chimica dell’ortite della Finlandia”. Nel 1855 fu il primo a terminare gli studi previsti dal corso
Universitario mostrando da subito talento per la chimica e una costante determinazione per lo studio e la
sperimentazione in laboratorio.Per l’eccellenza della preparazione accademica, gli viene conferita la
medaglia d’oro. Nel settembre dell’anno 1856 con il conseguimento della Laurea in Chimica ottiene il titolo
di Maghister (Master), discutendo la dissertazione “Sui volumi specifici”. Nel gennaio del 1857 Mendeleev
viene nominato il libero docente in Chimica presso l’Università di San Pietroburgo (una delle Università più
prestiggiose dell’epoca). Nel gennaio del 1859 D.I.Mendeleev viene mandato in missione per due anni in
Germania, presso l’Università di Heidelberg affinché potesse perfezionare la preparazione accademica e
scientifica in campo chimico, lavorando anche presso il laboratorio del Prof. Bunsen R.W. Si applicò
notevolmente in questo periodo e pubblicò alcuni di suoi lavori tra cui uno studio di elevato interesse
scientifico:“la scoperta della temperatura d‘ebollizione assoluta nei liquidi”. Al ritorno in Russia nel febbraio
del 1861 Mendeleev ricominciò ad insegnare Chimica Organica e allo stesso tempo pubblicò il primo libro
originale di Chimica Organica13 scritto in russo. Il testo si sviluppava su 40 pagine e fu preparato in soli 3
mesi. I principali temi affrontati erano: la legge di Avogadro-Gerhardt e le proprietà delle sostanze
organiche descritte con grande attenzione e accuratezza. Il 3 dicembre del 1876 Mendeleev viene eletto
membro della Accademia delle Scienze di San Pietroburgo. Nell’anno 1862 Mendeleev viene nominato
Docente di Chimica presso l’Università di San Pietroburgo. Contemporaneamente nel febbraio del 1863
viene eletto Professore fuori ruolo di Tecnologia Chimica, però non poté ricoprire la cattedra perche non
possedeva il titolo di Master in Tecnologia Chimica. Nel gennaio del 1864 diventò Docente di Ruolo
presso l’Universita di San Pietroburgo e pur non avendo presentato una dissertazione viene nominato
ugualmente dal Ministero dell’Istruzione Professore Ordinario dell’Università di Tecnologia Chimica. Egli
iniziò a scrivere un altro testo accademico importante sulla Chimica Inorganica e Generale, “I Fondamenti
della chimica”. La prima parte viene scritta nel 1869 la seconda nel 1871. La pausa della stesura si spiega
col fatto che Mendeleev inserisce nella seconda parte i risultati del Sistema Periodico. Terminando il servizio
all’Universita (erano 25 anni, egli ha fatto 30) chiedè le dimissioni e va in pensione. Il 22 marzo del 1890
presentò l’ultima lezione . Gli studenti non riuscivano a trattenere le lacrime sul viso. L’aula era
affollatisima. Le sue lezione avevano sempre un gran successo. Questa era la sua migliore presentazione sul
tema:”La chimica è “la lanterna magica” della scienza”. In conclusione della lezione Mendeleev
chiesé:”Per favore non accompagnate la mia ultima lezione ed il mio addio con gli applausi...”. Mendeleev
diventò il consulente scientifico del Ministero degli Affari Marittimi (1890) e ricoprì la posizione di
sovrintendente alla Camera dei pesi e delle unità di misura (1893). Nel 1906 (settembre) Mendeleev scrisse
nel suo diario:”Ho iniziato a mettere i libri e le carte in ordine. E' un'attività che mi impegna molto, in
attesa della morte, anche se ho l’aspetto gagliardo”. Il 2 febbraio del 1907 Mendeleev muore per infarto.
La scoperta del sistema periodico
Il 1 marzo del 1869 – giorno in cui è stata pubblicata la prima versione del Sistema Periodico degli elementi
- rappresenta una data importante e una nuova tappa nello sviluppo della Scienza Chimica. Ancora oggi la
Tavola Periodica degli elementi rappresenta un faro e una guida sicura per tutti gli studiosi e, in particolare
per i chimici inorganici e i radiochimici. Dopo aver determinato la massa atomica di tutti gli elementi con il
metodo di Cannizzaro, Mendeleev prese in considerazione le formule dei loro composti con l’ossigeno e con
il cloro e alcune proprietà fisiche, come la densità, la durezza e il punto di fusione. Egli ordinò i 63 elementi
conosciuti secondo la loro massa atomica crescente, disponendoli in file e incolonnandoli quando
presentavano proprietà simili. Apparve evidente che le proprietà degli elementi si ripetavano con regolarità
periodica e ordinata, per cui, tale dispozione prese il nome di Tavola Periodica degli Elementi. Il successo
del lavoro di Mendeleev è legato ad alcune intuizioni:
Aver pensato che le righe non dovessero avere tutte la stessa lunghezza;
Aver privilegiato nella disposizione degli elementi l’importanza delle proprietà chimiche, anche là
dove esse erano in contrasto con l’ordine indicato dalla massa atomica;
Aver previsto che potessero esistere elementi non ancora scoperti.
Mendeleev notò anche la presenza dei grandi Periodi specificando le differenze delle proprietà degli
elementi di uno stesso gruppo e classificandoli in due sottogruppi. Egli presentò le formule degli ossidi degli
elementi. Gli elementi vengono sistemati secondo i pesi atomici e la loro somiglianza chimica e fisica che si
è poi stabilito dipendere dalla costituzione del nucleo dell’atomo. Il cosi detto ’interno” degli atomi. Tenendo
conto degli studi fatti e delle conoscenze precise degli elementi ha capito che le misure dei certi pesi atomici
erano errati e ha dimostrato, giustamente, che occorre attribuire prioritariamente i valori alla regolarità delle
proprietà (come, per esempio, per lo iodio e il tellurio). In realtà gli elementi vengono ordinati, anziché
secondo il peso atomico, secondo il numero atomico che si è poi scoperto
che rappresenta, il numero dei protoni e degli elettroni contenuti nell’atomo
neutro ed è proprio il numero dell’atomo che determina il comportamento
chimico dell’elemento stesso. L’uso del peso atomico tiene conto del
numero dei protoni e neutroni, dove il numero dei neutroni non ha una
particolare influenza sul comportamento chimico e può variare dando luogo
a differenti isotopi. Mendeleev dovette affrontare un altro tipo di problema:
infatti, per far si che gli elementi con caratteristiche simili fossero ordinate
nelle stesse colonne oppure gruppi occorreva, in certi casi, lasciare alcune
caselle vuote. Mendeleev prevede l’esistenza di elementi di peso atomico
44, 68, 72 e ne anticipò le caratteristiche e diede loro i nomi di eka-boro,
eka-alluminio ed eka-silicio. Questa previsione fu un grande successo del
Sistema Periodico soprattutto quando, successivamente, vennero scoperti.
Nel 1875 Lecoq de Boisbaudran d’origine francese scoprì il gallio (a cui
diede un nome antico della Francia, e cioè quellodi Gallia) di peso atomico
calcolato pari a 70. Nel 1879 L. F. Nilson scoprì un nuovo elemento che chiamò scandio (dato che lo
scopritore era d’origine scandinava, il nome dell’elemento deriva da Scandinavia), di peso atomico calcolato
pari a 44,1 e, in fine, nel 1886 C. Winkler scoprì il germanio (questa voltalo scienziato era d’origine tedesca,
e il nome dell’elemento deriva dalla parola Germania) di peso atomico calcolato pari a 72. Questi elementi
rispettano e rispecchiano quelli previsti da Mendeleev. A proposito di questo fatto D. I. Mendeleev scrisse:
“La Tabella Periodica è stata la prima legge che ha permesso di “vedere” gli elementi non ancora
scoperti...” Nell’anno 1955 studiosi americani sotto la guida del Premio Nobel (1951) Glenn Th. Seaborg
hanno prodotto artificialmente un nuovo elemento a cui è stato attribuito il numero atomico 101 e a cui è
stato dato il nome di Mendelevio in onore di Mendeleev. Più tardi sono stati scoperti gli altri elementi
chimici con i numeri atomici 102, 103, 104, 105, 106 e 107. A queste scoperte,durante il periodo di
cent’anni, hanno contribuito i fisici russi anche sulla base del Sistema periodicodi Mendeleev. Ecco alcune
testimonianze sulla validità del Sistema periodico.
Il Prof. Meyer V. che fatto molti tentativi di classificazione degli elementi chimici dichiara: “confermo la
superiorità
di
Mendeleev
nella
scoperta
della
Legge
periodica”.
Il Prof. B. Brauner (Praga) afferma: “Ho scelto come scopo della mia vita disviluppare e divulgare il
Sistema
Periodico
e
tutti
i
concetti
legati
ad
esso”.
Prof. L. Malatesta e Prof. S. Cenini (Milano) ricordano che: ”Il chimico russo Mendeleev sin dal 1871,
quando, avendo osservato che le proprietà degli atomi variano in modo regolare e periodico con il crescere
del peso atomico, propose la sua celebre classificazione degli elementi”.
Henry Gwyn Jeffreys Moseley e il Nuovo ordinamento
Biografia
Henry Gwyn-Jeffreys Moseley, chimico-fisico inglese, nacque il 23 settembre
1887 a Weymouth, Dorset, in Inghilterra. Moseley proveniva da una famiglia
di scienziati : il nonno paterno fu un matematico ed il padre professore di
anatomia ad Oxford dove appunto Henry Gwyn conseguì la laurea in fisica , al
Trinity, nel 1910 . Subito dopo la laurea si trasferì a Manchester da Rutherford
dove iniziò la sua carriera studiando la radioattività del radio. Nel 1912
cominciò, in collaborazione con Charles Galton Darwin , nipote del naturalista
ed illustre cristallografo diffrattometrico, le indagini sugli spettri X. Seguirono
due anni di lavoro veramente indefesso; si può vedere in proposito l’articolo
di Darwin nel più volte citato Fifty Years , pagg. 559-563. Alla fine del 1913
ritornò ad Oxford, per motivi di famiglia, dove completò le sue ricerche (
righe di tipo L ) in un ambiente meno favorevole di quello del laboratorio di
Rutherford. Con la Prima Guerra Mondiale, Moseley, nel frattempo andato in
Australia, ritorna in patria. E' immediatamente arruolato - nonostante
Rutherford sia contrario - e viene ucciso a Gallipoli nel 1915 all’età di soli 28
anni. Non sono in pochi a pensare che, se Moseley fosse sopravvissuto alla
guerra, avrebbe certamente ricevuto il Premio Nobel, considerando
l’importanza del suo lavoro svolto nell’arco di tempo di soli 40 mesi. A
seguito della morte di Moseley, il governo britannico rinunciò per il futuro ad inviare scienziati al fronte in
tempo di guerra.
Un nuovo criterio ordinatore
Nel gruppo di Rutherford era ormai emersa l’idea che il numero atomico Z, introdotto nella tavola periodica
come semplice numero d’ordine, potesse rappresentare la carica del nucleo; Bohr proprio nel 1913 aveva
cominciato a sviluppare il suo modello dell’ atomo di idrogeno.Negli anni 1913-1914 il fisico inglese Henry
G. J. Moseley misurando la lunghezza dell’onda dei raggi X che uscivano da elementi di diversa natura
bombardati da elettroni veloci, scoprì che nell’atomo esisteva una quantità fondamentale il cui valore
aumentava regolarmente nel passare da un elemento a quello successivo della Tavola Periodica. Se, ad
esempio, due elementi creduti adiacenti nella Tavola Periodica davano origine a raggi X le cui lunghezze
d'onda differivano del doppio del previsto, fra loro doveva trovarsi un elemento ancora sconosciuto; se
differivano del triplo, gli elementi da inserire dovevano essere due. Se invece i raggi X di due elementi
adiacenti differivano della misura prevista, si poteva essere certi che fra di essi non doveva essere inserito
alcun nuovo elemento.Gli esperimenti di diffrazione di raggi X su diversi elementi avevano inoltre mostrato
che, per ogni elemento, allo spettro continuo della radiazione si sovrappone uno spettro caratteristico
costituito da un certo numero di righe: proseguendo le ricerche in questa direzione, egli riesce a ricavare una
semplice formula che correla la frequenza delle righe con il numero atomico dell'elemento emettitore, oltre a
confermare le ipotesi di Bohr. Essa è:
n = a (Z-b)2
in cui
a = 2,564 x 10-15 sec-1 è una costante ed ha le dimensioni di una frequenza, dato che (Z-b) è un numero puro
b = 1,425 è una costante e un numero puro
Z = numero atomico.
La legge è empirica (cioè non si conosce un vero modello che giustifichi questo comportamento) ma risulta
valida tanto da permettere di correlare con buona precisione Z e n. Essa permette di stabilire con estrema
esattezza il numero atomico di qualsiasi elemento e consente ad egli stesso di ritoccare in alcuni punti la
tavola
periodica
di
Mendeleev.
Questo assegna finalmente agli elementi una posizione definitiva nella tavola e a questo punto diventa
possibile assegnare un ben definito numero d'ordine ad ogni elemento: i chimici numerano quindi gli
elementi da 1 (idrogeno) a 92 (uranio). Risulterà poi che i numeri atomici sono più importanti, dal punto di
vista della struttura interna degli atomi, ben più di quanto non lo siano i pesi atomici. Grazie al lavoro dello
sfortunato talento inglese fu così definitivamente acquisito dalla chimica che la base teorica su cui in realtà
poggiava la classificazione degli elementi, andava ricercata nella carica elettrica posseduta dai nuclei e nella
conseguente struttura elettronica degli atomi. Successivamente si scoprì che dalla disposizione degli elettroni
intorno al nucleo derivava anche la spiegazione del significato chimico che il Sistema Periodico conteneva.
La configurazione elettronica degli atomi darà quindi giustificazione del raggruppamento spontaneo degli
elementi aventi proprietà analoghe e attribuirà, come vedremo, i motivi di tale comportamento alle
caratteristiche elettroniche degli atomi degli elementi stessi. Cerchiamo quindi di completare il modello
atomico definendo la posizione assunta dagli elettroni intorno al nucleo.
Fonti:
elkosta.narod.ru/mendeleev/mendeleev.htm
“Nuovo corso di Chimica” F. Tottola - A. Allegrezza - M. Rigetti
http://www.minerva.unito.it/Calleri/Call14.htm
http://venus.unive.it/chem2000/capitoli/04.htm
http://www.viandante.it/sito24/work/XIX%20secolo/1887_sc.php
Quesiti ed esercizi
1) Cos’è l’eka-silicio e qual è il suo peso atomico?
Mendeleev prevede l’esistenza di elementi di peso atomico 44, 68, 72 e ne anticipò le caratteristiche
e diede loro i nomi di eka-boro, eka-alluminio ed eka-silicio. Quest’ultimo venne poi identificato con
il nome di Germanio nel 1886 grazie allo scienziato C. Winkler.
2) Mendeleev scelse di ordinare gli elementi della tavola periodica secondo:
A- la loro massa atomica crescente
B- la loro densità
C- in ordine alfabetico
D- la loro temperatura di fusione
3) Qual è la formula ricavata da Moseley e cosa rappresenta Z?
La formula ricavata da Moseley e che conferma le precedenti ipotesi di Bohr è:
n = a (Z-b)2
Essa permette di stabilire con estrema esattezza il numero atomico di qualsiasi elemento
rappresentato nella formula da Z.
4) Henry Gwyn-Jeffreys Moseley ha vinto il premio Nobel. V F
(Se si, quando lo vinse???)
Il chimico inglese non vinse il premio Nobel. Non sono in pochi però a pensare che, se Moseley
fosse sopravvissuto alla guerra, avrebbe certamente ricevuto il Premio Nobel, considerando
l’importanza del suo lavoro svolto nell’arco di tempo di soli 40 mesi.