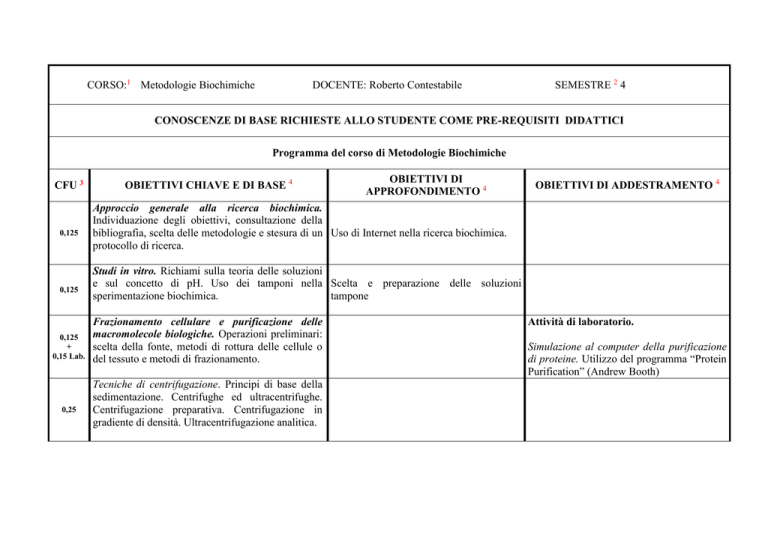
CORSO:1 Metodologie Biochimiche
DOCENTE: Roberto Contestabile
SEMESTRE 2 4
CONOSCENZE DI BASE RICHIESTE ALLO STUDENTE COME PRE-REQUISITI DIDATTICI
Programma del corso di Metodologie Biochimiche
CFU 3
0,125
0,125
0,125
+
0,15 Lab.
0,25
OBIETTIVI CHIAVE E DI BASE 4
OBIETTIVI DI
APPROFONDIMENTO 4
OBIETTIVI DI ADDESTRAMENTO 4
Approccio generale alla ricerca biochimica.
Individuazione degli obiettivi, consultazione della
bibliografia, scelta delle metodologie e stesura di un Uso di Internet nella ricerca biochimica.
protocollo di ricerca.
Studi in vitro. Richiami sulla teoria delle soluzioni
e sul concetto di pH. Uso dei tamponi nella Scelta e preparazione delle soluzioni
sperimentazione biochimica.
tampone
Frazionamento cellulare e purificazione delle
macromolecole biologiche. Operazioni preliminari:
scelta della fonte, metodi di rottura delle cellule o
del tessuto e metodi di frazionamento.
Tecniche di centrifugazione. Principi di base della
sedimentazione. Centrifughe ed ultracentrifughe.
Centrifugazione preparativa. Centrifugazione in
gradiente di densità. Ultracentrifugazione analitica.
Attività di laboratorio.
Simulazione al computer della purificazione
di proteine. Utilizzo del programma “Protein
Purification” (Andrew Booth)
Attività di laboratorio.
0,125
+
0,17 Lab
0,25
+
0,17 Lab
0,25
+
0,17 Lab.
0,25
+
0,17 Lab.
0,25
+
0,17 Lab.
Metodi basati sulla solubilità delle macromolecole.
Precipitazione frazionata con sali, con solventi, con
polimeri organici o al calore. Dialisi e
ultrafiltrazione.
Purificazione di una proteina ricombinante:
1) lisi batterica,
(NH4)2SO4 e dialisi.
Tecniche cromatografiche. Principi generali.
Cromatografia su carta, su strato sottile e su
colonna. Cromatografia d’adsorbimento, di
Tecniche
cromatografiche
ripartizione, ad esclusione molecolare, a scambio
risoluzione (HPLC e FPLC).
ionico, di affinità. Gas-cromatografia. Metodi di
rivelazione.
Tecniche
elettroforetiche.
Cenni
teorici.
Elettroforesi in fase libera e zonale. Elettroforesi a
basso e ad alto voltaggio. Elettroforesi su gel in
condizioni native e denaturanti. Focalizzazione L’Elettroforesi
isoelettrica.
Elettroforesi
bidimensionale. proteomica
Elettroforesi preparativa. Metodi di rivelazione.
Western blotting.
Tecniche
spettroscopiche.
Cenni
teorici.
Spettrofotometria nel visibile e nell’ultravioletto.
Spettrofluorimetria.
Determinazione
della
concentrazione delle proteine: metodi di Lowry, di
Bradford e del Biureto; misura dell’assorbimento
della luce nell’ultravioletto.
frazionamento
con
Attività di laboratorio.
Purificazione di una proteina ricombinante:
ad
alta
2) cromatografia a scambio cationico, analisi
del profilo di eluizione e raccolta delle
frazioni.
Attività di laboratorio.
Purificazione di una proteina ricombinante:
bidimensionale
e
la
3) analisi della proteina purificata tramite
elettroforesi su gel di poliacrilammide in
SDS
Attività di laboratorio.
Purificazione di una proteina ricombinante:
4) determinazione della concentrazione della
proteina purificata tramite il metodo di
Bradford.
Attività di laboratorio.
Tecniche enzimatiche. Chemio- regio- e
stereoselettività degli enzimi. Elementi di cinetica Misurazioni di cinetiche allo stato
enzimatica. Cinetica allo stato stazionario. prestazionario e relativa strumentazione 5) Saggi di attività enzimatica. Saggio di
Purificazione di enzimi: attività specifica e resa. utilizzata. Biosensori.
attività accoppiato; calcolo dell’attività
Dosaggio di attività enzimatiche: metodi continui,
specifica.
discontinui, accoppiati. Dosaggi spettrofotometrici,
fluorimetrici,
radioisotopici,
immunochimici.
Dosaggio di metaboliti. Studio delle interazioni
proteina-ligando. Impiego degli enzimi nei processi
biotecnologici. Enzimi immobilizzati e loro
applicazioni.
0,25
0,25
Inibizione enzimatica. Inibizione reversibile ed
irreversibile. Cenni sulla cinetica di inibizione.
Modificazione chimica. Inibizione basata sul
meccanismo d’azione degli enzimi. Inibizione
enzimatica come strumento nella ricerca biochimica
di base ed applicata. Applicazioni in agricoltura e
medicina. Esempi di importanza pratica.
Tecniche radioisotopiche. Cenni sulla teoria della
radioattività.
Rilevazione
e
misura
della
radioattività. Applicazione dei radioisotopi in
biochimica.
A.J. Ninfa e D.P. Ballau “Metodologie di base per la Biochimica e la Biotecnologia”
– Zanichelli
K. Wilson e J. Walker “Metodologia Biochimica. Le Bioscienze e le Biotecnologie in
Laboratorio” - Raffaello Cortina Editore
Libri di testo consigliati e
altro materiale didattico eventualmente disponibile
Bonaccorsi di Patti, Contestabile, di Salvo “Metodologie Biochimiche” – Casa Editrice
Ambrosiana
(I testi sono consultabili presso la Biblioteca della sede distaccata del Dipartimento
di Scienze Biochimiche in via degli Apuli, 9.)
Manuale pratico delle esercitazioni
Modalità di svolgimento dell’esame
ed accertamenti in itinere5
1
Esame orale
Nome del corso, 2 Progressione dei semestri da 1 a 6, 3 Frazione di credito formativo corrispondente all’obiettivo didattico; poiché 1 CFU
corrisponde a 8 ore di lezione frontale, gli obiettivi devono essere elencati in modo analitico e particolareggiato, con al massimo un obiettivo
corrispondente a 0,4 CFU, cioè 3 ore di lezione. 4 : la distinzione tra i vari obiettivi dovrebbe essere intuitiva per il docente ed esplicitata agli
studenti. 5 Debbono essere anonimi.







![(Microsoft PowerPoint - Norme x esami [modalit\340 compatibilit\340])](http://s1.studylibit.com/store/data/006672086_1-e4d714634554d1d8872697f43f2abb68-300x300.png)



