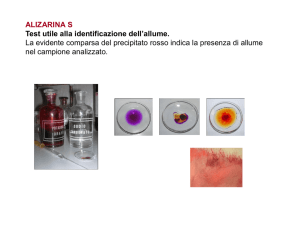
Purificazione virtuale di una proteina
Prima di iniziare leggere i seguenti paragrafi:
1. SCENARIO
Lavorate da poco in un nuovo laboratorio e avete avuto il compito di purificare una proteina nel
modo più economico possibile. Avete a disposizione tutto il materiale che vi serve. Purtroppo nel
laboratorio non c’è nessuno tranne un tecnico e il vostro tutor è dovuto partire per un congresso: in
altre parole siete soli! Dovete prendere da soli tutte le decisioni. Buona fortuna!
2. PER INIZIARE
Quando selezionerete Start dal menu, selezionate la miscela default.
Scegliete la proteina da purificare dal menu a tendina (ne avete 20 a disposizione).
Scoprirete che la proteina ha un’attività enzimatica e che è stato messo a punto un saggio specifico.
Avete a disposizione una collezione di anticorpi e sono stati selezionati 3 anticorpi monoclonali e
un anticorpo policlonale che sono specifici per la vostra proteina. Tuttavia, il tecnico presente in
laboratorio non è molto contento di prendere ordini da un nuovo arrivato e non vi darà nessun
suggerimento né vi avvertirà nel caso commettiate un errore.
Tenete presente che se perdete l’attività enzimatica, o effettuate più di 10 tappe di frazionamento o
spendete troppi soldi, verrete allontanati. Cercate di evitare questi errori.
3. STRATEGIA
Considerazioni iniziali
Non esiste una singola procedura con la quale una singola proteina può essere isolata in forma pura,
ma bisogna mettere in campo una serie di procedure ciascuna delle quali tenta di sfruttare le
caratteristiche strutturali e funzionali della proteina. Selezionando le procedure appropriate ed
applicandole in una logica sequenza di frazionamento, di solito è possibile ottenere un grado elevato
di purezza della proteina desiderata, con una resa accettabile. Non esiste un ordine standard con cui
utilizzare queste procedure per ottenere una purificazione ottimale.
Una conoscenza delle basi teoriche di ciascuna tecnica di frazionamento vi consentirà di scegliere
una sequenza di tecniche con cui tentare la purificazione. Tuttavia, lo sviluppo di un protocollo
ottimale implica un numero vario di prove per verificare l’efficacia di ciascuna tappa di
purificazione.
Indipendentemente dallo schema di purificazione adottato, è essenziale tener presente che le
proteine sono molecole delicate. L’esposizione a temperature anche moderatamente elevate, può
causare denaturazione e quindi tutte le tappe di purificazione devono essere condotte a basse
temperature (0- 4°C). Le proteine sono anche sensibili a estremi di pH, quindi le tappe di
purificazione dovrebbero essere effettuate in una soluzione tamponata (pH 7.0) e dovrebbero essere
evitati pH estremi. Infine, poiché molte proteine sono più instabili in soluzioni diluite la
concentrazione delle proteine non dovrebbe essere molto bassa.
Isolamento della proteina in forma solubile
Sebbene il programma simula la purificazione di proteine da una soluzione, il punto di partenza per
la purificazione di una proteina è di solito una coltura di cellule batteriche, vegetali o animali
oppure un particolare tessuto o organo. Sappiamo quali sono le procedure per ottenere l’estratto
grezzo, quindi considereremo che queste siano già state applicate.
Scelta del metodo di purificazione
Sono disponibili numerose procedure per purificare una proteina, alcune delle quali sono più
utilizzate rispetto ad altre. Lo schema ottimale di purificazione per una particolare proteina dipende
principalmente dalle sue caratteristiche chimico-fisiche. Di seguito sono indicate alcune linee guida
per la selezione delle tecniche ma dovreste ricordare che le condizioni di applicazioni di questi
metodi sono sempre frutto di prove ed errori.
1) Gli steps iniziali in uno schema di purificazione sono di solito quelli che hanno un basso
potere di risoluzione come la precipitazione con solfato d’ammonio o, per alcune proteine, la
denaturazione a calore. Queste procedure hanno il vantaggio di ridurre molto la quantità iniziale
di proteine totali in modo che le successive tappe di frazionamento (cromatografie) che hanno un
potere di risoluzione più elevato, possono essere applicate con più efficacia.
2) Di solito è più efficiente scegliere una serie di tecniche che sfruttano proprietà diverse
delle proteine piuttosto che ripetere una serie di tappe che sfruttano la stessa proprietà. Quindi, gli
schemi di purificazioni che utilizzano le cromatografie, di solito includono almeno una gelfiltration ed una scambio ionico.
Con il frazionamento mediante cromatografia, solitamente si sacrifica un po’ la resa per aumentare
la purezza. In altre parole non cercate di recuperare fino all’ultimo mg di proteina se questo
significa includere frazioni contenenti molte proteine contaminanti. Le frazioni da associare insieme
per le tappe successive di frazionamento dovrebbero essere scelte sulla base della massima purezza
con una resa ragionevole.
3) Un’altra importante considerazione di un processo di purificazione è il costo. Si deve
considerare sia il materiale utilizzato che il tempo impiegato. Alcune tecniche sono economiche e
veloci (solfato d’ammonio e trattamento a calore) mentre altre sono più costose e richiedono più
tempo.
Monitorare la purificazione
Ciascuna procedura di purificazione suddivide la miscela iniziale di proteine in un numero vario di
frazioni una o più delle quali conterranno la proteina d’interesse mentre altre non conterranno la
proteina d’interesse e verranno scartate. Ovviamente, per determinare quali frazioni bisogna
conservare e quali scartare dobbiamo essere capaci di rivelare e quantizzare la proteina d’interesse.
Se la proteina è un enzima, si deve disporre di un saggio specifico dell’attività enzimatica. Se
la proteina è invece un ormone, si può utilizzare un saggio di legame. Il software di simulazione
assume per semplicità che la proteina da purificare sia un enzima.
Oltre a misurare la quantità della proteina d’interesse in tutte le frazioni in ciascuna tappa di
frazionamento è anche necessario determinare la quantità di proteine totali presenti in ciascuna
frazione. Questa informazione è necessaria non solo per decidere quali frazioni utilizzare per le
tappe successive, ma anche per permettere di verificare il grado di purificazione in ciascuna tappa
e la resa in ogni tappa di purificazione.
Valutazione della purezza
All’ultimo stadio di purificazione, quando i profili delle proteine e dell’attività enzimatica nelle
frazioni coincidono potreste credere che avete purificato l’enzima.
La prova che la proteina è pura si ottiene semplicemente mediante un gel in SDS colorato con Blu
di Coomassie. Data l’elevata risoluzione di questa tecnica se il vostro campione mostra una sola
banda, potete ragionevolmente pensare che la proteina sia pura.
ADESSO SIAMO PRONTI PER INIZIARE
Andate all’indirizzo web: http://www.agbooth.com/pp_ajax/
Cliccate dal menu START from the beginning. Scegliere Default mixture. Purificherete una
proteina da una miscela di 20 proteine diverse. Scegliete il numero della proteina dal menu a
tendina.
Riportate di seguito le informazioni che appaiono nel menù a tendina:
1. Quale numero avete scelto?----------------------------------------------2. A quale temperatura e per quanto tempo l’attività dell’enzima è stabile?--------------------------------------------------------------------------------------------------------------------------------------3. A quale valore di pH la vostra proteina è stabile?......................................................................
Cliccate sul menù PAGE e scegliete 2-dimensional gel e Coomassie blue per visualizzare tutte
le proteine della miscela. Poi scegliere Immunoblot per visualizzare quale delle 20 proteine è
la vostra.
Riportate le informazioni ottenute di seguito:
4. Qual è il Peso Molecolare approssimativo della vostra proteina?--------------------------------5. Qual è il punto isoelettrico di questa proteina?------------------------------------------------------( il punto isolelettrico è il valore di pH a cui compare lo spot nell’immunoblot)
Cliccate di nuovo sul menù PAGE e scegliete Hide Immunoblot per ritornare alla pagina
principale.
Adesso avete le informazioni di base sulla vostra proteina e siete pronti per iniziare a purificarla.
Scegliete una tecnica dal menù SEPARATION per iniziare la vostra purificazione. In ciascuna
tecnica di separazione cliccare su INFO per avere più informazioni sulla tecnica e per avere un
aiuto sulla scelta dei parametri opportuni. Registrate sempre ogni parametro che scegliete in
ciascuna step di purificazione su un foglio.
Dopo aver effettuato il frazionamento virtuale vedrete una finestra di dialogo che riporta i
risultati della separazione oppure un grafico che riporta il numero di frazioni in funzione
dell’assorbimento a 280 nm.
Se si apre una finestra di dialogo dovete cliccare CANCEL se volete annullare questa tappa
oppure OK se volete salvare la tappa di purificazione.
Se ottenete un grafico, scegliete ASSAY ENZYME ACTIVTY dal menù FRACTIONS per
vedere quali frazioni contengono il vostro enzima. Potete anche verificare il progresso della
purificazione guardando il 2-D-GEL dal menù PAGE.
A questo punto dovete decidere se il metodo di separazione scelto è stato efficace.
Se non è stato efficace scegliete ABANDON THIS STEP AND CONTINUE dal menù QUIT.
Se invece volete continuare con la purificazione, scegliete POOL FRACTIONS dal menù
FRACTIONS. Compare una finestra di dialogo dove dovete indicare quali frazioni raccogliere.
Per ciascuna frazione premere ADD. Potete raccogliere fino ad un massimo di 15 frazioni.
Una volta raccolte le frazioni non potete più tornare indietro.
Dopo ogni tappa di purificazione, ricopiate l’informazione che appare nella finestra intitolata
Situation after step. Controllate anche il 2-D-GEL per verificare la purezza. Potete anche controllare
il PROGRESS REPORT nel menù HELP per controllare la resa e i costi di tutte le tappe che avete
effettuato.
OBIETTIVI DELLA STRATEGIA DI PURIFICAZIONE
Utilizzando tutto ciò che avete appreso a lezione, dopo aver imparato di più sulle tecniche e, dopo
aver effettuato prove e commesso errori, lavorate su una strategia di purificazione che rispetti
TUTTI questi criteri:
a)
b)
c)
d)
Alla fine della purificazione deve essere presente solo UNA proteina sul 2-D-Gel
Dovete effettuare al massimo 5 steps di purificazione
Dovete ottenere una resa minimo del 60%
Dovete avere un costo minore di 7 pounds/h/100U
Una volta finito, utilizzate il PROGRESS REPORT finale per rispondere alle seguenti domande
(vi può aiutare consultare i paragrafi precedenti)
6. Copiate il FINAL PROGRESS REPORT nella tabella dell’allegato A e rispondete alle
domande.
L’esercitazione può essere discussa, a vostra scelta, all’esame.
Allegato A
COGNOME-----------------------------NOME--------------------------------------------MATR………………………………………….
1. Quale numero avete scelto?----------------------------------------------2. A quale temperatura e per quanto tempo l’attività dell’enzima è stabile?--------------------------------------------------------------------------------------------------------------------------------------3. A quale valore di pH la vostra proteina è stabile?......................................................................
4. Qual è il Peso Molecolare approssimativo della vostra proteina?--------------------------------5. Qual è il punto isoelettrico di questa proteina?-------------------------------------------------------
STEP
Procedura Proteine
(mg)
Enzima
(unità)
Resa
Arricchimento Numero
dell’enzima
proteine
(%)
su 2Dgel
Costo
Iniziale
1
2
3
4
5
6. Come avete verificato la purezza dell’enzima in ciascuna tappa?
7. Che cos’è la RESA e come viene calcolata?
8. Che cosa vi dice il parametro arricchimento circa ogni tappa della vostra strategia di
purificazione?
9. Che cosa è importante nel decidere se la vostra strategia di purificazione è stata efficace?