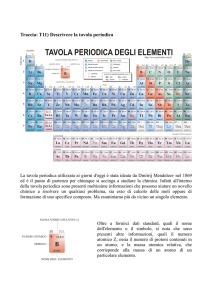
IL SISTEMA PERIODICO
LA CLASSIFICAZIONE DEGLI ELEMENTI
par.1 pag.118-119
Elementi noti all’epoca dei Romani:9
“
“ alla fine del 1700: 22
“
“ nel 1830: 55
Il primo tentativo di ordinare gli elementi conosciuti si deve a
Wolfgang Dobereiner, nella prima metà dell’Ottocento: egli rilevò che
gli elementi, a gruppi di tre (triadi), presentavano notevoli somiglianze
e che le loro proprietà variavano con gradualità (es. Cl-Br-I).
In particolare, a partire da alcune prove sperimentali, ipotizzò che la
massa atomica dell’elemento centrale della triade potesse essere la
media aritmetica delle masse atomiche degli altri due elementi.
La maggior parte degli elementi non rientrava tuttavia in alcun schema
di triade e le masse atomiche di molti elementi non erano ancora state
determinate in modo certo per poter confermare le sue previsioni.
Nel 1860 Cannizzaro risolse il problema delle masse
atomiche e, in seguito, John Newlands enunciò la legge
delle ottave, secondo la quale, ordinando gli elementi (noti)
in base alla massa atomica crescente, dopo una serie di 7
elementi, l’ottavo presentava proprietà simili al primo
elemento della serie precedente.
Disponendo gli elementi in colonne verticali di sette unità, gli
elementi simili occupavano le stesse righe orizzontali (es. Ca
vicino a Mg e K al Na).
Anche questo tentativo non ebbe tuttavia successo poiché
non tutte le righe contenevano elementi con proprietà simili.
Spetta a Lothar Meyer e a Dmitrij Mendeleev il merito di
aver individuato il criterio con cui classificare correttamente
gli elementi ma fu Mendeleev a intuire che nella costruzione
della tavola periodica era necessario prevedere l’esistenza di
elementi ancora non noti.
IL SISTEMA PERIODICO DI MENDELEEV
par.2 pag.119-120
Nel 1869 Dmitrij
Mendeleev costruì la
prima tavola periodica
degli elementi
ordinando i 63 elementi
noti, in base alla massa
atomica crescente, in file
orizzontali e lasciando
spazi vuoti per rispettare il
criterio della periodicità.
La periodicità degli elementi è la ripetizione ad
intervalli regolari di alcune proprietà chimiche
Nel 1871 pubblicò una versione aggiornata della tavola in cui gli
elementi erano ordinati in dodici file orizzontali e otto verticali secondo
la massa atomica crescente. Non comparivano i gas nobili ed erano
presenti spazi vuoti.
Dalla disposizione degli elementi ordinati secondo queste modalità si
può osservare che:
1)Le proprietà fisiche e chimiche degli elementi appartenenti a una
stessa riga (periodo) variano con gradualità.
2) Gli elementi che hanno proprietà chimiche simili appartengono a una
stessa colonna (gruppo).
Dalla lettura di questa tavola si evidenzia pertanto la periodicità degli
elementi perché al crescere della massa atomica, le loro proprietà si
ripetono in modo ciclico.
Attraverso la legge della periodicità Mendeleev determinò anche le
proprietà di elementi ancora sconosciuti e scoperti anni dopo e per i
quali aveva previsto la collocazione nella tavola lasciando degli spazi
vuoti.
LA MODERNA TAVOLA PERIODICA
par.3 pag.121-124
Gli elementi della moderna tavola periodica sono 118
Oggi si sa che le proprietà chimiche e fisiche degli elementi sono
una funzione periodica del loro numero atomico
pertanto
la moderna tavola periodica ordina gli elementi in base al numero
atomico crescente
Poiché all’aumentare di Z aumenta anche la massa, la sequenza degli elementi nei
due sistemi periodici differisce in realtà solo per poche coppie di elementi come
Ar-K, Co-Ni e Te-I (quest’ultima coppia, in base alle proprietà chimiche, era già
stata invertita da Mendeleev)
La posizione di ciascun elemento sulla tavola dipende quindi dal
suo numero atomico (Z)
Gli elementi sono organizzati, come aveva proposto Mendeleev in
gruppi e periodi
Criterio di costruzione della moderna tavola periodica
La tavola periodica è organizzata in blocchi che corrispondono agli orbitali
spdf.
Essa viene costruita disponendo gli orbitali secondo l’ordine di riempimento
in file orizzontali e, andando a capo, dopo il riempimento di ogni livello
energetico. Nei primi periodi sono lasciati spazi vuoti per permettere di
inserire nei periodi successivi (secondo l’ordine di riempimento) il blocco
degli orbitali d ed f.
Poiché ogni orbitale può contenere due elettroni, ogni orbitale viene
raddoppiato in modo da rappresentare due atomi (quello con uno e quello
con due elettroni).
Il blocco f per non essere troppo ingombrante è spostato sotto gli altri.
errato!!!
14 quadratini!!!
La moderna tavola periodica
PERIODI
La successione delle righe del sistema periodico corrisponde alla
successione dei livelli energetici dell’atomo.
Le righe orizzontali formano 7 periodi
Il numero di ogni periodo indica il livello energetico in cui si
trovano gli elettroni esterni degli elementi appartenenti a quel
periodo: coincide infatti con il numero quantico n del loro livello
più esterno.
Gli elettroni del livello più esterno sono detti elettroni di valenza
Gli elementi che appartengono allo stesso periodo presentano
gli elettroni di valenza nello stesso livello energetico.
I periodi vengono indicati con i numeri arabi
I primi tre periodi sono detti brevi periodi:
- il primo contiene elementi i cui elettroni appartengono solo al
sottolivello s (2 elementi)
- il secondo e il terzo contengono elementi i cui elettroni
appartengono ai sottolivelli s e p (8 elementi)
I periodi dal 4 al 7 sono detti lunghi periodi:
- il quarto ed il quinto contengono elementi i cui elettroni
appartengono ai sottolivelli s, p e d (18 elementi)
- il sesto ed il settimo contengono elementi i cui elettroni
appartengono ai sottolivelli s, p, d ed f (32 elementi)
GRUPPI
Gli elementi presenti nelle colonne formano i gruppi
I gruppi sono 18 di cui otto principali o gruppi A (gli elettroni
esterni occupano i sottolivelli s e p)
Essi vengono comunemente indicati con i numeri romani:
il numero del gruppo corrisponde al numero di elettroni esterni
Fra il gruppo II e il gruppo III si trovano gli elementi di
transizione o gruppi B (gli elettroni esterni occupano i
sottolivelli d)
Un secondo sistema di numerazione utilizza anche per i gruppi i
numeri arabi, in questo sistema vengono numerati tutti: i gruppi
degli elementi di transizione hanno numeri compresi tra 3 e 12.
In fondo alla tavola periodica ci sono due file di 14 elementi
metallici costituenti le serie dei lantanidi e degli attinidi (gli
elettroni esterni occupano i sottolivelli f ).
Gli elementi del I gruppo sono i metalli alcalini
Gli elementi del II gruppo sono i metalli alcalino-terrosi
Gli elementi del VII gruppo sono gli alogeni
Gli elementi dell’VIII gruppo sono i gas
nobili, così chiamati per la scarsissima
reattività dovuta alla loro configurazione
elettronica stabile: 8 elettroni nel livello
esterno (sottolivelli s e p)
Gli elementi appartenenti allo stesso gruppo
hanno proprietà chimiche e fisiche simili
perché hanno la stessa configurazione
elettronica esterna.
CONFIGURAZIONE ELETTRONICA ESTERNA
Configurazione elettronica esterna = elettroni nell’orbitale con
n più alto (cioè elettroni di valenza).
Il numero di elettroni del livello esterno corrisponde al numero
romano del gruppo (I gruppo 1 e-, II gr. 2 e-, ecc)
Es. Li, Na e K hanno tutti
1 e- nel livello esterno
(config. esterna s1) :
appartengono al I gruppo
s1
s2p6
s2
s2p1
s2p2
s2p3
s2p4
s2p5
I simboli di Lewis
pag.125
La struttura di Lewis permette di rappresentare la
struttura elettronica del guscio di valenza degli
elementi dei gruppi principali.
Il simbolo di Lewis di un elemento si scrive disponendo, attorno al simbolo
dell’elemento, un punto per ogni elettrone di valenza. Quando un atomo possiede
più di quattro elettroni, i punti si dispongono a coppie.
LE PROPRIETÀ PERIODICHE
DEGLI ELEMENTI
par.4 pag. 126
Le proprietà di un elemento dipendono dalla
configurazione elettronica esterna, pertanto, le
proprietà degli elementi variano con regolarità lungo
la tavola periodica in base alla variazione periodica
della configurazione elettronica esterna.
Sono proprietà periodiche:
il raggio atomico (proprietà fisica)
l’energia di ionizzazione (proprietà chimica)
l’affinità elettronica (proprietà chimica)
l’elettronegatività (proprietà chimica)
Raggio atomico
Il raggio atomico (Å) è la
metà della distanza minima
di avvicinamento tra due
atomi dello stesso
elemento:
- aumenta scendendo
lungo un gruppo
- diminuisce lungo un
periodo da sinistra verso
destra
pag.126-127
Fattori che determinano questo andamento:
1) Numero quantico principale n (invariato lungo il periodo, aumenta lungo
un gruppo)
2) Effetto schermante la carica positiva del nucleo, da parte degli elettroni
presenti nei livelli interni.
3) Aumento del numero atomico e quindi della carica nucleare
Scendendo lungo un gruppo:
1) Gli elettroni esterni vanno ad occupare spazi via via più lontani dal nucleo
(n aumenta)
2) Gli elettroni esterni risentono sempre meno dell’attrazione da parte del
nucleo sia per la distanza che per l’effetto schermante degli elettroni
interni
Procedendo da sinistra verso destra lungo un periodo
3) Aumenta il numero atomico e quindi la carica nucleare => aumenta
l’attrazione che il nucleo esercita sugli elettroni (ogni elettrone risente in
modo indipendente dagli altri dell’attrazione da parte del nucleo)
L’energia di ionizzazione
L’energia di ionizzazione (kJ/mol) è l’energia necessaria per
rimuovere un elettrone da un atomo isolato allo stato gassoso.
L’energia di ionizzazione aumenta lungo un periodo e
diminuisce lungo un gruppo.
Fattori che determinano questo andamento:
Scendendo lungo un gruppo:
L’Energia di ionizzazione diminuisce perché gli elettroni sono più lontani dal
nucleo => risentono sempre meno dell’attrazione da parte del nucleo sia per la
distanza che per l’effetto schermante degli elettroni interni
Procedendo da sinistra verso destra lungo un periodo
Aumenta il numero atomico e quindi la carica nucleare => aumenta l’attrazione
che il nucleo esercita sugli elettroni (ogni elettrone risente in modo
indipendente dagli altri dell’attrazione da parte del nucleo)
L’Energia di ionizzazione è l’indice della tendenza di un atomo a formare
cationi: tanto più è bassa, tanto più facilmente l’atomo perde gli elettroni
Vedi testo pag. 127-130: L’energia di ionizzazione
Vedi appunti: Formazione di CATIONI
L’affinità elettronica
L’affinità elettronica è l’energia che si libera quando un
atomo in fase gassosa cattura un elettrone.
L’affinità elettronica, come l’energia di prima ionizzazione,
aumenta lungo un periodo e diminuisce lungo un gruppo.
Fattori che determinano questo andamento:
Scendendo lungo un gruppo:
L’Affinità elettronica diminuisce perché aumentando il volume atomico, gli
elettroni da attrarre sono più lontani dal nucleo => risentono sempre meno
dell’attrazione da parte del nucleo sia per la distanza che per l’effetto
schermante degli elettroni interni
Procedendo da sinistra verso destra lungo un periodo
Aumenta il numero atomico e quindi la carica nucleare => aumenta l’attrazione
che il nucleo esercita sugli elettroni da attrarre
L’Affinità elettronica è l’indice della tendenza di un atomo a formare anioni:
tanto maggiore è l’energia liberata, tanto più facilmente l’atomo acquista elettroni
Vedi appunti: Formazione di ANIONI
L’elettronegatività
L’elettronegatività di un elemento misura la sua tendenza ad
attrarre gli elettroni di legame quando interagisce con un altro
elemento.
Gli elettroni di legame sono gli elettroni coinvolti
nell’interazione tra due atomi.
L’elettronegatività aumenta lungo un periodo, e diminuisce
lungo un gruppo.
Fattori che determinano questo andamento:
Scendendo lungo un gruppo:
L’Elettronegatività diminuisce perché aumentando il volume atomico, gli
elettroni di legame sono più lontani dal nucleo => risentono sempre meno
dell’attrazione da parte del nucleo sia per la distanza che per l’effetto
schermante degli elettroni interni
Procedendo da sinistra verso destra lungo un periodo
Aumenta il numero atomico e quindi la carica nucleare => aumenta l’attrazione
che il nucleo esercita sugli elettroni di legame
I valori dell’Energia di ionizzazione e dell’Affinità elettronica sono stati
determinati sperimentalmente.
Sono utilizzati per individuare la tendenza di un atomo isolato a formare ioni
positivi o negativi.
I valori dell’Elettronegatività sono stati determinati secondo calcoli teorici basati
sui valori delle due precedenti proprietà: esistono diverse scale, quella
maggiormente utilizzata è quella di Linus Pauling.
Sono utilizzati per prevedere il comportamento di un atomo quando interagisce
con un altro ovvero il tipo di legame chimico che si instaura tra gli atomi: i loro
elettroni di valenza sono infatti soggetti all’attrazione di entrambi i nuclei.
A differenza delle altre due proprietà, l’Elettronegatività non è una proprietà
intrinseca dell’elemento ma ha significato soltanto quando esso si combina con un
altro: gli elettroni di legame risultano spostati verso l’atomo più elettronegativo.
METALLI, NON METALLI E SEMIMETALLI
A seconda delle loro proprietà fisiche e chimiche
gli elementi si possono suddividere in metalli,
non metalli e semimetalli.
Ogni categoria occupa zone distinte del sistema periodico.
Le proprietà metalliche crescono da destra verso sinistra e dall’alto verso il
basso della tavola
Il confine tra metalli e non metalli corrisponde circa alla linea a
gradini che dal boro arriva all’astato: gli elementi di confine sono
semimetalli
I metalli sono più di 80 e occupano la parte sinistra
della tavola periodica.
Gli elementi metallici sono:
• solidi
• duri (esistono eccezioni es. mercurio (liquido), antimonio,
bismuto e manganese (duri ma friabili)
• lucenti (lucentezza metallica)
• malleabili (si possono ridurre in lamine sottili)
• duttili (si possono stirare in fili sottili)
• conducono calore ed elettricità
Le proprietà fisiche dei metalli (duttilità, malleabilità,
conducibilità elettrica e di calore) dipendono dal particolare
legame che unisce i loro atomi (legame metallico): gli elettroni
più esterni infatti, muovendosi liberamente da un atomo all’altro
del reticolo cristallino, costituiscono una nuvola elettronica che
tiene uniti saldamente gli atomi ma, contemporaneamente,
conduce l’elettricità e il calore.
Molte proprietà chimiche dei metalli dipendono dalla loro bassa E
di ionizzazione e quindi dalla loro tendenza a perdere elettroni
diventando ioni positivi:
la loro reattività è tanto più elevata quanto più l’E di ionizzazione
è bassa => diminuisce lungo il periodo e aumenta scendendo
lungo il gruppo.
I metalli di transizione e i lantanidi hanno
caratteristiche metalliche.
Gli elementi di ciascun blocco si diversificano l’uno
dall’altro per il diverso numero di elettroni contenuti,
rispettivamente, nei sottolivelli d e f ma, le loro
proprietà sono molto simili e, di tipo metallico, in
quanto determinate, essenzialmente, dagli elettroni
presenti nel sottolivello s (che ha numero quantico
principale superiore rispetto a quello degli orbitali d
e f)
Gli attinidi sono quasi tutti elementi artificiali,
instabili e radioattivi.
I non metalli occupano la parte destra in alto della
tavola periodica. Sono:
•
•
•
•
•
variamente colorati
gassosi, ma anche liquidi e solidi
cattivi conduttori di calore
cattivi conduttori di elettricità
né duttili, né malleabili
Le proprietà chimiche dei non metalli dipendono dalla loro
elevata affinità elettronica e quindi dalla capacità di accettare
elettroni diventando ioni negativi.
I semimetalli si trovano lungo il confine che separa i
metalli dai non metalli.
Non esiste accordo unanime circa la loro classificazione
Presentano comportamento metallico o non metallico
secondo l’ambiente di reazione.
• a temperatura ambiente sono solidi;
• sono semiconduttori (né conduttori né isolanti).
I semiconduttori più noti sono il
germanio e il silicio che,
opportunamente drogati (con B
e As), vengono impiegati come
componenti elettronici di
transistor e circuiti integrati.
I lettori di CD sono basati su laser a
semiconduttore, principalmente
all’arseniuro di gallio.