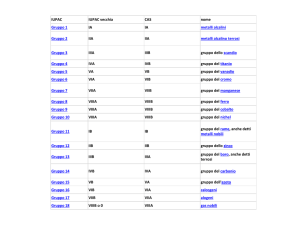
Lezione chimica 14
•proprietà periodiche,
•energia di ionizzazione,
•affinità elettronica,
•elettronegatività
proprietà periodiche
•
•
•
•
•
•
•
•
•
•
carattere metallico
numero di elettroni esterni
energia di ionizzazione
affinità elettronica
elettronegatività
raggio atomico
raggio ionico
temperatura di fusione
densità del solido
numero di legami
regole
• le proprietà periodiche variano con
continuità da sinistra a destra e
dall’alto al basso
• si ripetono simili ogni 8 elementi in
successione di numero atomico
crescente
• in ogni periodo, ciascun elemento
mostra valori intermedi tra quello
che lo precede e quello che lo segue
• si ripetono con valori simili
all’interno dei gruppi
andamento
energia ionizzazione
andamento
elettronegatività
elementi disposti in successione
per numero atomico crescente
energia di ionizzazione
energia necessaria per
allontanare un elettrone (di
prima ionizzazione) dall’atomo
aumenta
• da sinistra a destra
• dal basso all’alto
conseguenza
I metalli, con pochi elettroni periferici, li
perdono facilmente e si trasformano in
ioni positivi -cationi- ossia,
si ossidano.
Mostrano così il livello sottostante
penultimo- completo
metalli
non-metalli
Affinità elettronica aumenta
affinità
elettronica
Affinità elettronica aumenta
non-metalli
metalli
energia liberata da un atomo quando acquista un elettrone
Aumenta - da sinistra a destra - dal basso all’alto
I non metalli, con più di 4 elettroni periferici, attirano altri
elettroni per completare a 8 l’ultimo livello, si riducono e,
se riescono a strapparli ad altri atomi con affinità elettronica
Minore (i metalli), si trasformano in ioni negativi - anioni -
Elettronegatività crescente
Elettronegatività
energia con cui un nucleo attrae
gli elettroni di legame
(L. Pauling, 1932)
Elettronegatività crescente
aumenta - da sinistra a destra - dal basso all’alto
massima (4): fluoro -in alto a destraminima (0,7): francio -in basso a sinistra-
Elettronegatività e legami chimici
in un periodo (orizzontale):
aumenta da sinistra a destra
in un gruppo (verticale)
aumenta dal basso verso l’alto
la differenza di elettronegatività tra due
elementi diversi definisce il tipo di legame
chimico che si instaura tra i loro atomi
covalente puro
covalente polare
ionico