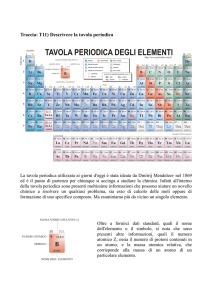
TAVOLA PERIODICA
Lo strumento principe della chimica
Storia del sistema periodico
•Nel 1869 Dmitrij Mendeleev ordinò i 63 elementi noti in base alla massa
atomica crescente, e costruì la prima tavola periodica degli elementi.
•Il calcolo delle masse atomiche si effettuava per pesata:
•
•
•
•
•
Dmitrij Mendeleev (1834-1907)
scopre che:
Le caratteristiche chimico e fisiche degli
elementi variano in maniera periodica
Si ripresentano simili ogni otto elementi
posti in successione secondo il peso
atomico crescente
periodi orizzontali lungo i quali le
caratteristiche si modificano
gradualmente
8 gruppi verticali nei quali si trovano
elementi con caratteristiche molto simili
inizialmente contava numerosi spazi
vuoti, previsti per gli elementi che
sarebbero stati scoperti in futuro, tra cui
alcuni nella seconda metà del 1900.
Classificazione degli elementi
Problema: ordinare gli elementi secondo un criterio logico
e memorizzabile
metalli
non-metalli
solidi (escluso mercurio)
lucenti (fotoelettricità)
duttili (fili)
malleabili (lamine)
buoni conduttori
ioni +
con ossigeno
danno
calore
elettricità
chimico
idrossidi (pH basico)
gassosi, liquidi, solidi
non lucenti
non duttili
non malleabili
cattivi conduttori
ioni con ossigeno danno
in acqua
in acqua
ossidi
solidi
polverosi
fisico
ossidi
gassosi
(anidridi)
acidi (pH acido)
Metalli e non metalli
TAVOLA PERIODICA MODERNA
•
•
•
•
•
•
1913: Henry Moseley propone come criterio di classificazione il numero atomico degli
elementi
vengo via via scoperti i gas nobili o inerti, con molecola monoatomica
il centinaio di elementi oggi noti sono divisi in:
8 gruppi principali (A) e
10 gruppi degli elementi di transizione (B)
i periodi sono 7, distinti in brevi e lunghi, a seconda del numero di elementi che comprendono
ogni casella viene indicata con un numero intero progressivo da sinistra a destra (numero
atomico)
riporta il simbolo dell’ elemento , il peso atomico relativo, e vari parametri chimico-fisici
periodici
gruppi
periodi
•
Esempio dei dati dell’elemento
gruppo IV
numero atomico
periodo 2
6
12,011
C
2,5
massa atomica relativa*
elettronegatività *
carbonio
1s2,2s2p2
distribuzione elettronica
dalla posizione della casella :
• numero d’ordine = numero atomico (Z) -numero protoni ed elettroni• gruppo = numero elettroni di ultimo livello
• periodo = ultimo livello
massa atomica relativa
media pesata degli isotopi dell’elemento
unità di misura: u.m.a. (1/12 isotopo 12C)
Configurazione elettronica e tavola Periodica
Proprietà periodiche
Le proprietà atomiche degli elementi dipendono dalla loro configurazione elettronica.
Le proprietà atomiche che variano in maniera ricorrente lungo ciascun periodo e
gruppo della tavola periodica sono chiamate proprietà periodiche degli elementi.
proprietà periodiche
a)
b)
c)
d)
e)
carattere metallico
energia di ionizzazione
affinità elettronica
elettronegatività
raggio atomico e raggio ionico
regole
•
•
•
•
le proprietà periodiche variano con continuità da
sinistra a destra e dall’alto al basso
si ripetono simili ogni 8 elementi in successione di
numero atomico crescente
in ogni periodo, ciascun elemento mostra valori
intermedi tra quello che lo precede e quello che lo
segue
si ripetono con valori simili all’interno dei gruppi
a) carattere metallico
• Il carattere metallico aumenta: da destra a sinistra
lungo un periodo dall’alto al basso lungo un gruppo
•I metalli sono caratterizzati da basse energie di
ionizzazione; affinità elettroniche piccole o positive;
bassa elettronegatività.
Come risultato tendono a perdere gli elettroni di valenza formando cationi
Na+
Ca2+
Al3+
•I non-metalli sono caratterizzati da elevate energie di ionizzazione; affinità
elettroniche negative e grandi; elevata elettronegatività.
-Come risultato tendono ad acquistare elettroni formando anioni monoatomici ed
ossanioni: ClBrS2NO3- SO42- ClO4-
b) numero di elettroni esterni
Gli atomi hanno al massimo 8
elettroni nel livello più esterno,
elettroni di valenza;
si definisce stato di ossidazione
il numero di elettroni ceduti (+)
o acquistati (-) nei legami.
a) energia di ionizzazione (pag. 153)
Energia di Ionizzazione (Ei) – l’energia richiesta per rimuovere una mole di elettroni da una
mole di atomi neutri in fase gassosa.
Atomo (g) → Ione+ (g) + e- ΔE = Ei > 0
Questo è un processo endotermico, che richiede che venga eseguito lavoro sul sistema.
Atomi con un basso Ei perdono
facilmente un elettrone.
Atomi con un basso Ei tendono perciò a
formare cationi.
Atomi con un alta energia di
ionizzazione tendono invece a
L’energia di 2a ionizzazione, Ei 2 corrisponde al processo:
formare anioni. E’ molto più difficile Ione+ (g) → Ione2+ (g) + 2 erimuovere un elettrone se Ei è alto.
ΔE = Ei 2 > 0 (sempre > Ei 1)
a) Affinità Elettronica
(pag. 154)
ΔE = EA1 è normalmente negativa, cioè si
Atomo (g) + e - → Ione - (g) ΔE = EA1
tratta di un processo esotermico.
• L’acquisizione di elettroni può essere sia
Affinità Elettronica dei Primi 34 Elementi:
endotermica (- EA) che esotermica (+EA).
•Gli elementi nei Gruppi 6A e 7A (alogeni) presentano alte Ei 1 ed alte EA1 negative (esotermici).
Questi elementi perdono elettroni con difficoltà, ma li attraggono fortemente. Formano con
facilità ioni negativi.
•Gli elementi nei Gruppi 1A e 2A hanno Ei 1 basse ed EA1 o lievemente negative o positive
(endotermici). Formano pertanto ioni positivi.
•I gas nobili hanno energie di ionizzazione molto alte ed affinitàelettroniche alte e positive.
Questi elementi non tendono ad acquistare ne a perdere elettroni.
a) Elettronegatività (pag.170)
UNA MISURA DELLA TENDENZA DI UN ATOMO AD ATTRARRE A SE’ ELETTRONI IN
UN COMPOSTO (N.B. QUANDO LEGATO CHIMICAMENTE)
•La scala di Pauling fu la prima scala di elettronegatività ed è quella ancora oggi maggiormente
utilizzata;
•Pauling ha definito una scala arbitraria assegnando il valore minimo (0,7) al francio e massimo
(4) al fluoro, per l’ossigeno (3,5);
•Per Pauling non è calcolabile l'elettronegatività dei gas nobili per i quali si assume il valore 0;
•l'elettronegatività aumenta dal basso verso l'alto nei gruppi e da sinistra a destra in un periodo.
a) raggio atomico e raggio ionico (pag. 154)
Misura del raggio atomico
Misura del raggio Ionico
Mappa
Concettuale