ELEMENTI MINERALI
L’organismo può immagazzinare molti minerali e di
conseguenza una diminuzione nell’apporto giornaliero
può essere compensata per un certo periodo:
l’acqua si deposita in tutto l’organismo
Il calcio si deposita nelle ossa sottoforma di apatite
Lo iodio nella tiroide sottoforma di tireoglobulina
Il ferro nel midollo, nel fegato e nella milza
sottoforma di ferritina ed emosiderina
………
In molti casi il metabolismo dei minerali viene
controllato da ormoni
ELEMENTI MINERALI
ELEMENTI MINERALI MAGGIORI
Sono solitamente presenti nei tessuti in quantità variabili da 15 g per Kg per quanto
riguarda il Ca a 0.4 g per Kg nel caso del Mg.
CALCIO
CLORO
MAGNESIO
POTASSIO
SODIO
ZOLFO
FOSFORO
ELEMENTI MINERALI PRESENTI IN TRACCE
Sono solitamente presenti nei tessuti in quantità variabili daI 20 agli 80 mg per Kg
per quanto riguarda il Fe da 0.02 a 0.1 mg per Kg nel caso del cobalto.
COBALTO
MANGANESE
RAME
MOLIBDENO
IODIO
SELENIO
FERRO
ZINCO
Elementi come NICHEL, CROMO E VANADIO hanno ruoli metabolici che si
stanno scoprendo solo adesso
CALCIO
E’ il minerale più abbondante presente nei vertebrati
Si trova principalmente nelle ossa, dalle quali può essere mobilizzato in casi di scarso
apporto
Molte delle sue funzioni sono mediate dalla proteina legante il calcio CALMODULINA e
possono essere iniziate per via ormonale tramite l’attivazione delle proteine G di membrana.
Ruolo strutturale
FUNZIONI
Messaggero intracellulare coinvolto nella regolazione di numerosi enzimi
nel muscolo:
attiva la glicogeno fosforilasi, la piruvato deidrogenasi, l’isocitrato deidrogenasi, l’achetoglutarato deidrogenasi
aumenta la degradazione del glicogeno e l’ossidazione del glucosio per provvedere alle
richieste di ATP
CONTRAZIONE MUSCOLARE
CALCIO
FUNZIONI
Nel tessuto nervoso
depolarizzazione della membrana neurale presinaptica
afflusso di calcio attraverso canali del calcio voltaggiodipendenti
fusione delle vescicole di acetilcolina con la membrana presinaptica, con rilascio di
acetilcolina
TRASMISSIONE DELL’IMPULSO NERVOSO
ALTRE FUNZIONI
coagulazione del sangue
controllo delle chiusure gap-junction tra le cellule interconnettive
adesione tra le cellule
CALCIO
ANOMALIE
Derivano da:
scarso apporto alimentare
disturbi fisiologici e metabolici
RACHITISMO = scarsa mineralizzazione delle ossa
OSTEOPOROSI = anormale riassorbimento o deposizione di Ca nelle ossa mature
IPOCALCEMIA DELLA PARTORIENTE = abbassamento dei livelli di Ca plasmatico tipico
delle femmine in allattamento
Contenuto di Ca di un bicchiere di latte rispetto ad altre fonti alimentari
1 ounce =35.274 g
1 fl oz = 33.814 g
Contenuto di Ca in fonti alimentari:
In frutta ‹ in ortaggi
Fino a 50 mg/100/g in lamponi, ribes nero
In frutta oleosa
Da 37 mg a 230 mg/100g in mandorle
FOSFORO
E’ diffuso in tutti gli organismi viventi
Svolge funzioni in più processi biochimici di ogni altro elemento minerale
Si trova per l’80% nelle ossa, dalle quali può essere mobilizzato in casi di scarso apporto
FUNZIONI
Trasduzione di energia e reazioni di ossido-riduzione a causa del suo ruolo
nei nucleotidi fosforilati ATP e GTP
Componente di acidi nucleici, fosfoproteine e fosfolipidi
Modificazione della funzione di proteine ed enzimi mediante
fosforilazione-defosforilazione (importante quella che avviene
Nelle proteine delle antenne dei fotosistemi)
modificazioni conformazionali delle proteine con modifiche di forma e/o dimensioni dei
siti attivi o siti di legame.
Esempi di processi in cui opera tale meccanismo:
trasporto di Na e fosfato attraverso il plasmalemma
controllo dell’attività enzimatica nel metabolismo del glicogeno
FOSFORO
FUNZIONI
Metabolismo degli zuccheri e dei polisaccaridi
Gli zuccheri semplici sono inerti a meno di non essere convertiti ad esteri fosfati
La prima tappa della GLICOLISI è l’attivazione del GLU a GLU-6-P
Contenuto di fosforo dei principali alimenti:
Crusca di cereali una tazza = 1540 mg
Latte in polvere scremato = 1030 mg
Germe di grano una tazza = 928 mg
Parmigiano 100 gr = 781 mg
Cacao amaro in polvere = 685 mg
Tè, in foglie = 630 mg
Farina soia = 600 mg
Fagioli borlotti, secchi crudi = 464
Noci 100 gr = 380 mg
Uovo 1 = 98 mg
GLICOLISI
FOSFORO
Olive, barbabietole rosse e vegetali a foglia sono tra i vegetali
più poveri mentre nei legumi, funghi e asparagi fino a
100mg/100g di prodotto
In frutta contenuto minore con valori che raggiungono
30-40 mg/100 g per ribes, more, avocado
50 mg per lamponi
70 mg/100 g per kiwi
Frutta oleaginosa: 300 mg/100 in nocciole e noci
FERRO
E’ presente in un gran numero di proteine animali e vegetali
In molti casi è coordinato nel gruppo prostetico EME, o Fe protoporfirina IX.
Colore rosso all’emoglobina e alla mioglobina, le proteine che legano l’O2 nel sangue e
nei muscoli, rispettivamente
Componente dei citocromi della catena respiratoria
Negli animali è trasportato dalla proteina TRASFERRINA, che media anche
l’assorbimento del Fe da parte delle cellule
E’ immagazzinato dalla FERRITINA (nelle piante FITOFERRITINA), che può
contenere un nucleo denso di idrossido ferrico.
Lo stoccaggio del ferro è fondamentale perché evita la catalisi da parte del Fe della
reazione di Fenton
Proteine ferro-zolfo
Queste biomolecole sono costitute da ca 100 metalloproteine che
contengono raggruppamenti atomici di Fe e S con differenti
stechiometrie.
Sono presenti nelle cellule di tutte le specie e probabilmente derivano
da forme di vita primitiva ma la loro versatilità ha permesso di
mantenersi come parte del metabolismo degli organismi più evoluti.
Sono importanti per:
1. Trasferimento elettronico (alcune fanno parte della catena di
trasporto mitocondriale)
2. Processi di attivazione catalitica
3. Biosensori di Fe, ossigeno, superossido e altre specie
Sono sintetizzate nei mitocondri; una volta formato il raggruppamento Fe-S
viene trasferito alle proteine incomplete.
FERRO
FUNZIONI
Alcune proteine Fe-S fanno
mitocondriale e cloroplastica
parte
della
catena
di
trasporto
Esistono almeno 6 centri Fe-S nella catena respiratoria, 5 dei quali nel
complesso della NADH deidrogenasi e almeno 1 nel complesso b-c.
Nei cloroplasti una proteina Fe-S, la FERRIDOSSINA, media il
trasferimento finale degli elettroni dal PSI alla NADP reduttasi
Anche gli enzimi aconitasi e xantina ossidasi possiedono centri Fe-S.
Nelle piante è contenuto per la maggior parte nelle foglie, e in
particolare 3/5 nelle membrane tilacoidali, 1/5 nello stroma e 1/5 è
extracloroplastico.
Rubredossine e ferrodossine
Partecipano come centri redox nella fotosintesi, nella respirazione cellulare e
altri processi
1.
Tutte queste proteine basano le loro
proprietà sulla presenza della coppia
reversibile Fe(III)/Fe(II) e di atomi di
zolfo a ponte (nFe-mS).
2.
Questi elementi si combinano generando
differenti motivi strutturali che
costituiscono il centro attivo della
metalloproteina:
a)
Rubredossine:
1Fe-0S
b)
Ferrodossine:
2Fe-2S
c)
Ferrodossine: 4Fe-4S
d)
Ferrodossine: 3Fe-4S
Ferrodossine 2Fe-2S
Vengono chiamate anche ferrodossine delle piante
perchè partecipano al processo fotosintetico.
La struttura della ferrodossina di Anabaena sp
(genere cianobatteri) contiene il nucleo centrale
del tipo Fe2(-S)2
Ogni atomo di Fe completa la coordinazione
tetraedrica legandosi a 2 cisteine
L’idrolisi acida forma H2S a spese dei ponti a
zolfo
CITOCROMI
Sono una famiglia di metalloproteine (oltre 50) contenenti il gruppo eme con i
sostituenti differenti nell’anello della porfirina, con composizione della catena
proteica variabile, come pure il modo in cui l’atomo di Fe è unito alla proteina.
Scoperti nel 1884 da McMunn e “riscoperti” da Keilin 40 anni dopo che ne
attribuì il nome (pigmenti cellulari)
A differenza della Hb, in cui Fe ha
esclusivamente il N.O. II, nei
citocromi il ferro si ossida
reversibilmente e quindi i gruppi
eme variano la loro carica formale
da +I nella forma ossidata a 0 nella
forma ridotta
Si indicano con le lettere
minuscole a, b e c assegnate
inizialmente in funzione delle loro
proprietà spettroscopiche.
Rappresentazione schematica dei componenti redox della
membrana mitocondriale che partecipano alla catena
respiratoria
Struttura della forma ridotta del citocromo c
Gruppo prostetico EME, o Fe protoporfirina IX.
Citocromo P450
Rappresenta una famiglia di metalloproteine (varie centinaia,
presenti in animali, piante, e in alcuni tipi di cellule procariote) il
cui sito attivo è costituito da una ferroporfirina.
Questa famiglia di enzimi catalizza le reazioni di idrossilazione
usando NADPH (forma ridotta della nicotinammide adenina
dinucleotide fosfato) e O2:
RH + O2 +
NADPH +
H+ → ROH + H2O +
NADP+
RH rappresenta una ampia varietà di substrati, generalmente
composti idrofobici dannosi per l’organismo (steroidi, pesticidi, etc)
che si accumulano nella membrana cellulare.
L’idrossilazione di RH a ROH rende i composti bersaglio più solubili
in acqua e quindi più facilmente eliminabili.
CITOCROMO P450
SEMINARIO 3 Maggio 2012
26
BIOTRASFORMAZIONE degli XENOBIOTICI
ASSORBIMENTO
METABOLISMO
Fase I
Xenobiotico
Xenobiotico
Metabolita
con attività diversa
Metabolita inattivo
Xenobiotico
Lipofilico
Fase II
Coniugato
Coniugato
Coniugato
E
L
I
M
I
N
A
Z
I
O
N
E
Idrofilico
Localizzazione intracellulare
Nella cellule di eucarioti è ancorato alle membrane microsomiale e
mitocondriale
Gli enzimi P450 predisposti al metabolismo degli xenobiotici si
trovano soprattutto nel reticolo endoplasmatico del fegato
Il citocromo P450 microsomiale
è legato alla membrana del
reticolo endoplasmatico tramite
la regione N-terminale
idrofobica.
•
Sistema di trasporto microsomiale del citocromo P450
•Nel reticolo endoplasmatico l’NADPH dona gli elettroni ad una
flavoproteina denominata NADPH-citocromo P450 reduttasi
• Peso molecolare di 78 kDa
• Contiene sia il FAD che l’FMN come gruppi prostetici
SUBSTRATI DEL CITOCROMO P450
Xenobiotici
Farmaci, inclusi antibiotici
Carcinogeni
Sostanze di origine vegetale
Antiossidanti
Solventi
Anestetici
Coloranti
Pesticidi
Derivanti del petrolio
Alcol
Odori
Composti di origine fisiologica
Colesterolo, Steroidi
Eicosanoidi (leucotrieni,
prostaglandine)
Acidi grassi
Idroperossidi dei lipidi
Retinoidi (vitamina A)
Acetone
Struttura ai raggi-X del citocromo P450 ricavato dal
batterio Pseudomonas putida
La struttura (1985) di questo enzima (che
catalizza la ossidazione della canfora) mostra la
presenza di 12 a-eliche e 5 foglietti
antiparalleli, ha PM 45kDa.
Il gruppo eme è unito alla proteina attraverso il
residuo Cys-357. La sesta posizione di
coordinazione sembra essere una molecola di
H2O.
Il potenziale redox, a pH 7 è –380 mV, molto più
negativo rispetto a quello del citocromo c (+ 250
mV).
FERRO
Contenuto di ferro dei principali alimenti:
Il ferro è presente sia in alimenti di origine animale (carne e pesce) che in alimenti di
origine vegetale (legumi, indivia, radicchio verde e spinaci).
Circa 1/3 del ferro assunto giornalmente deriva da verdure e ortaggi mentre minore è la
quota di assunzione dai cereali, dalla carne e dal pesce, per cui prevale la forma non-eme.
Alimento (mg/porzione)
Ferro
Fegato di suino (170 g)
30.6
Fegato di bovino (170 g)
14.9
Radicchio verde (100 g)
7.4
Spigola (300 g)
6.6
Rucola (100 g)
5.2
Prugne secche (40 g)
5.2
Tuorlo d’uovo (36 g = 2 tuorli)
3.2
Fagioli Borlotti secchi (35 g)
3.1
Cioccolato fondente (50 g)
2.5
Albicocche secche (40 g)
2.0
Spinaci surgelati (g 120)
1.2
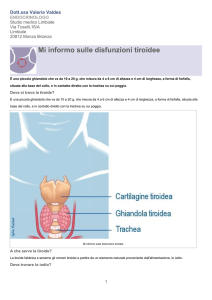
IODIO
Nell’uomo oltre il 90% è localizzato nella tiroide
Ne sono particolarmente ricche le piante marine, sebbene non sia un nutriente essenziale
per le piante
ASSORBIMENTO
La maggior parte dello iodio alimentare è assorbito come ioduro (I-)
Viene trasferito alla tiroide attraverso la circolazione sanguigna mediante un processo di
trasporto attivo associato al plasmalemma, un’ATPasi-Na+K+
Nella tiroide lo I- è convertito a radicale che reagisce con i gruppi fenilici delle tirosine
della tiroglobulina
La proteina iodinata si accumula nella tiroide
In seguito a stimolazione ormonale, la tiroglobulina iodinata si scinde nei lisosomi nei due
ormoni triiodio tironina (T3) e tetraiodio tironina o tiroxina (T4)
Le migliori fonti di iodio sono i vegetali cresciuti in terreno ricco di iodio: cipolle, latte,
pesce di mare.
IODIO
FUNZIONI
•
E’ richiesto per la sintesi degli ormoni tiroidei T3 e T4
•
La sua carenza determina
ipertiroidismo
•
Uno dei rimedi più semplici e meno costosi è appunto quello di
aggiungere iodio al comune sale da cucina
•
Incapacità della tiroide di sintetizzare gli ormoni T3 e T4 =
ipotiroidismo
un ingrossamento della tiroide = gozzo o
ALIMENTI CONTENENTI IODIO
Le migliori fonti di iodio sono il pesce di mare e
i vegetali cresciuti in terreno ricco di iodio. Si
trova nel latte e nelle uova, mentre nella carne
il suo contenuto varia molto.
IODIO
Negli animali lo iodio è richiesto per la sintesi degli
ormoni tiroidei: la triiodo tironina (T3) e la tetraiodio
tironina o tiroxina (T4)
Più del 90% dello iodio è concentrato nella tiroide.
La maggior parte dello iodio alimentare è assorbito come
ioduro (I-)
Viene trasferito alla tiroide tramite la circolazione
sanguigna
Nella Tiroide:
II° + tirosine (tiroglobulina)
proteina iodinata
T3 + T4
SELENIO
FUNZIONI
La glutatione perossidasi è l’unico enzima contenente selenio conosciuto negli animali
Questo enzima antiossidante lavora in associazione con la superossido dismutasi, la
catalasi, la vitamina E e la vitamina C.
Nei tessuti animali sono state identificate un certo numero di selenio-proteine, alcune
delle quali potrebbero essere probabili trasportatori di selenio
Negli animali molti sintomi di carenza di selenio sono legati a danni tissutali associati ad
elevati livelli di perossidi lipidici
Contenuto di selenio nei principali alimenti:
Noci brasiliane 8 = 840 mcg
Ostriche 6 = 60,1 mcg
Tonno in scatola = mcg 133 (una Scatola)
Rene di maiale (una tazza = mcg 271)
Rene di bue (una tazza = mcg 212)
(Cereali )Farina integrale una tazza (mcg 80,6 )
ZOLFO
Lo zolfo entra nella composizione di amminoacidi quali la metionina, cistina e
cisteina.
Il gruppo SH della cisteina stabilizza la struttura terziaria e quaternaria delle
proteine attraverso l’ossidazione a formare ponti disolfuro con gruppi SH
adiacenti.
L’apporto di aa solforati per la sintesi proteica può essere un fattore
limitante per la crescita delle piante e degli animali.
Si ritrova anche nei coenzimi acido lipoico e coenzima A, nelle acil carrier
proteins, nel glutatione e nelle vitamine biotina e tiamina.
I tessuti animali non sono in grado di ridurre il solfato alla forma SH
presente in molte proteine e dipendono pertanto dai composti solforati ridotti
presenti nella dieta.
I microrganismi del rumine possono comunque usare lo zolfo inorganico per la
sintesi degli amminoacidi
2
Nucleo pirimidinico Nucleo tiazolico
BIOTINA VITAMINA H
E’ una vitamina idrosolubile che si trova
in uova, fegato, lieviti, cereali, latte e
prodotta dalla microflora intestinale per
cui la sua deficienza è rara. Funziona da
coenzima nelle reazioni di trasferimento
dei gruppi carbossilici. Inoltre la biotina
può avere funzioni nella sintesi di
proteine in particolare della cheratina.
La biotina si ritrova in natura sia legata ad un amminocido, normalmente la
lisina. Negli animali viene assorbita facilmente dall’intestino tenue in entrambe
le forme. Molte proteine che legano la biotina sono prodotte dai microorganismi
per esempio la streptavidina e la stravidina dal Saccharomyces avidinii.
L’albume contiene una proteina simile, l’avidin. La somministrazione con la
dieta rifortemente la disponibilità di biotina presente nella dieta
apparentemente impedendo l’assorbimento da parte delle mucose intestinali. La
sua deficienza può essere indotta in molti animali nutrendoli con albume crudo.
Sintomi di carenza:ritardo della crescita, dermatiti, perdita di peli e disturbi a
carico del sistema nervoso.
VEGETALI
glutatione
Reazione di riduzione
Metionina ecc
….un esempio
AGLIO (Allium sativum; Liliacee)
PROPRIETA’
Attività antimicrobica
Effetto sul metabolismo lipidico
Azione anti-aggregante piastrinica
Azione antitrombotica per l’ajoene.
capacità di ridurre il rischio di infarto o di
prevenzione contro il cancro non ancora del tutto
comprovata.
AGLIO (Allium sativum; Liliacee)
L’allicina (sulfossido della cisteina) è il componente più importante che si
ottiene per spremitura dal bulbo.
L’allicina non è presente nell’aglio integro ma viene prodotta dal precursore alliina per azione
dell’enzima alliinasi che si libera dai tessuti del bulbo quando esso viene schiacciato. Sia alliina che l’
alliinasi sono stabili in assenza di acqua. L’aglio essiccato libera l’allicina nel momento in cui viene a
contatto con l’acqua. L’allicina è sensibile al calore o ai solventi organici e si degrada per dare:
solfuri diallilici (mono-,di- ed oligo-solfuri), vinilditiine, ajoeni
AGLIO (Allium sativum; Liliacee)
Le preparazioni a base di aglio contengono una miscela di composti
solforati.
Quelli utilizzati in terapia medica comprendono oli ottenuti per distillazione in
corrente di vapore, aglio macerato in oli vegetali (in olio di soia), aglio essiccato
e polverizzato e sospensioni gelificate di polvere d’aglio. La natura e la % dei
costituenti nelle diverse preparazioni sono soggette a notevoli variazioni:
Spicchi d’aglio freschi schiacciati contengono generalmente allicina (0.4% circa)
ed altri tiosulfinati (0.1% circa, di cui la maggior parte è allilmetiltiosulfinato).
La polvere essiccata fornisce una minore quantità di tali prodotti.
Le polveri macerate in olio perdono fino all’80% dei composti solforati e
contengono soprattutto vinilditiine e ajoeni.
L’olio d’aglio ottenuto per distillazione in corrente di vapore contiene dialch(en)il
solfuri (come il diallilsolfuro, allilmetilsolfuro ecc.) quali principali componenti
solforati (0.1-0.5%).
Il cattivo odore nell’alito e nel sudore, spesso provocato da ingestione di aglio, sia
a scopo medicinale che gastronomico, è dovuto all’allilmetil solfuro e disolfuro al
diallil solfuro e disolfuro ed al 2-propenetiolo.
AGLIO (Allium sativum; Liliacee)
I sulfossidi della S-alchilcisteina sono componenti caratteristici delle cipolle. Tutte le
specie di Allium contengono tali prodotti anche se gli S-propil analoghi predominano
nell’erba cipollina (Allium schoenoprasum), l’S-1-propenil derivato nelle cipolle (A.
cepa) e l’S-allil composto (alliina) nell’aglio.
MAGNESIO
Il Ca, il P e il Mg sono considerati i “costruttori delle ossa” poiché sono
necessari in gran quantità per formarli.
Il Mg è un componente minore delle ossa (0.5-0.7 mg per Kg di osso) e
in tale forma rappresenta circa il 60-70 % del Mg presente nell’intero
organismo. Il restante Mg si ritrova nei tessuti molli.
La richiesta di Mg non è assoluta perché può essere sostituito dal Mn o
un altro catione bivalente.
Il Mg agisce come controione degli acidi nucleici che in condizioni
fisiologiche esistono come polianioni, pertanto il Mg può influenzare la
trascrizione del DNA a mRNA e la traduzione dell’mRNA a proteina
stabilizzando la struttura ribosomiale e attivando il trasferimento degli
aa dagli amminoacil tRNA al polipeptide nascente.
Quasi tutto l’ATP e l’ADP presente nelle cellule si
ritrova complessato con il Mg.
Durante le reazioni enzimatiche di fosforilazione il Mg
forma un ponte fra il pirofosfato dell’ATP e la molecola
dell’enzima ed abbassa l’energia di attivazione della
reazione.
SODIO, CLORO, POTASSIO
Questi tre elementi rappresentano i maggiori elettroliti dei
fluidi fisiologici. Il Sodio rappresenta oltre il 90% dei cationi
totali ed il Cl oltre il 65% degli anioni ematici. Il K è il
principale catione intracellulare. La pressione osmotica dei liquidi
intra ed extracellulari può essere profondamente alterata da
entrate ed uscite eccessive di uno o più di questi ioni.
Conc intrac.
mM
Na+
K+
Cl-
5-15
140-145
5-15
Conc. Extrac.
mM
145-150
5-10
110-115
Il movimento del Na attraverso le membrane cellulari è richiesto
per la trasmissione di impulsi nervosi e per l’assorbimento dei
nutrienti dal tratto digerente e nelle cellule.
La depolarizzazione e la ripolarizzazione delle membrane
neuronali coinvolgono il rapido ingresso di Na attraverso i
canali del Na voltaggio dipendenti.
Nel tratto digerente il Na che è presente in alte
concentrazioni nei fluidi digestivi è cotrasportato con i
monosaccaridi e gli amminoacidi attraverso le
plasmamembrane delle cellule circostanti il lume
dell’intestino tenue.
Cobalto
Tutte le funzioni conosciute del
cobalto sono legate al suo ruolo
come componente della vitamina
B12
VITAMINA B12
Ha la struttura più complessa di tutte le
vitamine. Il termine B12 viene usato per un
gruppo di composti caratterizzati dalla
presenza di un anello tetrapirrolico in cui
l’atomo di N interno di ciascun anello
pirrolico è coordinato ad un singolo atomo
di cobalto. La forma commerciale è la
cianocobalamina che sebbene presente in
natura non è una forma importante della
vitamina.
Nei microorganismi la 5’-deossiadenosil
cobalamina è coinvolta in un gran numero
di reazioni di riarrangiamento. Negli
animali avviene un solo tipo di queste
reazioni ed è la conversione del
metilmalonil-CoA a succinil-CoA. Questa
reazione è una via utile attraverso la quale
il propionato derivato dall’ossidazione degli
acidi grassi con un numero dispari di atomi
di C e dal catabolismo degli aa può essere indirizzato verso la sintesi del glucosio (gluconeogenesi).
E’ importante nei ruminanti in cui poco o niente del glucosio alimentare viene assorbito dal tratto digerente
e il rifornimento di glucosio è dipendente dalla gluconeogenesi.
Anche il passaggio da omocisteina a metionina la metilcobalamina agisce come trasportatore di un gruppo
metilico.
Manganese
Può sostituirsi al magnesio in molte delle sue
funzioni
Una carenza di manganese può portare ad
anomalie delle ossa e delle articolazioni per il ruolo
delle glicosiltransferasi nella sintesi della matrice
ossea e della cartilagine.
Nelle piante la biosintesi dei terpenopidi può
essere influenzata dalla sua carenza perché può
essere richiesto dall’enzima: farnesil pirofosfato
sintetasi.
SESQUITERPENI
(DMAPP)
(IPP)
(GPP)
Farnesil pirofosfato sintasi
Mn++
(FPP)
Zinco
Lo zinco negli esseri viventi
Zn è un elemento essenziale per la crescita e lo sviluppo di tutte le forme di vita.
Il corpo umano ne contiene 23 g/70 kg e richiede 1020 mg nella dieta
giornaliera
Si trova ampiamente distribuito nel regno vegetale e animale.
Si assorbe attraverso meccanismi di diffusione passiva come pure attraverso
proteine di trasporto
Una volta nel sangue, la principale
proteina di trasporto presente
nel siero, l’albumina, lega ca. 2/3
del metallo presente mentre la
rimanente viene legata dalla a2macroglobulina
La maggior parte dello Zn
assorbito si trova all’interno
delle cellule.
Distribuzione schematica dello zinco nelle cellule
Quasi tutte le cellule contengono lo zinco: la sua conc. varia ampiamente (da
10-9 M nel citoplasma a 10-3 M in alcune vescicole).
P = proteina; ZRT = proteina di
trasporto
MT = metallotioneina
Metallo enzimi dello zinco
Enzimi contenenti Zn sono oltre 200. Nei suoi enzimi il metallo può
svolgere:
Funzione catalitica: quando lo ione Zn2+ è implicato direttamente
nella catalisi e la sua eliminazione determina la perdita dell’attività
enzimatica
Funzione cocatalitica: quando sono necessari 2 o 3 metalli perché
l’enzima esplichi la sua funzione e lo Zn occupa una posizione molto
vicina ad un altro centro metallico con il quale è unito con un ponte
formato da un solo aa oppure attraverso una molecola di H2O
Funzione strutturale: quando lo ione è necessario per mantenere
la struttura terziaria e, frequentemente, la quaternaria
dell’apoenzima.
Proteine di Zn implicate nella regolazione dell’espressione
genica
E’ nota da tempo l’esistenza di zinco proteine che riconoscono sequenze specifiche di
basi del DNA e partecipano a processi di regolazione e trascrizione.
Sono dette anche fattori di trascrizione e alcune di esse contengono motivi
strutturali chiamati “zinc finger” (dita di zinco) per il fatto che possono inserirsi nel
solco della doppia elica del DNA come fossero delle dita.
Ciò è dovuto alla possibilità che hanno gli ioni metallici di formare legami trasversali
all’interno di una stessa proteina. Per esempio, in una struttura tipica contenente 25-60
aa (formata da un foglietto antiparallelo seguito da una a elica), lo Zn è coordinato a
due residui di cisteina e due di istidina, generando una geometria tetraedrica distorta
del tipo [ZnS2N2].
Lo ione Zn consente solo a piccoli tratti della
catena polipeptidica di ripiegarsi in forma di
unità stabili, capaci di interagire con gli acidi
nucleici
Interazioni di una proteina “zinc finger” con
frammenti di DNA