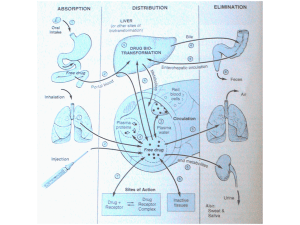
METABOLISMO
Il Metabolismo dei Farmaci è un processo
di biotrasformazione che ha lo scopo di
modificare all’interno dell’organismo la
struttura dei farmaci, per facilitarne
l’escrezione (le sostanze sono rese più
polari e idrosolubili) ma può anche renderli
più attivi (trasformazione da profarmaco a
farmaco)
Xenobiotico-(farmaco)
Idrofilo
Molto lipofilo
ACCUMULO NEI
GRASSI
Lipofilo
Polare
BIOTRASFORMAZIONI DI FASE I:
Ossidazione Riduzione Idrolisi
Polare
BIOTRASFORMAZIONI DI FASE II:
Coniugazioni
Idrofilo
MOBILIZZAZIONE EXTRACELLULARE
ESCREZIONE
BILIARE
SANGUE
ESCREZIONE RENALE
Farmaci non metabolizzati
ES.
C2H5C2H5
Barbital
Ether
Farmaco inattivo (Profarmaco)
Biotrasormazione
Farmaco Attivo
Il metabolismo dei farmaci si attua
attraverso due fasi:
• Fase I, chiamata anche fase di
funzionalizzazione
• Fase II, chiamata anche fase delle
reazioni di coniugazione o di sintesi
Profarmaco
Esempi di farmaci inattivi che formano metaboliti attivi, di farmaci
e/o veleni non tossici che formano metaboliti tossici
Significato attribuibile alle fasi del metabolismo
Ossidazioni
Si dividono in microsomiali e non microsomiali
Le microsomiali che
principalmente
concernono il
metabolismo dei
farmaci sono:
•Ossidazione alifatica
•Ossidazione aromatica
•N-ossidazioni
•S-ossidazioni
•Ecc.
Le non microsomiali
che principalmente
concernono il
metabolismo dei farmaci
sono:
•Alcool-deidrogenasi
•Aldeide-deidrogenasi
•Monoaminoòossidasi
(MAO)
•Xantino-ossidasi
Enzimi microsomiali
• Gli enzimi microsomiali mancano di
specificità: sono in grado di metabolizzare
sostanze con struttura chimica assai
differente.
• Essi catalizzano reazioni riguardanti
composti liposolubili e mantengono la loro
attività solo se associati alle loro strutture
La maggior parte del metabolismo ossidativo
degli xenobiotici è catalizzata dal sistema
enzimatico P450
La superfamiglia del citocromo P450
Il citocromo P450 è presente in numerose forme
isoenzimatiche caratterizzate da una diversa
struttura peptidica.
Mediante tecniche di DNA ricombinante si è giunti
ad identificare l'esistenza di una superfamiglia del
citocromo P450 costituita da numerosissime famiglie
codificate da più di 300 geni diversi, che si sono
evoluti da un unico gene ancestrale comparso da
oltre circa 2000 milioni di anni.
Il corredo e l’attività enzimatica nell’uomo è spesso diversa
dall’animale da laboratorio e sono riconoscibili anche notevoli
differenze nella specie umana imputabili alla etnia
Rappresentazione schematica della Fe-protoporfirina IX incorporata nel citocromo:
X è il quinto legame con un anione S- di un residuo cisteinico della catena polipeptidica
dell’isoforma
Y è il sesto legame del Fe occupato dall’acqua che può essere facilmente spiazzato
dall’ossigeno o da qualche substrato
l sistema ossido- riduttivo del Citocromo P450
Tipico spettro di assorbimento del citocromo P450 ridotto e
complessato a CO
L’insieme di questi
enzimi è contenuto
nella matrice
fosfolipidica del
reticolo
endoplasmatico
La presenza dei
fosfolipidi è
fondamentale per
permettere sia le
reazioni fra i due
enzimi sia l’arrivo
del substrato a
livello del sistema
enzimaticamente
attivo
La nomenclatura delle varie isoforme di P450 è la seguente:
•Le lettere maiuscole CYP indicano isoforme umane
•Il primo numero arabo che segue indica la famiglia dell’isoforma
•La sottofamiglia è indicata dalla lettera che segue
•Infine l’ultimo numero arabo indica un prodotto genico individuale nella
sottofamiglia
**
** Da A Parkinson in “Casarett & Doul’s TOXICOLOGY”
Nel REL sono presenti enzimi non costitutivi e inducibili che
catabolizzano gli xenobiotici. Possono catalizzare:
Idrossilazioni aromatiche e alifatiche
Epossidazioni di doppi legami
Ossigenazione di S-,N-,I-,e N-idrossilazione
Dealogenazioni ossidative e riduttive
Rottura di esteri
Dealchilazioni su (O, S, N)
Deaminazioni
Dealogenazioni
Sulfossidazioni
Alcuni Farmaci sono anche metabolizzate da forme di P450
costitutive non inducibili presenti a livello mitocondriale
Reazioni di ossidazione
Le reazioni di ossidazione richiedono la
presenza di:
• Ossigeno molecolare
• NADPH
• Del sistema ossidasico rappresentato da
due enzimi accopiati: la NADPH citocromo
P450 reduttasi (flavoproteina) e il
citocromo P450 (emoproteina)
Ossidazioni non microsomiali
Le reazioni di ossidazione possono essere
catalizzate oltre che da:
• Enzimi microsomiali denominati ossidasi a
funzione mista
• Anche da Enzimi non microsomiali
localizzati prevalentemente nei mitocondri
o da enzimi solubili presenti nel citosol.
RIDUZIONI
Sono anch’esse catalizzate da:
• Enzimi microsomiali
• Enzimi non microsomiali
Riduzioni non microsomiali
IDROLASI:Sono presenti in vari tessuti tra cui sangue e fegato.
Si dividono in: CARBOSSILESTERASI (nel REL e citosol)
PEPTIDASI (in sangue e lisosomi)
EPOSSIDO IDROLASI (nel REL e citosol)
Le CARBOSSILESTERASI catalizzano
1. Idrolisi di: esteri di acidi carbossilici
•
amidi
•
tioesteri
•
esteri di acidi fosforici
•
anidridi acide
2. Transesterificazioni ( es sostituzione di etanolo con
metanolo)
R-CH2-CO-O-CH2-R’ + H2O
esterasi
R-CH2-CO-OH + OH-CH2-R’
Acido
Alcool
R-CH2-CO-NH-CH2-R’ + H2O
amidasi
R-CH2-CO-OH + NH2-CH2-R’
Acido
Amina
Tutte le reazioni di sintesi hanno
caratteristiche comuni:
• L’organismo fornisce l’energia e l’agente coniugante
• Non sono reazioni peculiari per i farmaci (anche
sostanze formatesi dai normali processi metabolici
possono subire coniugazione)
• I prodotti coniugati sono inattivi e meno liposolubili.
Quasi tutti i composti coniugati sono acidi relativamente
forti
• I prodotti coniugati sono meno facilmente riassorbibili
una volta raggiunta l’urina tubulare o l’intestino
• Un composto può essere escreto sotto forma di
coniugati diversi se possiede uno o più centri di
coniugazione per una o più reazioni
Glucuronoconiugazioni
Le reazioni di glucuronoconiugazione sono
per la numerosità dei substrati sui quali
agiscono, per la diversità e numerosità dei
loro gruppi funzionali e per l’elevata
disponibilità del cofattore coinvolto (l’acido
urididifosfoglucuronico)
le più importanti fra le reazioni di
coniugazione
Coniugazione con l’Acido Glucuronico
Coniugazione per sostanze nucleofile:
1. Acidi organici: alifatici e aromatici
2. Alcol :alifatici, aliciclici, benzilici, fenolici
3. Chetoni , insaturi
4. Carbamati
5. Composti sulfidrilici (RSH)
6. Sulfonamidi (RSO2NH2)
7. Amine: ariliche, alifatiche terziarie
8. Idrossilamine (RNOH2)
I l cofattore è l’UDP-G A (acido Uridindifosfoglucuronico)
Vi sono più isoforme, localizzate nel REL di quasi tutti gli organi, di UGT
(UDP-GLUCURONOSILTRANFERASI), inducibili da xenobiotici
come il P450 .
• La formazione dei glucoronidi è mediata
dalla presenza di diverse isoforme di UDPglucoroniltransferasi
• Le diverse isoforme rispondono ai diversi
agenti induttori e dimostrano selettività
verso alcune classi di substrati
• L’eterogeneità di questi enzimi spiega le
differenze di specie che portano a difetti
nella glucuronazione soltanto per alcune
classi di accettori dell’acido glucuronico
Coniugazione con aminoacidi
Coniugazione importante per metabolizzare
solubilizzare ed eliminare con le urine gli
acidi carbossilici aromatici, acidi acetici
aromatici sostituiti, si formano amidi.
La reazione è in due tempi, necessita prima
l’attivazione dell’acido carbossilico con
CoA e consumo di ATP ad opera di una
CoA-ligasi, segue quindi la coniugazione
con un amino acido ad opera di una Naminoaciltranferasi. Le reazioni avvengono
nel citosol e nel REL di vari organi di tutti
gli organismi con differenti aminoacidi.
Coniugazione con
AMINOACIDI
METILAZIONE
Le Metiltransferasi sono enzimi citosolici con
cofattore la S adenosil metionina (SAM)carente
negli anziani.
I substrati sono:
• le sostanze organiche con gruppi idrossilici fenolici (catecoli)
•le sostanze organiche o con gruppi aminici primari,secondari, terziari
•Le sostanze contenenti gruppi sulfidrilici
Anche alcuni metalli possono essere metilati
Acetilazione
Subiscono acetilazione
• le Amine aromatiche
• Alcune Amine Alifatiche primarie
• Le Idrazine sostituite
• Le idrazidi
• Le Sulfonamidi
Cofattore è l’Acetil CoA
La localizzazione delle Acetiltranferasi è mitocondriale o
citosolica, una piccola parte nel REL
L’eliminazione dei prodotti acetilati è principalmente con le
urine.
Acetilazione e deacetilazione, operata da amidasi,
contribuiscono all’attivazione in carcinogeni di amine
aromatiche
Sulfotranferasi
• Come le UGT coniugano sostanze nucleofile e competono
tra loro per vari substrati. Sono localizzate nel citosol, e
hanno come cofattore la 3’-fosfo-adenosin-5’-fosfosolfato
(PAPS)
• Le sulfotranferasi sono sistemi enzimatici con più affinità
delle UGT per i substrati ma con meno capacità. I
solfoconiugati sono eliminati nelle urine
• Fattore limitante è la disponibilità di PAPS. Non vi è
fenomeno di induzione da xenobiotici
• I solfonati delle N-idrossilamine sono sostanze tossiche
IL GLUTATIONE
Coniugazione col tripeptide GLUTATIONE
Coniugazione con Glutatione e sintesi di Acidi Mercapturici
INDUZIONE METABOLICA
Una caratteristica importante degli enzimi
biotrasformativi è rappresentata dal fatto che la
loro attività può aumentare in seguito a
trattamento con:
• Farmaci
• Pesticidi
• Sostanze chimiche di origine industriale, prodotti
di origine naturale destinati all’alimentazione
L’effetto viene chiamato induzione metabolica
•
•
•
•
•
•
L’iduzione metabolica è stata inizialmente
osservata nel caso delle aminossidasi;
successivamente è stato riconosciuto che il
fenomeno è comune a molte monossigenasi
P450 dipendenti e coinvolge anche enzimi di
tipo coniugativo.
Il tempo di latenza della comparsa dell’induzione
l’intensità, la durata, possono variare in
funzione:
Dell’agente inducente
Della dose
Della durata dell’esposizione
Della etnia
Del sesso
GLI AGENTI INDUTTIVI
PRINCIPALMENTE STUDIATI
POSSONO RACCOGLIERSI IN
DUE GRANDI GRUPPI
• Quello del fenobarbital
• Quello degli idrocarburi aromatici
(benzopirene e 3-metilcolantrene)
IL FENOBARBITAL INDUCE:
• Ipertrofia del fegato
• Proliferazione del reticolo endoplasmatico
• Aumento del contenuto di proteine e
fosfolipidi
• Aumento della sintesi di enzimi quali la
NADPH-citocromo P450 reduttasi e alcune
forme del citocromo P450
IL 3 METILCOLANTRENE INVECE
PROVOCA:
• Un aumento selettivo di alcuni membri
della superfamiglia del citocromo P450
con caratteristiche spettrali e catalitiche
diverse da quelle degli isoenzimi indotti dal
fenobarbital.
• Non provoca ipertrofia del fegato né
aumenta le proteine, i fosfolipidi o la
NADPH citocromo-P450 reduttasi
Fenobarbital
metilcolantrene
L’attivazione del recettore Ah
•
•
•
•
•
Induce la trascrizione:
Del citocromo P450 1A1
Della Glutatione-S-transferasi
Della UDP-glucoroniltransferasi
Della Aldeide deidrogenasi
MECCANISMI POST-TRASCRIZIONALI
DELL’INDUZIONE METABOLICA
Splicing alternativi dell’mRNA per
determinate isoforme di citocromo P450,
che lo rendono meno suscettibile
all’attacco delle ribonucleasi, possono
conferire una maggior stabilità alla
molecola
MECCANISMI POST-TRADUZIONALI
DELL’INDUZIONE METABOLICA
• Stabilizzazione della molecola d’enzima
che viene degradato più lentamente
CONSEGUENZE
DELL’INDUZIONE ENZIMATICA
• Aumentata velocità con cui avviene la
biotrasformazione epatica dei farmaci
• Aumentata velocità di formazione dei metaboliti
• Aumentata clearance epatica dei farmaci
• Diminuzione dell’emivita plasmatica
• Diminuzione delle concentrazioni plasmatiche
totali di farmaco e di quelle di farmaco libero
• Diminuzione degli effetti farmacologici qualora i
metaboliti siano inattivi
Frazioni microsomiali (CYP), farmaci metabolizzati dai singoli CYP
(substrati) e substrati utilizzati per la tipizzazione fenotipica
(substrati sonda). L’elenco dei farmaci non è completo
Sono conosciute varianti enzimatiche
negli individui relative sia ad enzimi
coniuganti che acetilanti con diversa
velocità di reazione
Esistono almeno 2 famiglie e 3
sottofamiglie di Glucuronil-transferasi
Esistono numerose forme di
Acetiltransferasi e di Sulfotranferasi
non ancora ben definite.
Nell’uomo esistono grosse variazioni nel metabolismo dei
farmaci e la popolazione umana può essere suddivisa in
sub popolazioni diverse su base genetica