Circolo
Sistemico
Interfaccia
circolotessuti
Tessuto bersaglio
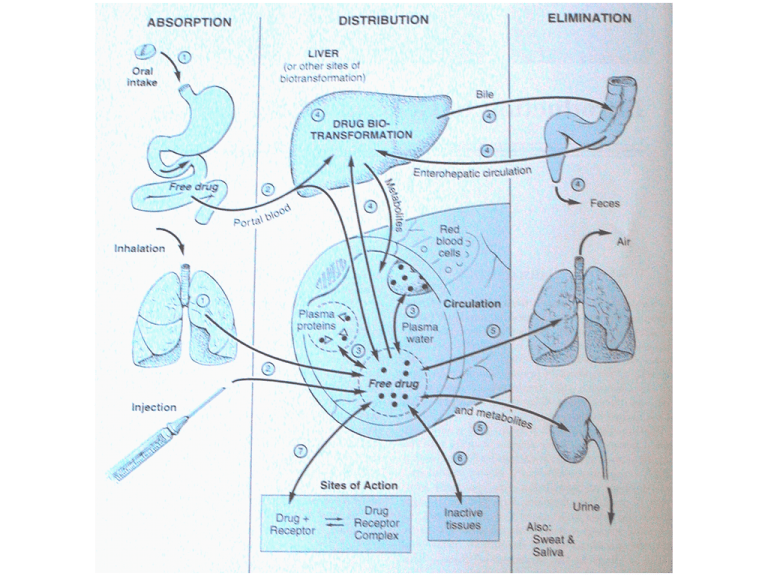
Fegato
Vena porta
Farmacocinetica
Assorbimento
Distribuzione
Metabolismo
Escrezione
(ADME)
Enterociti
Rene
Intestino tenue
Metabolismo - Biotrasformazione
Le sostanze lipofile sono escrete più lentamente
di quelle idrofile perché:
• sono più facilmente riassorbite nel tubulo
renale (o nell’intestino in caso di eliminazione
biliare)
• si accumulano nel tessuto adiposo
• E’ stato calcolato che il tempo di
dimezzamento (emivita) dell’esobarbitale, che
è pari a 5-6 ore, sarebbe di 2-5 mesi se non
venisse biotrasformato
Distribuzione tissutale degli enzimi
metabolizzanti
L’organo più ricco di enzimi metabolizzanti è il
fegato
Altri organi o tessuti con significativa capacità
metabolica sono polmoni, reni e intestino
Alcuni tessuti hanno un’elevata concentrazione di
enzimi metabolizzanti (mucosa nasale, cristallino), che
servono a difendere il tessuto, ma il cui contributo al
metabolismo sistemico è pressoché nullo dato il volume
del tessuto
BIOTRASFORMAZIONI
Farmaco attivo in metabolita inattivo
Amfetamina
Fenobarbital
Deaminazione
Idrossilazione
Fenilacetone
Idrossifenobarbital
Farmaco attivo in metabolita attivo
Codeina
Procainamide
Fenilbutazone
Demetilazione
Acetilazione
Idrossilazione
Morfina
N-acetilprocainamide
Ossifenbutazone
Farmaco inattivo in metabolita attivo (profarmaco)
Etacillina
Sulfosalazina
Idrolisi
Azoriduzione
Ampicillina
Sulfapiridina + acido 5aminosalicilico
Farmaco attivo in intermedio reattivo (tossico)
Acetaminofene
Idrossilazione aromatica
Benzopirene
Idrossilazione aromatica
Metabolita reattivo
(necrosi epatica)
Metabolita reattivo
(carcinogenesi)
La localizzazione degli enzimi è importante nel
determinare l’organo colpito nel caso di formazione di
metaboliti tossici
Molti metaboliti tossici sono infatti altamente reattivi e
colpiscono quindi solo le cellule dell’organo in cui si
formano. Ad esempio, molti composti sono epatotossici
perché i metaboliti reattivi si formano nel fegato.
Inoltre, la tossicità è spesso limitata, all’interno
dell’organo, alle cellule che esprimono l’enzima che
porta alla formazione del metabolita tossico. Ad
esempio, il paracetamolo e CCl4 causano necrosi
centrolobulare perché le cellule della regione
centrolobulare sono ricche di citocromo P450
Gli enzini metabolizzanti hanno scarsa
selettività per i substrati
Un numero relativamente esiguo di enzimi puo’
metabolizzare un enorme numero di sostanze
Lo stesso enzima può catalizzare reazioni
diverse sullo stesso substrato
Una sostanza può essere metabolizzata da
enzimi diversi
In genere uno xenobiotico viene
metabolizzato secondo più vie metaboliche
Metabolismo del flunitrazepam
Uno stesso enzima può metabolizzare più
substrati presenti contemporaneamente
nell’organismo
Sono quindi possibili interazioni
(inibizione competitiva, induzione) tra
xenobiotici, o tra xenobiotici e composti
endogeni
Esempio di interazione: inibizione del metabolismo
della terfenadina ⇒ aritmie
Terfenadine
(Teldane, profarmaco)
CYP3A4
Inibitori: succo di
pompelmo, ketoconazolo
Fexofenadine
(Telfast)
Classificazione delle reazioni di biotrasformazione:
Fase I: reazioni di
1. ossidazione
2. riduzione
3. idrolisi
La capacità delle reazioni
di fase I è limitata dalla
quantità di enzima
Fase II: reazioni di
coniugazione
La capacità delle
reazioni di fase II
è limitata
principalmente
dalla disponibilità
del cofattore
La maggior parte dei metaboliti tossici si forma nelle reazioni di
fase I, in particolare nelle reazioni di ossidazione
ENZIMI DELLA FASE I
1. IDROLISI
procainamide
Anti-aritmico
procaina
Anestetico locale
ENZIMI DELLA FASE I
1. IDROLISI
ENZIMI DELLA FASE I
EPOSSIDO-IDROLASI
ENZIMI DELLA FASE I
EPOSSIDO-IDROLASI
RIDUZIONI:
RIDUZIONI:
RIDUZIONI:
A
B
Ciclo redox
dei chinoni
Danno a proteine e DNA
Anione superossido
🔻
Radicale perossidrossilico
🔻
Perossido di idrogeno
🔻
Radicale idrossilico
Perossidazione dei lipidi
Citocromo P450 (CYP 450)
E’ l’enzima più importante di fase I perché metabolizza
un gran numero di composti esogeni ⇒ principale
responsabile dell’inattivazione di molti farmaci e
composti tossici
Responsabile della biosintesi o degradazione di molti
composti endogeni (ormoni steroidei, TXA2, PGI2,
vitamine liposolubili, acidi grassi ecc.)
Presente in tutti i tessuti.
I livelli più alti sono nel fegato, a livello del reticolo
endoplasmatico (frazione microsomiale)
OSSIDAZIONI:
RH + O2 + NADPH + H+
=
ROH + H2O + NADP+
Ciclo catalitico del citocromo P450
Nell’uomo, esistono 60 o più enzimi CYP450, che
differiscono, anche se parzialmente, per specificità
di substrato e sensibilità a induttori e inibitori
Membri della stessa sotto-famiglia possono avere
omologia di sequenza fino al 97%
Solo alcune sottofamiglie di citocromi
hanno un ruolo significativo nel
metabolismo dei farmaci:
La risposta allo stesso farmaco varia all'interno di
una popolazione
Campione di pazienti
Trattamento
efficace MA
tossico
Trattamento NON
efficace e tossico
Stessa diagnosi
Trattamento NON
efficace e NON
tossico
Stessa prescrizione
Trattamento efficace
e NON tossico
La variabilità individuale della
risposta ai farmaci può avere basi
GENETICHE
ACQUISITE
Farmaci
e
Geni
Farmacogenomica
POLIMORFISMO DEL CITOCROMO P450
Delezione
del gene
Enzima
assente
Duplicazione
dei geni
Singolo gene
Enzima
instabile
Enzima
normale
Alterata
specificità di
substrato
Metabolismo
assente
Metabolismo Metabolismo
normale
ridotto
Alti livelli di
enzima
Metaboliti
diversi
Metabolismo
aumentato
POLIMORFISMO DEL CITOCROMO P450
Genotipo
Genotipo
Fenotipo
Atteso
Frequenza
nella
popolazione
Esempio
Di dose
Nel caso
Di
Profarmaco
Metabolizzatori Metabolizzatori
Metabolizzatori
Buoni
intermedi
lenti
ultrarapidi
Metabolizzatori
risposta
Assente
risposta
Attesa
risposta
maggiore
risposta
Eccessiva
Ultraveloci
Buoni
Intermedi
Lenti
Aggiustamento
della dose sulla
base
del genotipo
e
dei relativi
parametri
farmacocinetici
EFFETTI DEL POLIMORFISMO DEL CITOCROMO P450
ENZIMA
CYP2C3
RIDOTTA CLEARANCE
warfarin
fenitoina
losartan
tolbutamide
FANS
EFFETTI AVVERSI
sanguinamento
atassia
RIDOTTA ATTIVAZIONE
DEL PROFARMACO
losartan
ipoglicemia
sanguinamento gastrico
CYP2C19
omeprazolo
diazepam
sedazione
CYP2D6
antidepressivi triciclici
aloperidolo
farmaci anti-aritmici
SSRI
cardiotossicità
parkinsonismo
aritmie
nausea
tramadol
codeina
etilmorfina
FANS, farmaci anti-infiammatori non steroidei; SSRI, inibitori selettivi delre-uptake della serotonina
La variabilità individuale della
risposta ai farmaci può avere basi
GENETICHE
ACQUISITE
INTERAZIONI TRA FARMACI
ED ENZIMI CYP450:
DUE MECCANISMI
1. INIBIZIONE
2. INDUZIONE
INIBIZIONE dell'attività dell'enzima
A seconda del farmaco, l'inibizione può
determinare riduzione dell'effetto terapeutico (pro
farmaci) o comparsa di effetti avversi (ADR,
Adverse Drug Reaction) per accumulo del
farmaco non metabolizzato
INIBIZIONE
a) competitiva
c) non-competitiva
ortosterica
b) non-competitiva
allosterica
d) mista
2. INDUZIONE
L'attività degli enzimi biotrasformanti
aumenta in seguito all'esposizione a sostanze
esogene
Ciò è dovuto ad un aumento della sintesi exnovo degli enzimi biotrasformanti
(INDUZIONE)
L'aumento dell'attività si manifesta nei
confronti sia del composto induttore, sia di
altri composti substrati del medesimo enzima
MECCANISMO DELL’INDUZIONE
MEDIATA DAI RECETTORI Ah
Sostanza
Esogena
Metaboliti
AhR: Aromatic hydrocarbon Receptor
HSP90: Heat Shock protein
Arnt: Ah receptor nuclear translocator
ESEMPI DI INTERAZIONE TRA
FARMACI ED ENZIMI CYP:
CYP
SUBSTRATO
1A2
caffeina, clomipramina, teofillina
2C9
2C19
2D6
3A4
INIBITORE
INDUTTORE
cimetidina
fluvoxamina
ticlopidina
fluorochinoloni
diclofenac, ibuprofene, piroxicam, losartan, tolbutamide, fluconazolo
warfarin
fluvastatina
zafirlukast
omeprazolo, diazepam, nelfinavir
cimetidina
fluvoxamina
Farmaci del SNC: amitriptilina, desipramina, imipramina, cimetidina
paroxetina, aloperidolo
fluexetina
Anti-aritmici: propafenone
paroxetina
Beta bloccanti: propranololo, timololo
Narcotici: codeina, dexytrometorfano
omeprazolo
tabacco
Calcio antagonisti: diltiazem, nifedipina, verapamil
Immunosoppressori: ciclosporina A, tacrolimo
Steroidi: cortisolo, progesterone, 17-β-estradiolo,
testosterone
Macrolidi: eritromicina, claritromicina
Chemioterapici: ciclofosfamide, tamoxifene, vincristina,
vinblastina, fosfamide
Benzodiazepine: alprazolam, midazolam, triazolam
Oppiodi: fentanil, alfentanil
Inibitori delle proteasi HIV: indinavir, ritonavir
Vari: cisapride, chinidina, sildenafil
barbiturici
carbamazepina
fenitoina
rifampina
amiodarone
claritromicina
eritromicina
fluconazolo
chetoconazolo
indinavir
trolendomicina
rifampina
rifampina
REAZIONI DELLA FASE II
o di coniugazione
Richedono un enzima, un cofattore e un gruppo funzionale
Reazione di coniugazione
Gruppo funzionale
con acido glicuronico
-OH; -COOH; -NH2; -SH; -CH
-OH aromatico; -NH2 aromatico
con solfato
-NH2 aromatico; -COOH
-NH2 aromatico; -NH2 alifatico;
idrazine; -SO2NH2
con aminoacidi
con acetato
con metile
con glutatione
-OH aromatico; -NH2 ; -SH
epossidi; alidi organiche
COFATTORI
Glucuronazione: uridin difosfato D-glucuronato
(UDP-GA)
Solfatazione: 3-fosfoadenosin 5'-fosfofosfato (PAPS)
Acetilazione: acetil coenzima A
Metilazione: S-adenosil metionina
Coniugazione con Glutatione: Glutatione
(glutammato-cisteina-glicina)
GLUCURONAZIONE
enzima: UDP-glucuronil transferasi (UGT)
cofattore: UDP glucuronato (UDPGA)
Bilirubina
Steroidi
Acidi biliari
Ormoni tiroidei
ACETILAZIONE: N-acetil transferasi (NAT)
CONIUGAZIONE CON GLUTATIONE
CONIUGAZIONE CON GLUTATIONE
CONIUGAZIONE CON GLUTATIONE
GLI
INDIMENTICABILI
Il Vd mette in relazione la quantità di farmaco
presente nell’organismo con la concentrazione del
farmaco nel plasma. L'unità di misura è il litro
La risposta allo stesso farmaco varia all'interno
di una popolazione con una distribuzione di
tipo gaussiano
La variabilità della risposta ha basi sia
genetiche, sia acquisite
Il meccanismo dell'induzione dei Cyt P 450












