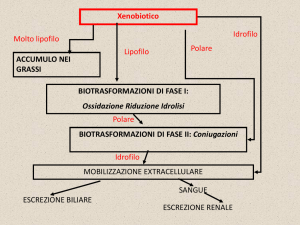
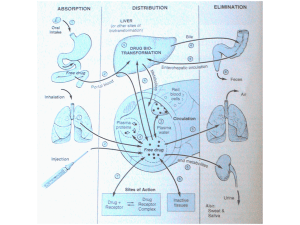
La maggior parte del metabolismo ossidativo degli
xenobiotici è catalizzata dal sistema enzimatico P450
La superfamiglia del citocromo P450
Il citocromo P450 è presente in numerose forme
isoenzimatiche caratterizzate da una diversa struttura
peptidica.
Mediante tecniche di DNA ricombinante si è giunti ad
identificare l'esistenza di una superfamiglia del
citocromo P450 costituita da numerosissime famiglie
codificate da più di 300 geni diversi, che si sono evoluti
da un unico gene ancestrale comparso da oltre circa
2000 milioni di anni.
Il corredo e l’attività enzimatica nell’uomo è spesso diversa dall’animale da
laboratorio e sono riconoscibili anche notevoli differenze nella specie umana
imputabili alla razza
Rappresentazione schematica della Fe-protoporfirina IX incorporata nel citocromo:
X è il quinto legame con un anione S- di un residuo cisteinico della catena
polipeptidica dell’isoforma
Y è il sesto legame del Fe occupato dall’acqua che può essere facilmente spiazzato
dall’ossigeno o da qualche substrato
Tipico spettro di assorbimento del citocromo P450 ridotto e
complessato a CO
La nomenclatura delle varie isoforme di P450 è la seguente:
•Le lettere maiuscole CYP indicano isoforme umane
•Il primo numero arabo che segue indica la famiglia dell’isoforma
•La sottofamiglia è indicata dalla lettera che segue
•Infine l’ultimo numero arabo indica un prodotto genico individuale nella
sottofamiglia
** Da A Parkinson in “Casarett & Doul’s TOXICOLOGY”
Animali
Gli enzimi costitutivi non sono inducibili e sono principalmente localizzate nei mitocondri,
ma anche nel REL sono implicati nella sintesi e catabolismo di:
1)Ormoni 2)Steroidi 3)Acidi biliari 4)Vitamine liposolubili (vit D) 5)Acidi grassi
6)Eicosanoidi
Gli enzimi non costitutivi sono inducibili e localizzati nel REL dove catabolizzano gli
xenobiotici. Possono catalizzare:
Idrossilazioni aromatiche e alifatiche
Epossidazioni di doppi legami
Ossigenazione di S-,N-,I-,e N-idrossilazione
Dealogenazioni ossidative e riduttive
Rottura di esteri
Dealchilazioni su (O, S, N)
Deaminazioni
Deidrogenazione
Sulfossidazioni
PIANTE
Il sistema P450 è simile a quello animale
Gli enzimi costitutivi sono la maggior parte e sono principalmente nel REL, sono
implicati in numerosi processi di sintesi:
•
Sintesi di giberelline e fitoalessine
•
Idrossilazioni di: acido cinammico, monoterpeni (geraniolo), flavonoidi
•
β-idrossilazione di digitoxina
•
ω-idrossilazione dell’acido laurico
Gli enzimi non costitutivi sono debolmente inducibili da IPA, acidi Fenossiacetici
e metalli, catabolizzano vari pesticidi erbicidi e xenobiotici: IPA, Benzopirene,
Monuron, Aminopirene, Diclofop, Acidi fenossiacetici, organofosforici
I citocromi P450 del REL necessitano di O2, di NADPH e della NADPH-citocromo
P450 riduttasi (flavoproteina). La presenza di citocromo b5 facilita la reazione
Fe3+ O2
RH
Modificata da A Parkinson in “Casarett & Doul’s TOXICOLOGY”
SISTEMA P450 MITOCONDRIALE
Il donatore di elettroni è il NADPH ma molto spesso il NADH il
traporto dell’elettrone è fatto da due proteine una Ferro Solfo
Proteina (ISP) e una Flavoproteina contenente FMN (ferrodoxina
riduttasi)
Anche i batteri hanno un sistema ossidativo P450 dipendente
Il donatore di elettoni è il NADH e i trasportatori sono una Flavoproteina
e la Putidoredoxina
H
C CH3
H
Cl
H
Etilbenzene
OH
C CH3
Cl
C
H
H
Cl
Cl
H
C
OH
-HCl
Cl
C O
-HCl
CO
H
Diclorometano
Cl
Cl
-HCl
Cl
Cl
Cl
C
OH
C
Cl
H
Cloroformio
H
H
C
H
C
Cl
Cloruro di vinile
Cl
-HCl
C
O
Cl
Fosgene
H
H
C C
H
Cl
H
Cl
C
O
C
H
Aldeide Cloracetica
H
Ossidazione di un aromatico
monoalogenato
Induzione del sistema P450 e sue conseguenze Tossicocinetiche
Sono induttori i seguenti fattori:
•Le diete con alterato rapporto proteine/grassi
•Assunzione di cibi vegetali contenenti flavonoidi (crucifere), indoli dei cavolini di
Bruxelles
•Assunzione di cibi contenenti IPA (grigliati, affumicati), diossine o PCB, o aflatossine
•Alto consumo di Etanolo e
•Fumo di sigaretta (Benzopirene)
L’induzione produce aumento di attività tossicologica di tossici che
sono attivati dall’ossidazione
L’induzione produce perdita di attività tossicologica delle sostanze
che sono ossidate prima di essere escrete
INIBIZIONE
Alcuni xenobiotici possono avere azione diretta di inibizione :
•Gli N-eterociclici che si legano al Fe
•L’etanolo per azione competitiva
Altri attraverso i loro metaboliti:
•I tiocomposti
•Gli alcheni non sostituiti o monosostituiti, come il cloruro di vinile
•I metalli pesanti come Piombo e Cobalto che interferiscono con la biosintesidell’eme
•Anche il CO e le sostanze che riducono la produzione di NADPH o che ledono le
membrane del REL sono inibitori
Età sesso e razza sono fattori determinanti in Tossicococinetica
Età
Gli enzimi che metabolizzano gli xenobiotici sono
insufficienti nel feto e nei neonati prematuri
I bambini, invece, possono metabolizzare alcuni
tossici più rapidamente degli adulti
Anche negli anziani vi sono numerose variazioni
tossicococinetiche dovute sia a fattori metabolici
che a variazioni anatomiche e/o fisiologiche
inoltre prendono molti farmaci che possono
competere con i tossici per i medesimi enzimi
metabolizzanti
COOSSIDAZIONI DIPENDENTI DA PEROSSIDASI
ROOH + SUBSTRATOred
ROH +SUBSTRATOox
Accoppiamento tra riduzione di H2O2 o lipidi
idroperossidati con l’ossidazione di un substrato.
Esempi:
nel surrene, pelle, epitelio della vescica è presente
la prostaglandina sintetasi-idroperossidasi (PGS)
nella ghiandola mammaria la lattoperossidasi
Nei leucociti e nel midollo osseo la
mieloperossidasi
Aromatizzazione:
Processo ossidativo a livello mitocondriale
O
COOH
C
CoA
ATP
O
SCoA
C
SCoA
COOH
Coniugazione con l’Acido Glucuronico o con il Glucosio
Coniugazione per sostanze nucleofile:
1.
Acidi organici: alifatici e aromatici
2.
Alcol :alifatici, aliciclici, benzilici, fenolici
3.
Chetoni α,βinsaturi
4.
Carbamati
5.
Composti sulfidrilici (RSH)
6.
Sulfonamidi (RSO2NH2)
7.
Amine: ariliche, alifatiche terziarie
8.
Idrossilamine (RNOH2)
I cofattori sono rispettivamente UDP-GA (acido Uridindifosfoglucuronico) e UDPG
(Uridindifosfoglucosio )
Vi sono più isoforme, localizzate nel REL di quasi tutti gli organi, di UGT (UDPGLUCURONOSILTRANFERASI), inducibili da xenobiotici come il P450 .
La coniugazione con l’Acido Glucuronico è tipica dei vertebrati
ed in particolare di animali a sangue caldo
La coniugazione con il Glucosio è tipica degli invertebrati e delle
piante
I prodotti prendono nome rispettivamente di Glucuronide e
Glucoside
I Glucuronidi sono escreti con le urine con meccanismi di
ultrafiltrazione e attraverso un sistema di trasporto anionico
delle cellule dei tubuli renali. Se lo xenobiotico coniugato
conserva peso molecolare elevato > 500 e discreta lipofilia può
essere escreto con la bile, attraverso un sistema di trasporto
anionico delle cellule epatiche, in tal caso nell’intestino può
essere anche degradato da β-glucuronidasi batteriche ed
entrare nel circolo enteroepatico
Sulfotranferasi
Come le UGT coniugano sostanze nucleofile e
competono tra loro per vari substrati. Sono localizzate
nel citosol, e hanno come cofattore la 3’-fosfoadenosin-5’-fosfosolfato (PAPS)
Le sulfotranferasi sono sistemi enzimatici con più affinità
delle UGT per i substrati ma con meno capacità. I
solfoconiugati sono eliminati nelle urine.
Fattore limitante è la disponibilità di PAPS. Non vi è
fenomeno di induzione da xenobiotici.
I solfonati delle N-idrossilamine sono sostanze tossiche
Acetilazione
Subiscono acetilazione
• le Amine aromatiche
• Alcune Amine Alifatiche primarie
• Le Idrazine sostituite
• Le idrazidi
• Le Sulfonamidi
Cofattore è l’Acetil CoA
La localizzazione delle Acetiltranferasi è mitocondriale
o citosolica, una piccola parte nel REL
L’eliminazione dei prodotti acetilati è principalmente
con le urine.
Acetilazione e deacetilazione, operata da amidasi,
contribuiscono all’attivazione in carcinogeni di
amine aromatiche
Sono conosciute varianti enzimatiche negli
individui relative sia ad enzimi coniuganti
che acetilanti con diversa velocità di
reazione
Esistono almeno 2 famiglie e 3
sottofamiglie di Glucuronil-transferasi
Esistono numerose forme di
Acetiltransferasi e di Sulfotran-ferasi non
ancora ben definite.
METILAZIONE
Le Metiltransferasi sono enzimi citosolici con cofattore
la S adenosil metionina (SAM)carente negli anziani.
I substrati sono:
• le sostanze organiche con gruppi idrossilici fenolici (catecoli)
•le sostanze organiche o con gruppi aminici primari,secondari, terziari
•Le sostanze contenenti gruppi sulfidrilici
Anche alcuni metalli possono essere metilati
Coniugazione con aminoacidi
Alcuni acidi carbossilici aromatici, acidi acetici
aromatici sostituiti, acidi propionici sostituiti e
acidi acrilici si coniugano con aminoacidi
formando amidi.
La reazione è in due tempi, necessita prima
l’attivazione dell’acido carbossilico con CoA e
consumo di ATP ad opera di una CoA-ligasi, segue
quindi la coniugazione con un amino acido ad
opera di una N-aminoaciltranferasi. Le reazioni
avvengono nel citosol e nel REL di vari organi di
tutti gli organismi con differenti aminoacidi.
UOMO
UCCELLI
GLICINA, GLUTAMINA
ASPARGINA, SERINA
GLICINA,GLUTAMINA, SERINA,
CARNITINA, ACIDO
GLUTAMMICO
GLICINA, ORNITINA, TAURINA
PESCI
GLICINA, TAURINA
PIANTE
SERINA, ACIDO GLUTAMMICO,
ACIDO ASPARTICO, GLICINA,
CISTEINA, ALANINA
MAMMIFERI
Coniugazione con
AMINOACIDI