Introduzione alla biochimica
AO 11/14
Il Gruppo Carbonilico
1. E’ uno dei gruppi funzionali più
importanti
2. Sp2, legame polarizzato
1.
Ossigeno elettronegativo: effetto
induttivo
2.
Effetto di risonanza (i due elettroni
del legame p-greco si possono
spostare completamente
sull’ossigeno)
3. Aldeidi, chetoni
4. Acidi, esteri, anidridi, ammidi
Aldeidi e chetoni: gruppo funzionale
I gruppi funzionali delle aldeidi e dei chetoni sono molto
simili: per le aldeidi è —CHO, mentre per i chetoni è
—CO—. Entrambi i gruppi funzionali contengono il
raggruppamento
detto carbonile.
Per questo motivo aldeidi e chetoni sono anche chiamati
composti carbonilici.
3
Aldeidi e chetoni: proprietà fisiche
I punti di ebollizione delle aldeidi
e dei chetoni sono più alti di quelli
degli idrocarburi a uguale massa
molecolare. Questo si deve all’elevata
elettronegatività dell’atomo
di ossigeno, che polarizza il legame
carbonio-ossigeno e fa sì che tra le
molecole di aldeidi e chetoni ci siano
forti interazioni dipolo-dipolo. Gli alcoli
corrispondenti, invece, bollono
a temperature più elevate a causa
dei legami a idrogeno, assenti in aldeidi
e chetoni.
Modello molecolare
dell’acetone (un
chetone) con
evidenziata la
polarizzazione
4
© Zanichelli editore, 2014
Aldeidi e chetoni: nomenclatura
Il nome IUPAC delle aldeidi si ricava da quello
dell’alcano corrispondente sostituendo alla –o finale il
suffisso –ale. Analogamente il nome dei chetoni si
ottiene col suffisso –one. È frequente tuttavia l’utilizzo
della nomenclatura tradizionale per alcuni composti di
uso comune.
5
© Zanichelli editore, 2014
Aldeidi e chetoni: reattività e
diffusione
La reazione caratteristica dei composti carbonilici è
l’addizione nucleofila grazie all’atomo di carbonio
polarizzato del gruppo carbonile.
La parziale carica positiva rende il carbonio esposto
all’attacco di nucleofili
6
Aldeidi ,chetoni e….. in natura
Aromi gradevoli (profumi, aromi e detersivi)
La formazione di emiacetali
L’emiacetale contiene sullo stesso atomo di carbonio una funzione alcolica e una
eterea. Le aldeidi con un gruppo ossidrile a distanza appropriata all’interno della
stessa molecola formano emiacetali ciclici.
Strutture di questo genere sono molto importanti nella chimica dei carboidrati
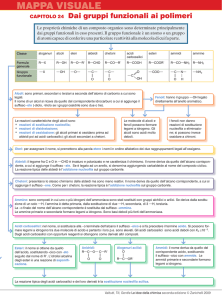
Acidi carbossilici: gruppo funzionale
Gli acidi carbossilici sono caratterizzati dal gruppo
funzionale —COOH, chiamato gruppo carbossile. Esso
deriva dalla fusione tra il carbonile
e il gruppo
ossidrile —OH.
Carbossile o gruppo carbossilico
9
© Zanichelli editore, 2014
Acidi carbossilici: nomenclatura
La nomenclatura degli acidi carbossilici prevede
l’aggiunta del suffisso -oico al nome dell’alcano
corrispondente. Alla nomenclatura IUPAC ne è affiancata
una corrente, tutt’ora in uso.
Nei nomi correnti si usano le lettere greche α, β, γ… per
designare gli atomi di carbonio che seguono al gruppo
carbossile.
10
© Zanichelli editore, 2014
Molti acidi hanno nomi correnti spesso legati alla
fonte da cui l’acido viene isolato……
.No
Common name
Formula
IUPAC name
1
Formic acid
HCOOH
2
Acetic acid
CH3COOH
Ethanoic acid
3
Proprionic acid
CH3CH2COOH
Propanoic acid
4
Butyric acid
CH3(CH2)2COOH
Butanoic acid
5
Caproic acid
CH3(CH2)4COOH
Hexanoic acid
6
Caprylic acid
CH3(CH2)6COOH
Octanoic acid
7
Capric acid
CH3(CH2)8COOH
Decanoic acid
8
Lauric acid
CH3(CH2)10COOH
Dodecanoic acid
9
Myristic acid
CH3(CH2)12COOH
Tetradecanoic
acid
10
Palmitic acid
CH3(CH2)14COOH
Hexadecanoic acid
11
Stearic acid
CH3(CH2)16COOH
Octadecanoic acid
Methanoic acid
Acidi carbossilici: proprietà fisiche
Gli acidi carbossilici sono composti polari, tendono a
formare legami a idrogeno intermolecolari; pertanto
presentano punti di ebollizione abbastanza alti.
In acqua sono solubili solo gli acidi formico, acetico e
propionico (basso PM).
12
Acidi carbossilici: proprietà chimiche
Gli acidi carbossilici sono acidi deboli (KA : 10-4 – 10-5)
Si dissociano in acqua per formare anione carbossilato e ione idronio
Il carbonio del carbonile è sede di una carica positiva che facilita la
collocazione di una carica negativa sull’adiacente atomo di ossigeno quando
il gruppo ossidrilico si ionizza perdendo il protone
formule di risonanza dello ione
carbossilato
13
R COOH + H2O
⇌ RCOO
-
+ H3O+
K = [RCOO−][H3O+]
[RCOOH][H2O]
K x [H2O] = [RCOO−][H3O+]
[RCOOH]
Ka
=
[RCOO−][H3O+]
[RCOOH]
Ka = costante di dissociazione acida, misura la forza dell’acido
Ka può essere espresso anche come pKa
pKa= -logKa
Confronto tra acidità acidi e di alcooli
La carica negativa (l’elettrone ) è dispersa in maniera uguale (delocalizzata)
su entrambi gli atomi di ossigeno per cui ogni atomo di ossigeno ne porta
solo metà
- molecola carbossilato più stabile dell’etossido
- carbossilato meno disponibile per fissare un protone (equilibrio più
spostato a destra)
Confronto acidità tra acidi carbossilici:
l’effetto induttivo
Tra gli acidi carbossilici l’acidità può variare a seconda del gruppo legato al
carbonile.
gruppi elettronattrattori (elevata elettronegatività) determinano un aumento di
acidità mentre i gruppi elettrondonatori la fanno diminuire.
acido cloro-acetico: il cloro legato al carbonio in α (alfa) al gruppo carbossilico,
essendo un elemento molto elettronegativo, ha un effetto elettronattrattore che
stabilizza lo ione cloroacetato:
Viceversa, i gruppi alchilici (–CH3) sono debolmente elettronrepulsori e quindi
accentuano la carica negativa sugli ossigeni dello ione carbossilato e
determinano quindi una diminuzione di acidità.
Per tale motivo l'acido acetico (CH3COOH) è circa 12 volte più debole dell'acido
formico (HCOOH).
Ka Acidi carbossilici
Nota: Forza acidi e basi
Lo scienziato danese J. N. Bronsted e l'inglese T. M. Lowry nel
1923, indipendentemente l'uno dall'altro, proposero una teoria
sul comportamento degli acidi e delle basi, che teneva conto del
traferimento dei protoni H+. Essi definirono:
• acido una sostanza capace di cedere ioni H+ (protoni)
• base una sostanza capace di acquistare ioni H+ (protoni)
Secondo Bronsted e Lowry, l'acido può donare il protone solo in
presenza di una base che lo accetti.
Pertanto non esistono acidi e basi come tali, ma solo coppie di
acidi e basi che in soluzione acquosa danno luogo a una
reazione: la reazione acido-base.
Generalizzando, se si indica con :B una generica base e con HA
un generico acido, l'equilibrio della reazione acido-base può
essere così schematizzato:
reazione acido base
dove:
BH+ è l'acido coniugato della base :B
mentre:
:A- è la base coniugata dell'acido HA
Nota: acidi e basi forti/deboli
Sono considerati forti quegli acidi e quelle basi che in acqua sono
completamente ionizzati.
Tra i tanti acidi noti, sono pochi quelli che si comportano da acidi
forti. Tra questi ricordiamo l'acido perclorico HClO4; l'acido nitrico
HNO3; HCl; HBr; HI.
Gli idrossidi del I e del II gruppo della tavola periodica
costituiscono invece le basi forti. Tra queste ricordiamo l'idrossido
di sodio NaOH; LiOH; KOH; Ba(OH)2
Gli acidi e le basi deboli invece, quando si sciolgono in acqua, si
ionizzano solo in minima parte tendendo a rimanere in forma
indissociata.
Da un punto di vista quantitativo, la forza degli acidi e delle basi è
determinato dal valore della costante acida o basica. Tanto più
elevato è il valore della costante, tanto più forte è l'acido o la
base.
Ka/Kb
Per un generico acido HA che si dissocia secondo il seguente
equilibrio:
ionizzazione acido debole
possiamo scrivere:
costante acida
Quanto più l'acido è debole, cioè quanto più l'equilibrio della reazione di
dissociazione è spostato a sinistra, tanto più piccolo è il valore della sua
costante acida Ka.
In altre parole, il valore della costante acida Ka è la misura della forza di un
acido: tra due acidi, il più forte è quello che ha la costante acida più grande.
pH
Acidi carbossilici: reattività (I)
A causa della loro acidità, gli acidi carbossilici reagiscono
con basi forti per dare dei sali:
A partire dagli acidi carbossilici, con reagenti adeguati, si
ottengono diversi derivati, tutti caratterizzati dalla
presenza del gruppo acilico —RCO.
24
Acidi
carbossilici
diffusione e
usi
Esteri, saponi, ammidi e
ammine
26
L’esterificazione
Gli esteri si ottengono per reazione fra un acido carbossilico e alcol ad alta
temperatura. La reazione
inversa all’esterificazione prende il nome di idrolisi.
Sono composti polari ma non formano forti legami idrogeni intermolecolari
Il nome è formato da due termini che individuano l’acido (ico-oico con ato-oato) e l’alcool
Esempio: ACETATO DI ETILE (ac. Acetico + alcool etilico)
27
Gli esteri in natura (II)
• basso PM
• Hanno un odore gradevole e sono impiegati per la
produzione di aromi sintetici.
•ACETATO DI ISOPENTILE ( aroma sintetico di banana)
28
• PENTANOATO DI ISOPENTILE (aroma sintetico mele)
Nota: La normativa Europea di conseguenza identifica 3 categorie di
aromi: aromi naturali, estratti da prodotti naturali, aromi naturalidentici, ottenuti per sintesi chimica, ma uguali a prodotti presenti in
natura, aromi artificiali ottenuti per sintesi chimica e non presenti in
natura.
http://ec.europa.eu/food/food/chemicalsafety/flavouring/database/dsp
Gli Aromi
Gli aromi sono composti usati per conferire odore e/o sapore
agli alimenti. La legislazione comunitaria e nazionale definisce
diversi tipi di aromi:
•
aromi naturali, natural-identici ed aromi artificiali
•
preparazioni aromatiche di piante o di origine animale
•
aromatizzanti di trasformazione che sviluppano aromi dopo
riscaldamento
•
aromi di fumo o di affumicatura.
•
http://www.salute.gov.it/portale/home.html
in Europa la legge prevede solo la dizione “aroma”; se si tratta
di un aroma naturale, l’etichetta (il produttore ne ha tutto
l’interesse) indicherà aroma naturale, altrimenti (aroma
naturale identico o artificiale) resterà la sola parola aroma.
Gli esteri in natura (I)
Esteri naturali ad alto peso molecolare sono le cere, i
grassi e gli oli.
• Le cere sono esteri di un acido carbossilico e di un alcol,
entrambi a lunga catena.
30
Gli esteri in natura (III)
• I grassi (solidi e saturi) e gli oli (liquidi e insaturi) sono
esteri del glicerolo (trigliceridi) con acidi carbossilici a
lunga catena sia saturi sia insaturi.
Modello
molecolare di (A)
un trigliceride
saturo; (B) un
trigliceride con una
catena insatura
Struttura generale di un trigliceride
31
A seconda della distanza dal metile
del primo doppio legame vengono
distinte tre serie di acidi grassi insaturi
che vengono denominati w9, w6, w3
(o anche n-9, n-6, n-3).
I mammiferi, pur avendo necessità di
disporre di una adeguata quantità di
polinsaturi w6 ed w3, non sono in
grado di operare una desaturazione in
queste posizioni. Gli acidi grassi
linoleico (18:2 w6) ed a-linolenico
(18:3 w3), "essenziali" per la vita
dell'organismo, devono quindi essere
assunti preformati con
l'alimentazione.
Contenuto in lipidi totali,
acidi grassi saturi totali,
monoinsaturi (acido oleico),
polinsaturi (linoleico,
a-linolenico) dei principali
grassi ed oli (g/100 g di
parte edibile)
Contenuto in lipidi totali,
acidi grassi saturi, monoinsaturi e
polinsaturi
di alcuni alimenti (g/100 g di
parte edibile
I saponi
I grassi e gli oli riscaldati con una soluzione acquosa di
NaOH (o di KOH) danno luogo a un’idrolisi alcalina
formando un sale.
I saponi sono i sali di sodio (o di potassio) degli acidi
grassi a lunga catena.
36
Saponificazione
La saponificazione è il processo per la produzione del sapone a
partire da grassi e idrossidi di metalli alcalini.
La saponificazione richiede l'idrolisi basica di un trigliceride, che
può essere un estere o acido grasso, per produrre il corrispettivo
sale sodico (carbossilato, più propriamente).
Assieme al sapone, i tradizionali processi di saponificazione
producono glicerolo
A seconda del tipo di base utilizzata nella loro preparazione, i
saponi acquistano proprietà differenti.
L'idrossido di sodio (NaOH) genera saponi solidi, mentre se si
impiega idrossido di potassio (KOH), si formano saponi liquidi.
I saponi: proprietà
I saponi sono formati da una lunga catena idrocarburica
detta coda, idrofobica, alla cui estremità si trova il
gruppo -COO– detto testa, che è idrofilo. A contatto con
un tessuto sporco, le code apolari disperdono le
molecole di grasso in acqua. L’azione detergente dei
saponi dipende dalla durezza dell’acqua, cioè dal
contenuto di sali di calcio e magnesio.
38
Le ammidi
Le ammidi sono derivati degli acidi carbossilici molto
diffuse in natura (per esempio nelle proteine). Vengono
classificate in:
• primarie, quando l’azoto ha un idrogeno sostituito con
un gruppo alchilico R—CO—NH2;
• secondarie, quando l’azoto ha due idrogeni sostituiti
con gruppi alchilici R—CO—NHR;
• terziarie, quando tutti gli idrogeni dell’azoto sono
sostituiti con gruppi alchilici R—CO—NR2.
39
© Zanichelli editore, 2014
Le ammidi: nomenclatura
La nomenclatura delle ammidi prevede la sostituzione
del suffisso -ammide al nome dell’acido
corrispondente. Anche in questo caso esistono nomi
tradizionali ancora utilizzati.
40
Le ammine
Le ammine derivano dall’ammoniaca (NH3) per
sostituzione di uno, due o tutti gli atomi di idrogeno con
altrettanti gruppi alchilici. Il gruppo funzionale delle
ammine è il gruppo amminico —NH2.
41
Le ammine: nomenclatura
• La nomenclatura delle ammine prevede che si
indichino i nome dei gruppi alchilici legati all’azoto
con la desinenza -ammina.
• Per le ammine aromatiche si usano spesso i nomi
correnti, per esempio anilina.
42
Le ammine: proprietà fisiche
Le ammine primarie e secondarie formano legami a
idrogeno intermolecolari, per cui i loro punti di
ebollizione sono più alti di quelli degli alcani a uguale
massa molecolare.
Per lo stesso motivo le ammine con pochi atomi di carbonio
sono solubili in acqua.
43
Le ammine: proprietà chimiche
Le ammine sono composti basici (deboli) in virtù del
doppietto elettronico libero dell’azoto.
La dimetilammina, per esempio, instaura in acqua
il seguente equilibrio:
44