Il Citoscheletro negli organismi Procarioti
Omologie con gli Eucarioti
Gabriele Zaffagnini
Matricola 0000283888
CdL in Biotecnologie
Per quanto ancora in fase di sviluppo, recenti studi1 attestano con sicurezza la
presenza, anche negli organismi procarioti di una complessa rete proteica con funzioni
analoghe al citoscheletro delle cellule eucariotiche, smentendo, così, la teoria che
prevedeva l’assenza di questa struttura nei batteri. Se è vero, infatti, che non si
riscontrano in queste cellule le proteine che compongono il citoscheletro degli eucarioti,
quali l’actina, la tubulina, le varie proteine dei filamenti intermedi e tutte le proteine
rispettivamente associate, è altrettanto vero, però, che sono presenti proteine
omologhe, in particolar modo alla tubulina (FtsZ) e all’actina (MreB), in grado di
svolgere funzioni non dissimili dalle loro controparti eucariotiche. Addirittura, si è ipotizzato
che queste famiglie proteiche omologhe possano derivare da ancestrali comuni.
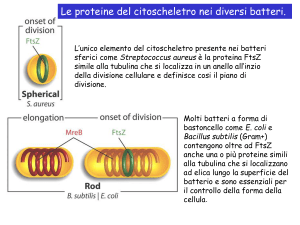
La proteina FtsZ
Sebbene la catena polipeptidica primaria corrisponda soltanto per il 10-18% con la
tubulina eucariotica, è stato rilevato, tramite studi cristallografici, che le due proteine sono
tridimensionalmente molto simili tra loro: entrambe sono dimeriche, GTP-dipendenti e in
grado di legare varie proteine associate. Questa omologia conformazionale determina
anche una corrispondenza funzionale: infatti, è stato osservato che in vitro i dimeri di FtsZ
associati a GTP polimerizzano rapidamente formando strutture filamentose molto simili
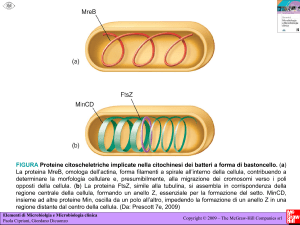
ai protofilamenti di tubulina. In vivo questi filamenti di FtsZ formano una struttura ad
anello chiamata Z-ring; la sua ultrastruttura non è ancora del tutto nota, ma si è già
potuto osservare che si trova in una condizione di equilibrio dinamico, esattamente
come i microtubuli nelle cellule vive: nuovi dimeri sono in continua polimerizzazione
all’estremità positiva, mentre altri depolimerizzano all’estremità negativa. Secondo alcuni
studi, è anche possibile, anche se meno frequente, che monomeri di FtsZ o anche
oligomeri già assemblati siano inseriti all’interno dell’anello o ne siano sottratti, attraverso
un processo di cross-linking. Inoltre, come alcune proteine associate ai microtubuli (MAP)
hanno funzioni regolative sulla loro polimerizzazione, sembrano essere state riscontrate nei
procarioti alcune proteine, come FtsA, coadiutrici della formazione del Z-ring.
Una seconda classe di analogie tra elementi collegati al citoscheletro eucariotico e
proteine presenti nei batteri è stata messa in luce osservando il ruolo della proteina MinD
nella funzionalità dell’anello di polimeri di FtsZ nella divisione cellulare (scissione
1
[Lowe et al., 2001], [Draper et al., 2002], [Møller-Jensen et al., 2002], [Carballido-Lopez et al., 2003],
[Mayer, 2003], [Lee and Steward, 2003], [Lowe et al., 2004], [Mayer, 2006], [Kumar Ghosh et al., 2006].
(Full text consultati tramite la banca dati accessibile dal sito www.biocfarm.unibo.it; in grassetto l’articolo analizzato più
approfonditamente.)
- 1 -
binaria). Si pensa, infatti, che sia il sistema proteico Min, tra cui è presente anche MinD,
a garantire un “punto di riferimento” per l’ancoraggio del Z-ring alla membrana plasmatica
dei procarioti, permettendo, così, la formazione di una strozzatura citoplasmatica nelle
fasi terminali della scissione. Si è così osservato che MinD ha una un funzionamento
analogo alla dinamina, una proteina eucariotica coadiutrice della formazione delle
invaginazioni della membrana che portano, poi, alla gemmazione di vescicole
endocitotiche.
Infine, è interessante rilevare che gli organuli delle cellule eucariotiche per cui si
suppone un’origine endosimbiontica (mitocondri e cloroplasti) presentano meccanismi
autonomi di duplicazione per scissione binaria regolati proprio da FtsZ.
La figura2 mostra la polimerizzazione e depolimerizzazione
di FtsZ a formare un Z-ring. In particolare, il riquadro (b)
mostra l’inserzione o la delezione di monomeri [A] di FtsZ
o di interi protofilamenti [B] all’interno dell’anello già
formato.
Il riquadro (A) mostra filamenti di
FtsZ ottenuti per polimerizzazione
associata a GTP in vitro. Il riquadro
(B) mostra il confronto tra le
ricostruzioni
tridimensionali
al
computer dei dimeri di tubulina, a
sinistra, e di FtsZ, a destra. Sono
evidenti le analogie morfologiche,
evidenziate dall’identica colorazione
per domini omologhi.
La proteina MreB
La seconda importante proteina strutturale presente nei procarioti che manifesta
omologie con il citoscheletro eucariotico è chiamata MreB. Nonostante anche in questo
caso la corrispondenza della catena polipeptidica con la sua controparte eucariotica,
l’actina G, sia solo al 15%, Mreb forma strutture polimeriche filamentose molto simili
all’actina F, soggette anch’esse a meccanismi di instabilità dinamica come già descritto
per StfZ. Una terza analogia che accosta questa proteina all’actina è il fatto che la
polimerizzazione di entrambe è ATP-dipendente.
A livello funzionale, MreB pare coinvolta nel mantenimento della forma non
sferica dei batteri spirilli o bacilli; le analisi rivelano, infatti, che una mutazione che ne
limiti la funzionalità, indotta nel suo gene corrispondente, porta alla perdita della tipica
forma allungata di E.Coli, e all’assunzione di una forma sferica. A supporto di questa tesi,
2
Tutte le figure riportate sono dedotte dall’articolo di Carballido-Lopez e colleghi, citato alla nota 1.
- 2 -
si trova anche che MreB non è presente nei cocchi, fatto che lascia presumere a, questo
punto, che quella sferica sia la forma di default, se non altro per le cellule procariotiche.
Un’altra nota importante è che la perdita della forma a bastoncello di B.Subtilis è indotta
anche da mutazioni provocate nei due geni adiacenti a quello per MreB, i quali
sintetizzano per due proteine chiamate MreC e MreD. Questo indica che anch’esse sono
coinvolte nel processo di mantenimento della forma non sferica del batterio, e, in
particolare, alcuni studi rilevano che MreC, grazie alla sua struttura transmembrana,
potrebbe essere coinvolta nella regolazione della sintesi dei peptidoglicani della
parete esterna, processo che sembra avvenire associato a MreB o a proteine dello stesso
gruppo. Oltre che nel dare forma, infatti, le proteine della famiglia di MreB sono coinvolte
anche nel processo di allungamento della cellula batterica. In particolare, è stato
dimostrato che Mbl (MreB-Like), con la sua forma filamentosa a spirale, in B.Subtilis è
responsabile della sintesi in forma elicoidale di nuove porzioni della parete
cellulare esterna.
Infine, ulteriori studi evidenziano che altre proteine della medesima famiglia actinlike, come ParM, sono responsabili della segregazione attiva di plasmidi batterici,
processo collegato con la duplicazione cellulare.
Come nel caso di FtsZ e la tubulina,
in figura è possibile notare le evidenti
corrispondenze
morfologiche
tra
l’actina e le proteine procariotiche
MreB, coinvolta nel mantenimento
della forma cellulare, e ParM, legata
al processo di ripartizione dei plasmidi
batterici.
Bologna, 3/1/07
Gabriele Zaffagnini
Matricola 0000283888
CdL in Biotecnologie
Allievo del Collegio Superiore dell’Alma Mater Studiorum di Bologna
- 3 -