I CARBOIDRATI
LA CHIMICA DELLA VITA
© GSCATULLO
(
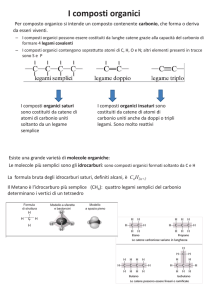
I Carboidrati
Le biomolecole
Cosa sono le biomolecole?
Le biomolecole sono quelle molecole presenti negli organismi viventi e da loro sintetizzate. Sono più di mille
miliardi di tipi diversi, ma possono essere suddivise in quattro classi fondamentali, tutte indispensabili per la
vita:
i carboidrati
le proteine
i lipidi
gli acidi nucleici
I carboidrati e i lipidi costituiscono le fonti energetiche per il nostro organismo, le proteine svolgono la
maggior parte delle funzioni che lo tengono in vita e quella strutturale, e gli acidi nucleici detengono le
informazioni che permetta alla cellula di vivere e riprodursi.
I Carboidrati
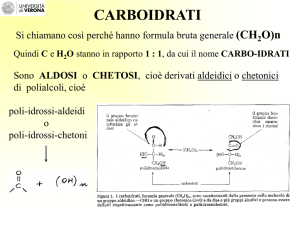
I carboidrati, detti anche saccaridi o glucidi, hanno formula bruta (𝐶𝐻2 𝑂)𝑛 con n > 3. Esistono sia in forma
semplice, monosaccaridi, che come polimeri, oligo- e poli-saccaridi, formati dall’unione di più monosaccaridi.
Sono la principale fonte di energia per gli organismi. Il monosaccaride più importante in questo senso, e
anche il più abbondante, è il glucosio, da cui derivano polisaccaridi come l’amido, la cellulosa e il glicogeno.
Monosaccaridi
I monosaccaridi sono generalmente costituiti da 3 a 7 atomi di carbonio e vengono classificati come aldosi o
chetosi in base alla presenza di un gruppo funzionale aldeidico o chetonico. L’aldoso più semplice è la
gliceraldeide, mentre il chetoso più semplice è il diidrossiacetone. Questi due zuccheri semplici vengono
chiamati triosi perché contengono tre atomi di carbonio, così gli altri prendono nome in base al numero di
carboni che hanno: tetrosi (4), pentosi (5), esosi (6), … I monosaccaridi più semplici sono solubili in acqua e
generalmente hanno un sapore dolce.
Da questi due zuccheri più semplici è possibile ricavare tutti gli altri semplicemente aggiungendo gruppi CH2O
al centro della molecola:
Isomeria ottica
Gli aldosi con almeno 3 atomi di carbonio ed i chetosi con almeno 4 atomi di carbonio contengono centri
chirali, possono esserlo tutti quei carboni che si trovano tra il primo e l’ultimo carbonio della molecola, e che
sono detti carboni asimmetrici.
L’esistenza del centro chirale, che individuiamo grazie ad un particolare modo di rappresentare le molecole
chiamato proiezione di Fischer (che abbiamo già usato sopra), provoca l’esistenza di due stereoisomeri. Per
ogni centro chirale cioè, la molecola avrà due possibili configurazioni speculari. Esse prendono nome di
enantiomeri e si indicano come configurazione D- e configurazione L-.
Prendendo come riferimento la forma D e la forma L della gliceraldeide è possibile individuare enantiomeri
di tutti i monosaccaridi guardando la posizione del gruppo OH del carbonio stereogenico, il secondo partendo
dal basso con il gruppo aldoso in alto: se OH si trova a destra la configurazione sarà D, se si trova a sinistra L.
Gli enantiomeri hanno la stessa reattività chimica e le stesse proprietà fisiche, ad eccezione del senso di
rotazione del piano della luce polarizzata. Le molecole chirali sono infatti dotate di attività ottica, sono cioè
in grado di ruotare il piano della luce polarizzata. L’attività ottica delle molecole si determina con il
polarimetro. Il senso destrorotatorio viene indicato con il simbolo (+) mentre quello levorotatorio con il
simbolo (-). Il potere rotatorio specifico dei due enantiometri è uguale in valore assoluto, ma di segno
opposto, da qui il nome di antipodi ottici. Una miscela di due enantiomeri presi in parti uguali (al 50%) non
è otticamente attiva, ovvero non devia il piano della luce polarizzata, perché le deviazioni si annullano a
vicenda, questa miscela si chiama racemica.
Nelle molecole che hanno più centri chirali possono essere individuati altri stereoisomeri oltre gli
enantiomeri, le differenze tra essi danno luogo ai diastereoisomeri. Il numero di stereoisomeri di queste
molecole si calcola come 2𝑛 , dove n sono il numero di carboni chirali ovvero asimmetrici.
I composti che differiscono per la posizione di un solo gruppo OH legato al carbonio asimmetrico prendono
nome di epimeri.
La forma ciclica
I monosaccaridi non si trovano in natura come li abbiamo rappresentati fino ad ora, in
forma “aperta” ben visibile grazie alla proiezione di Fischer, ma in forma ciclica (o
“chiusa”). La chiusura dell’anello avviene per reazione nucleofila tra il gruppo –OH legato
a uno degli atomi di carbonio terminali della catena, e il gruppo aldeidico o chetonico. Per
rappresentare le forme cicliche degli zuccheri si utilizzano le formule di Haworth, che
rappresentano l’anello come fosse piano e visto di lato, si pone in alto a destra l’ossigeno
nell’anello, gli atomi di carbonio si contano dalla sua destra, partendo dal C-1, e i sostituenti
(H, OH, ecc.) si trovano sopra o sotto il piano dell’anello.
In base alla posizione del gruppo ossidrile OH rispetto al carbonio C-1 è possibile individuare due nuovi
isomeri detti anomeri. Se il gruppo si trova sotto il piano della molecola si farà precedere al nome dello
zucchero -, se si trova sopra si farà precedere -.
Anche gli zuccheri pentosi possono avere forme chiuse. Le strutture ad anello che si vengono a formar sono
dette furanose se a cinque termini e piranose se a sei, perché ricordano rispettivamente il furano e il pirano,
due composti chimici.
Gli anomeri sono soggetti ad un particolare fenomeno chiamato mutarotazione. Quando un α -D-Glucosio è
messo in soluzione acquosa dà una rotazione ottica di +112° che diminuisce sino a raggiungere i +52°, tipico
valore della forma D. A sua volta quando ad essere messo nell’acqua è il β -D-Glucosio dà una rotazione ottica
di +19° che aumenta sino a +52°. Questo perché nell’acqua l’anello si apre e si richiude alternando le due
forme.
Zuccheri particolari
I monosaccaridi più utilizzati nell’industria alimentare sono:
lo xilitolo, non fermentabile dalla microflora orale non causa le carie, per questo è usato nelle
gomme da masticare;
il sorbitolo, dolcificante utilizzabile anche come umettante;
il mannitolo, antiedemigeno, contro l’edema, potente lassativo.
Disaccaridi e polisaccaridi
I disaccaridi
I disaccaridi sono formati dall’unione di due monosaccaridi per reazione dell’-OH anomerico dell’uno con un
gruppo –OH alcolico dell’altro, che va a formare un legame di glicosidico (O-glicosidico o glucosidico), con un
ossigeno che fa da “ponte” e lega le due molecole. Questo legame è detto di condensazione perché nella sua
formazione si rilascia una molecola d’acqua H2O.
I disaccaridi più importanti sono:
il saccarosio, lo zucchero di canna e di barbabietola;
GLUCOSIO + FRUTTOSIO. Legame α 1 2 β
il maltoso, lo zucchero del malto;
GLUCOSIO + GLUCOSIO. Legame α 1 4 α
il lattosio, lo zucchero del latte;
GALATTOSIO + GLUCOSIO. Legame β 1 4 β
il cellobioso, ottenuto per parziale idrolisi della cellulosa;
GLUCOSIO + GLUCOSIO. Legame Legame β 1 4 β
Nel nostro organismo sono presenti degli enzimi idrolitici, cioè capaci di sciogliere il legame di condensazione,
specifici detti idrolasi. Sciogliere un legame significa riottenere i monosaccaridi originari, che possono essere
riutilizzati, cioè digerirli. Tuttavia questi enzimi non hanno un’azione “universale”, ma sono specializzati in
base al tipo di legame che devono rompere. Nel nostro organismo si trova l’amilasi, che rompe il legame α,
e la lattasi, che rompe quello β del lattosio. L’assenza della lattasi provoca l’intolleranza al lattosio che non
può essere digerito. Gli erbivori hanno invece nel loro stomaco un altro enzima, la cellulasi, che gli permette
di digerire la cellulosa, mentre noi quando ci nutriamo di verdure e altri cibi contenenti cellulosa non ne
ricaviamo energia ma solo sali minerali e vitamine!
I polisaccaridi
I polisaccaridi sono polimeri ad alta massa molecolare derivati dall’unione di molte unità di monosaccaridi (i
monomeri) naturali; la maggior parte ne contiene mediamente un centinaio, ma ci sono casi, come la
cellulosa, dove arrivano anche a più di 3000 unità! Si dicono omopolisaccaridi quelli formati da un unico tipo
di monosaccaride ed eteropolisaccaridi quelli formati da monosaccaridi di tipo diverso. I polisaccaridi più
importanti biologicamente possono svolgere funzione di deposito (es. amido, glicogeno) o strutturale (es. la
cellulosa).
I polisaccaridi più importanti sono:
l’amido, omopolisaccaride dell’ α-D-glucopiranosio, presente soprattutto nelle patate e nei semi dei
cereali, è la riserva di carboidrati tipica delle piante. Esiste in due forme: una lineare (α-amilosio 1030%) e una ramificata (amilopectina, 70-90%) in cui catene lineari sono collegate tra di loro con
legami di tipo α1 6.
Negli animali la digestione dell’amido comincia in bocca con l’enzima amilasi salivare, prodotto dalle
ghiandole salivari, che taglia i legami α14 glicosidici solo all’interno della catena (attività
endoamilasica). Quest’attività è poco efficace sull’amido crudo, che se scaldato si rigonfia e assume
acqua permettendone l’azione.
il glicogeno è il polisaccaride di riserva degli organismi animali, normalmente accumulato nel fegato
(ne costituisce fino al 10% del peso) e nei muscoli, che può essere costituito fino a 100 000 unità di
glucosio e ha una struttura simile a quella dell’amilopectina, ma molto più ramificata, per favorire
l’accesso e l’utilizzo da parte delle glicogeno fosforilasi. Quando ingeriamo glucosio ed esso non è
immediatamente necessario, esso viene immagazzinato sotto forma di glicogeno.
La cellulosa è il polimero più abbondante
presente sulla terra, e svolge funzione strutturale
riunita nelle fibre vegetali. È un omopolisaccaride
lineare di D-glucosio formato da legami β 1 4,
questa l’unica eccezione – la configurazione
anomerica-, che lo differenzia dall’amilosio. Può
essere digerita facilmente dagli erbivori e dalle
termiti che ospitano nel loro stomaco batteri che
secernono la cellulasi, una beta-glucosidasi, in
grado di idrolizzare (rompere i legami) la
cellulosa.
Altro importante polisaccaride strutturale, oltre la cellulosa, è la
chetina, usata nell’esoscheletro degli artropodi e nella parete
cellulare di alcuni funghi. È simile alla cellulosa ma contiene
azoto.
Realizzato da Paolo Franchi, 5°BC A.S. (2015/2016) il
03/03/2016.
AMDG