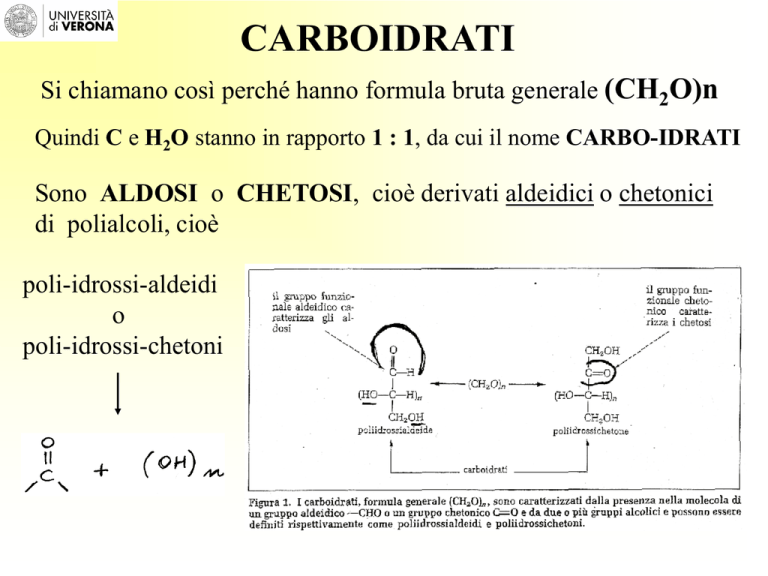
CARBOIDRATI
Si chiamano così perché hanno formula bruta generale (CH2O)n
Quindi C e H2O stanno in rapporto 1 : 1, da cui il nome CARBO-IDRATI
Sono ALDOSI o CHETOSI, cioè derivati aldeidici o chetonici
di polialcoli, cioè
poli-idrossi-aldeidi
o
poli-idrossi-chetoni
Formula generale (CH2O)n
Monosaccaridi
sono aldeidi o chetoni poliossidrilici
solidi cristallini inodori, incolori,
idrosolubili.
Contengono uno o più atomi di C*,
asimmetrici, e quindi sono presenti in
natura sotto forma di vari
diasteroisomeri (anomeri, epimeri)
Si dividono in:
•Aldosi (ribosio, glucosio,
galattosio,…)
•Chetosi (fruttosio,…)
D-gliceraldeide
aldoso
chetoso
DIASTEREOISOMERI
diastereoisomeri, o diastereomeri, due stereoisomeri che
non sono l'uno l'immagine speculare dell'altro.
Spesso e in modo equivalente si definiscono
diastereoisomeri due stereoisomeri che non sono
enantiomeri.
CHETOSI
Principali
chetosi
della serie D
PENTOSI
ESOSI
TRIOSO
TETROSO
NON
CHIRALE
CHIRALI
Tutti Chirali
ALD O SI
TRIOSO
TETROSI
PENTOSI
ESOSI
CLASSIFICAZIONE DEI CARBOIDRATI
MONOSACCARIDI : NON possono essere demoliti per IDROLISI
OLIGOSACCARIDI:
DISACCARIDI, TRISACCARIDI, ecc.
fino a 10 unità
POLISACCARIDI:
aventi PIU’ di 10 unità saccaridiche, possono essere
di STRUTTURA o di RISERVA
OLIGO- e POLISACCARIDI possono essere demoliti per idrolisi
a poche unità saccarìdiche, fino a diventare MONOSACCARIDI
I MONOSACCARIDI hanno tutti almeno 1 centro chirale,
ad eccezione del DIIDROSSIACETONE
NOMENCLATURA E CONFIGURAZIONE
Il capostipite è la D- o L-gliceraldeide
Si hanno chetosi o aldosi a 3, 4 , 5, 6 atomi di C:
TRIOSI
3C
TETROSI
4C
PENTOSI
ESOSI
5C
6C
D-gliceraldeide
Esempi PENTOSI: Ribosio (RNA), 2-desossi-Ribosio (DNA)
ESOSI: Glucosio, o Destrosio
Glucosio: importantissimo per le cellule, perché è “carburante” di esse; circola
nel sangue e a volte si trova in eccesso nelle urine, diabete mellito.
Se scarseggia viene somministrato per endovena.
Durante la digestione TUTTI i carboidrati POLISACCARIDI
vengono degradati a e/o trasformati in GLUCOSIO
ALCUNI MONOSACCARIDI
Glucosio e galattosio : già visti
D-MANNOSIO: si trova in certi batteri, funghi
E piante, ma quasi mai come monosaccaride;
Nei vegetali come polisaccaride di riserva
(MANNANI), e a volte è associato al galattosio
D-FRUTTOSIO: si trova nella frutta e nel miele
Come disaccaride
FRUTTOSIO + GLUCOSIO = SACCAROSIO
Il fruttosio ha alto potere dolcificante:
Scaldando il saccarosio si libera fruttosio
come caramello, molto dolce
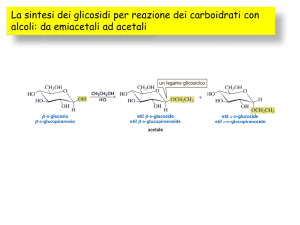
Aldeidi e chetoni possono SOMMARE alcoli
ALDEIDE
CHETONE
Gli zuccheri sono POLIOLI che sommati ad ALDEIDE danno ACETALI
sommati a CHETONI danno CHETALI
α
Carbonio
anomerico
β
Glucosio
Fruttosio
Cheto-Esoso (6 C) ma ciclo a 5 !
Chiusura con ciclo a 5 come il
ribosio, che però è un aldo-pentoso
Ribosio
CICLIZZAZIONE ANOMERICA
Gli ZUCCHERI sono particolari CHETONI o ALDEIDI
Aldeidi e Chetoni possono SOMMARE ALCOLI, per dare
EMICHETALI / EMIACETALI
(ch. / ald. + 1 Alcol)
CHETALI / ACETALI
(ch / ald + 2 Alcoli – H2O)
Negli zuccheri funzione aldeidica o chetonica è presente
insieme a molte funzioni alcoliche, per cui si può avere una
SOMMA con ciclizzazione INTRAMOLECOLARE
E’ “facile” se lo zucchero è a 5 o 6 atomi di C : cicli a 5 o 6 C sono stabili
In questo modo si forma un EMIACETALE o EMICHETALE in cui il
carbonio 1 (o 2), inizialmente carbonilico, diventa sp3 e quindi ASIMMETRICO
Si formano così 2 DIASTEROISOMERI, definiti ANOMERI, in cui il
carbonio 1 (o 2) è il carbonio ANOMERICO, (C1) sotto il piano, o sopra
PIRANO
ANOMERI
FURANO
MUTAROTAZIONE
Rappresentazione di Haworth
CARBONIO ANOMERICO
MOLTO IMPORTANTE perché:
AMIDO (polisaccaride 1-4 Glucosio) viene digerito dall’AMILASI
CELLULOSA ( “ “
1-4 Glucosio) NON viene digerita !!
EPIMERI
Ancora diasteroisomeri aventi lo stesso carbonio anomerico ( o )
ma con configurazione invertita ad uno solo degli altri.
Ad esempio, Glucosio e Galattosio,
che si legano formando il disaccaride
Lattosio, sono EPIMERI al C4
REAZIONI dei MONOSACCARIDI
Oltre alla ciclizzazione anomerica si hanno:
OSSIDAZIONE da alcoli ad aldeidi e acidi carbossilici e
quindi gli ZUCCHERI sono RIDUCENTI
Si può ossidare la funzione ALDEIDICA al C1, ma anche la funzione
alcolica al C6. Quindi si può avere COOH in C1, o in C6 , o in entrambi.
COOH in C1: acido Gluconico
COOH in C6: acido Glucuronico
COOH in C1 e C6 acido Glucarico
L’ossidazione degli
Zuccheri è utile per la
loro identificazione e
quantificazione
nei liquidi biologici
OSSIDAZIONE degli ZUCCHERI
Reattivo di Fehling: colorimetrico Cu++ (blu) diventa Cu+ ( rosso)
Reatt. di Benedict, stesso principio, ma usa Cu(OH)2 invece che CuSO4
Opportune ‘strisce’ di carta imbevute di questi reagenti consentono la rapida
determinazione del contenuto di glucosio nelle urine (…diabete)
Riassumendo
si ha la seguente
sequenza
OSSIDATIVA
Ma NON tutti gli zuccheri sono riducenti !
DISACCARIDI (OLIGOSACCARIDI)
Quando 2 monosaccaridi reagiscono tra loro attraverso l’ossidrile EMIACETALICO
del primo e qualsiasi ossidrile del secondo si forma un DISACCARIDE con un
LEGAME GLICOSIDICO (acetalico) - H2O
o a seconda che l’emiacetale di partenza sia anomero o
Il legame glicosidico è molto più forte del legame emiacetalico e non può
essere Scisso con i comuni reagenti ossidanti (Fehling o Benedict)
Ma lo stesso legame glicosidico viene idrolizzato in vivo a 37°C con enzimi
Legame O-glicosidico gruppo ossidrilico di
uno zucchero che reagisce con il Carbonio
Anomerico di un altro zucchero (esce H2O!)
Può essere di tipo α o β
β
α
α
β
DISACCARIDI
Alcuni sono riducenti,
altri NO
C12H22O11
Se il legame glicosidico interessa
l’OH anomerico (carbonilico)
di uno solo dei 2 si hanno disaccaridi
riducenti, altrimenti NO !
Questi sono
TUTTI
RIDUCENTI
DISACCARIDI
Gluc.
NON RIDUCENTI
1
2
Frutt.
(GLUCOSIO + FRUTTOSIO)
Legame glicosidico che coinvolge entrambi gli OH anomerici
Nel Fruttosio (Chetoso) il C anomerico è il C2
POLISACCARIDI
(1) di STRUTTURA o (2) di RISERVA
Derivando da pentosi ed esosi vengono in generale anche classificati come
PENTOSANI ed ESOSANI, ma è meglio classificarli secondo la loro funzione
Hanno Peso Molecolare altamente VARIABILE, tra 10.000 e 1.000.000 Dalton
A differenza dei mono- e disaccaridi sono INSOLUBILI in H2O, perchè sono
polimeri che si idratano solo in superficie, in misura insufficiente per solubilizzarsi
NON sono RIDUCENTI, anche se hanno una estremità anomerica libera,
ma è troppo poco in una molecola così grande
Oltre a quelli di struttura e di riserva vi è una terza classe:
POLISACCARIDI COMPLESSI
Polimeri ad alto peso molecolare formati da numerose
unità di monosaccaridi. Si distinguono in
omopolisaccaridi e eteropolisaccaridi
Omopolisaccaridi con
funzione di riserva
energetica:
•AMIDO Polisaccaride di riserva
delle cellule vegetali. Polimero di
unità di glucosio unite da legame
glicosidico (α 14). È formato da
amilosio e amilopectina (ramificata
(α 16)).
•GLICOGENO Polisaccaride di
riserva delle cellule animali in
particolare nel fegato e nel muscolo
scheletrico. Polimero di unità di
glucosio unite da legame glicosidico
(α 14) con ramificazioni (α 16).
POLISACCARIDI DI STRUTTURA
Cellobiosio
disaccaride 1- 4
CELLULOSA
Polisaccaride 1- 4
Glucosio-Glucosio
La cellulosa forma le pareti cellulari (il reticolo strutturale) delle piante, da cui
la carta è fatta di cellulosa, e il solo fatto di avere un legame -glicosidico la rende
NON digeribile. L’amido è uguale, ma con legame , idrolizzabile dall’amilasi!
POLISACCARIDI DI RISERVA
Costituiscono una parte delle riserve energetiche degli organismi
Il glucosio può essere prodotto dalla fotosintesi clorofilliana
AMIDO :
Amilosio
+
Amilopectina
GLICOGENO: riserva di glucosio nele fegato degli animali
AMILOPECTINA
GLICOGENO
Amilopectina
Glicogeno
Omopolisaccaridi con funzioni
strutturali:
•CELLULOSA: presente nei vegetali
verdi. Unità di glucoso legate da legami
glicosidici (β 14). Struttura allungata
che conferisce rigidità e resistenza alla
parete cellulare delle piante.
•CHITINA: Unità di NAcglucosamina
unite da legami (β 14). Conferisce
rigidità e resistenza all’esoscheletro di
insetti, ragni e crostacei.
GLICOSAMMINOGLICANI
Polimeri lineari formati
da unità disaccaridiche
ripetute in cui i due
monosaccaridi sono
zuccheri modificati. Sono
costituenti della matrice
extracellulare assieme ad
alcune proteine fibrose
come il collagene.
PROTEOGLICANI:
proteine e glicosaminoglicani
presenti nella matrice
extracellulare si aggregano
sia in modo covalente che
non covalente.Struttura
molto estesa a forma di
spazzola. Principali
costituenti del tessuto
connettivo a cui conferiscono
resistenza meccanica
GLICOPROTEINE:
quasi tutte le
proteine secrete o
associate alle
membrane delle
cellule di cellule
eucariote.Contengono
uno o più polisaccaridi
uniti covalentemente
durante la traduzione
mediante legami Nglicosidici o Oglicosidici
Glicoconiugati
1. Iniziale digestione nella bocca ad
opera dell’α-amilasi salivare
2. Ulteriore digestione ad opera dell’αamilasi pancreatica e di disaccaridasi
e oligosaccaridasi prodotti dalla
mucosa intestinale
3. Assorbimento da parte delle cellule
della mucosa intestinale
I trasportatori del
glucoso
attraverso la
membrana
plasmatica sono
detti GLUT. Alcuni
sono sempre
presenti nella
membrana, altri
vengono trasferiti
sulla membrana
in risposta
all’insulina.
L’ingresso del glucoso nella cellula è reversibile, ma la
reazione di fosforilazione catalizzata dall’esochinasi è
endoergonica e praticamente irreversibile. Il G6P viene
praticamente “intrappolato” all’interno della cellula.
Il destino del glucoso-6-fosfato
Riserva
Produzione di energia
Potere riducente (NADPH) e
precursori di acidi nucleici