MOD_3 : GLUCIDI
I carboidrati (o zuccheri o glucidi) sono composti chimici formati da carbonio (C), idrogeno (H)
e ossigeno (O) e rappresentano gli alimenti più usati a scopo energetico, dato che vengono
completamente bruciati dall'organismo (energia di pronto impiego).
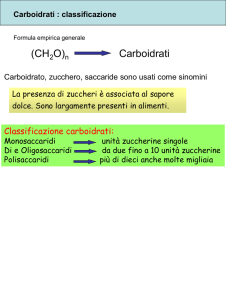
Queste sostanze si dividono in tre gruppi a seconda della loro struttura; monosaccaridi,
oligosaccaridi e polisaccaridi. I monosaccaridi sono i glucidi più semplici, risultando formati da
una sola molecola; i principali sono il glucosio, il fruttosio, il galattosio e il mannosio. I
disaccaridi sono formati da due monosaccaridi; i principali sono il saccarosio, il maltosio, il
lattosio e il cellobiosio. Gli oligosaccaridi sono formati dall'unione di più molecole di
monosaccaridi (4-14 circa); I polisaccaridi, infine, sono carboidrati complessi derivati
dall'unione di un numero elevatissimo di monosaccaridi legati gli uni agli altri per formare
lunghissime catene lineari o ramificate; i più importanti sono l'amido (riserva energetica nei
vegetali), la cellulosa (fonte strutturale nei vegetali) e il glicogeno (riserva energetica negli
animali).
Assorbimento
Tutti i carboidrati, dopo essere stati introdotti nell'organismo, devono essere ridotti con la
digestione alla forma più semplice (monosaccaridi) prima di essere assorbiti dall'intestino.
Dall’intestino giungono al fegato, da dove sono distribuiti ai tessuti del corpo come sorgente di
energia. Così i carboidrati sono rapidamente utilizzati dall’organismo, verso il quale svolgono
prevalentemente una funzione energetica. Una piccola quantità di carboidrati viene
prudentemente immagazzinata nel fegato sotto forma di glicogeno: serve come riserva e per
mantenere il livello di glicemia, cioè il contenuto di glucosio nel sangue, al suo valore
normale, quando esso si abbassa.
Un’altra quota viene immagazzinata nei muscoli sempre sotto forma di «glicogeno
muscolare» che sarà utilizzato solo dal muscolo per la sua attività. Le fonti alimentari più
ricche di glucidi sono i cereali e i legumi secchi (50-90%), il pane (50%), le patate (20%), la
frutta (5-20%). Sono praticamente sprovvisti di glucidi la carne, il pesce, le uova e i formaggi.
Le funzioni dei carboidrati sono essenzialmente quattro:
1. riserva energetica, combustibili e intermedi metabolici
2. impalcatura strutturale del DNA e dell’RNA (ribosio e desossiribosio)
3. elementi strutturali delle pareti cellulari di batteri e piante (infatti la cellulosa, il principale
costituente delle pareti cellulari delle piante, è uno dei composti organici più abbondanti
nella biosfera)
4. i carboidrati, legati a proteine e lipidi, svolgono ruoli essenziali nel mediare le interazioni tra
le cellule e tra le cellule ed altri elementi presenti nell’ambiente cellulare)
Nomenclatura
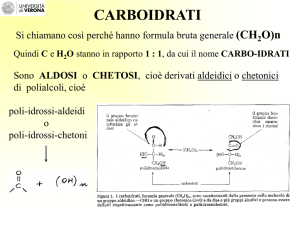
I monosaccaridi sono aldeidi o chetoni con più gruppi ossidrilici
Assumono sempre la desinenza –oso (oppure –osio)
I monosaccaridi vengono classificati
- in base al numero degli atomi di carbonio che contengono: triosi (C3), tetrosi (C4), pentosi
(C5), esosi (C6)…
1
- in base alla presenza di un gruppo carbonilico: chetonico o aldeidico rispettivamente in
chetosi o aldosi
Aldoso
Chetoso
Chimica dei carboidrati
I carboidrati contengono tre gruppi funzionali: alcoli, chetoni e aldeidi, quindi daranno le
reazioni caratteristiche di questi gruppi funzionali.
Ciclizzazione dei carboidrati (formazione di semiacetali)
I carboidrati in soluzione non sono catene aperte, ma si trovano sottoforma di anelli.
In generale gli alcoli possono sommarsi reversibilmente alle aldeidi formando i semiacetali.
In generale, però , la formazione del semiacetale tra un alcol e un'aldeide è una reazione
sfavorita ed è quindi spostata verso sinistra. Infatti, anche se i legami formati sono
globalmente più stabili di quelli di partenza, la reazione è svantaggiosa in termini di disordine
molecolare, cioè di entropia, dato che due molecole, l'alcol e l'aldeide, condensano per darne
una, il semiacetale.
I monosaccaridi costituiscono un'eccezione a questa regola generale infatti possiedono
contemporaneamente il gruppo aldeidico e quello alcolico nella stessa molecola e quindi
possono formare un semiacetale ciclico per condensazione intramolecolare.
Nel glucosio la formazione del legame semiacetalico porta alla chiusura di un anello a sei
atomi privo di tensioni. Questa reazione risulta altamente favorita dato che non comporta
diminuzione del numero di molecole e quindi l'entropia non è più sfavorevole. Il D-glucosio
esiste, all'equilibrio, prevalentemente in forma ciclizzata nella quale l'ossidrile in posizione 5
ha reagito con il C-1 aldeidico formando un legame semiacetalico intramolecolare, mentre
solo una piccola quantità , lo 0.02%, resta nella forma aldeidica libera.
2
In linea di principio, tutti e cinque gli ossidrili potrebbero sommarsi al gruppo carbonilico per
formare semiacetali ciclici di diversa grandezza. Di solito, però , risulta preferita la formazione
dell'anello a sei atomi che viene chiamato piranosio, nome derivato dal pirano, un etere ciclico
mostrato in figura. In alternativa si può formare un anello a cinque atomi chiamato furanosio,
dal furano. A differenza del glucosio, che esiste soprattutto come piranosio, il fruttosio può
dare sia un anello a sei che a cinque atomi chiamati rispettivamente fruttopiranosio e
fruttofuranosio che all'equilibrio in soluzione sono presenti nella proporzione 70 : 30.
Si osservi che il carbonio carbonilico ha una geometria planare e, come si vede nelle figure
sotto, l'ossidrile può attaccare il carbonio aldeidico da sopra o da sotto il piano molecolare,
formando due diversi semiacetali isomeri chiamati anomeri α e β, il nuovo carbonio
asimmetrico viene chiamato anche carbonio anomerico.
Proiezioni di Haworth
Le strutture cicliche di glucosio e fruttosio sono state disegnate nella pagina precedente
usando le proiezioni conformazionali. Questo è il modo più moderno e corretto per
rappresentarle, ma esistono altre convenzioni accettate: le proiezioni di Fischer e quelle di
Haworth.
Nelle proiezioni di Fischer “aperte”, per convenzione, si scrive la molecola con il carbonio
più ossidato in alto. I carboni asimmetrici occupano il centro dei legami a croce, i legami
verticali si intendono diretti sotto il piano del foglio, i legami orizzontali verso chi guarda.
Le proiezioni di Haworth rispecchiano meglio la reale struttura tridimensionale degli zuccheri.
Secondo questa convenzione l'etere ciclico deve essere rappresentato come un esagono o
un pentagono con il carbonio anomerico a destra e l'ossigeno eterociclico in alto. I legami che
escono dall'anello devono essere disegnati come trattini verticali.
Come trasformare una struttura di Fischer in una di Haworth
3
1) In questo esempio vogliamo ottenere un β-piranosio a partire dal D-glucosio. Per prima
cosa bisogna numerare la catena del glucosio fino a identificare l'OH che chiude l'anello.
L'OH che chiude il ciclo a sei atomi è quello sul C-5, l'OH principale.
2) Disegnare la struttura dell'anello piranosidico secondo la proiezione di Haworth e numerare
la catena di atomi di carbonio.
3) Trascrivere i gruppi OH dalla struttura di Fischer a quella di Haworth. Gli OH che si trovano
a destra in Fischer vanno posti in basso nella struttura di Haworth. L'OH principale sul C-5
non va trascritto dato che è coinvolto nel legame semiacetalico. Scrivere quindi solo gli OH
sui carboni 2, 3 e 4.
4) Scrivere ora il CH2OH terminale che va posto sul C-5 dalla parte opposta a quella che
spettava all'OH principale, quindi verso l'alto.
5) Infine va disegnato l'OH anomerico sul C-1, il nuovo centro asimmetrico. In questo caso,
dato che vogliamo ottenere l'anomero β, l'OH va posto in trans rispetto alla posizione che
spettava all'OH principale, cioè va posto sopra.
Proiezioni conformazionali
Le proiezioni di Haworth descrivono meglio la struttura tridimensionale degli zuccheri rispetto
a quelle di Fischer, ma sono in ogni caso una semplificazione. Per avere una
rappresentazione più accurata si utilizzano le proiezioni conformazionali che rappresentano i
piranosi come strutture a sedia e i furanosi come strutture a busta. In questo modo è possibile
valutare meglio i dettagli strutturali distinguendo i legami assiali da quelli equatoriali. Le
4
considerazioni fatte con le proiezioni di Haworth a proposito di forme D e L, anomeri α
β
conformazionali. Per convenzione l'ossigeno semiacetalico
va disegnato in alto e il carbonio anomerico a destra.
Chimica del glucosio
La chimica del glucosio è caratterizzata dalla presenza del legame semiacetalico, infatti la
maggior parte delle reazioni del glucosio avvengono o sull'aldeide libera, dopo apertura
dell'anello, o per sostituzione dell'OH anomerico per formare acetali.
Reazioni sull'aldeide libera.
Il glucosio, dopo l'apertura dell'anello, può dare le reazioni tipiche delle aldeidi. L'apertura
dell'anello con scissione del legame etereo semiacetalico può avvenire con catalisi sia acida
che basica.
Ossidazione
L'ossidazione degli zuccheri può essere condotta sia in ambiente basico che in ambiente
acido. Mentre l'ossidazione in ambiente alcalino è utilizzata solo per scopi analitici, quella in
ambiente acido è utilizzata sia a scopo analitico che preparativo (a noi interessa l’ossidazione
in ambiente basico). Una blanda ossidazione degli aldosi produce i corrispondenti acidi
carbossilici chiamati acidi gliconici, un'ossidazione più energica produce gli acidi dicarbossilici
chiamati acidi glicarici.
Esistono tre diversi reattivi per operare l'ossidazione alcalina degli aldosi e dei chetosi che
vengono trasformati in acidi gliconici:
1) Reattivo di Fehling. E' composto da due soluzioni A e B da mescolare al momento dell'uso.
La soluzione A contiene CuSO4. La soluzione B contiene tartrato di sodio ed NaOH. Il tartrato
ha la funzione di complessare il Cu2+ che altrimenti precipiterebbe come idrossido. La specie
ossidante è il Cu2+ che si riduce a Cu+ precipitando come ossidulo di rame Cu2O rosso.
2) Reattivo di Benedict. E' identico al Fehling con la differenza che usa lo ione citrato al
posto del tartrato ed è composto da una sola soluzione stabile nel tempo.
3) Reattivo di Tollens. E' composto da una soluzione ammoniacale di AgNO 3 che contiene il
complesso Ag(NH3)2+. La specie ossidante è lo ione Ag+ che si riduce ad Ag metallico e
precipita sotto forma di specchio sulla superficie interna della provetta.
5
Questi tre reattivi permettono di eseguire dei saggi qualitativi (talora anche quantitativi) per
determinare se un certo zucchero è ossidabile in condizioni basiche. Uno zucchero che
reagisce positivamente a questi saggi viene definito zucchero riducente. Il gruppo aldeidico
dello zucchero viene ossidato e si forma un acido carbossilico chiamato acido gliconico. Dato
però che l'ossidazione avviene in ambiente basico, possono reagire anche molecole che non
contengono inizialmente il gruppo aldeidico, ma che lo possono generare per isomerizzazione
alcalina. Ecco perché possono reagire oltre alle aldeidi come il D-glucosio anche gli alfaidrossichetoni come il fruttosio che viene prima isomerizzato a glucosio e mannosio e poi,
sotto questa forma, può essere ossidato ad acido gluconico e mannonico.
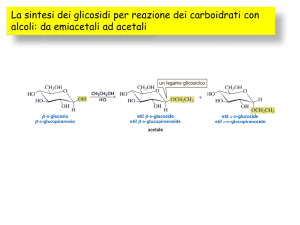
Reazioni con sostituzione dell'OH anomerico. (formazione di glicosidi)
I monosaccaridi si possono legare ad alcoli ed ammine mediante legami glicosidici. Ad
esempio il glucosio reagirà con il metanolo in un processo catalizzato da un acido: l’atomo di
carbonio anomerico reagisce con il gruppo ossidrilico del metanolo per formare due prodotti: il
metil a-D-glucopiranoside ed il metil b-D-glucopiranoside. I due glucopiranosidi differiscono
nella configurazione alivello dell’atomo di carbonio anomerico. Il nuovo legame formato tra
l’atomo di carbonio anomerico del glucosio e l’atomo di ossigeno ossidrilico del metanolo è
detto legame glicosidico, specificamente legame O-glicosidico.
L’atomo di carbonio anomerico di uno zucchero può legarsi all’atomo di azoto di un’ammina
mediante il legame N-glicosidico.
In natura, invece, queste reazioni non sono lasciate al caso, ma sono condotte da enzimi
specifici. Per esempio, nella sintesi del glicogeno, l'UDP-glucosio (uridina difosfato glucosio)
viene idrolizzato e trasformato nel carbocatione intermedio a forma di mezza sedia, questo
può reagire solo con il lato inferiore della molecola dato che si trova legato nel sito attivo
dell'enzima che rende inaccessibile l'altra faccia. Così per reazione con l'OH, legato al C-4
terminale di una catena di glicogeno in accrescimento, si ottengono solo legami di tipo alfa,
come è illustrato nella figura seguente.
6
Abbiamo visto che i monosaccaridi reagiscono con ossidanti come lo ione Cu 2+ in quanto
l’anello dello zucchero può aprirsi per liberare il gruppo aldeidico che reagisce con lo ione
rameico. Invece i glicosidi non reagiscono con lo ione rameico perché non vengono
facilmente interconvertiti nella forma aperta che contiene il gruppo aldeidico libero.
Gli zuccheri che reagiscono con lo ione rameico sono detti zuccheri riducenti, quelli che non
reagiscono sono detti zuccheri non riducenti.
I glicosidi sono importanti in natura:
- Molte sostante naturali sono dei glicosidi, formati dall'unione di una sostanza non
carboidratica (aglicone) con uno zucchero attraverso un legame glicosidico. La glicosidazione
dell'aglicone serve a modificare le caratteristiche di solubilità, rendendo la sostanza più
solubile in acqua.
- Nei disaccaridi e nei polisaccaridi le unità di monosaccaridi sono unite tra di loro con legami
glicosidici
In laboratorio non è facile ottenere selettivamente un glicoside α
β
chimici
hanno trovato molti "trucchi" per realizzare tale selettività). La natura è invece molto efficiente.
Gli enzimi preposti alla creazione di legami glicosidici (glicosil transferasi) sono molto selettivi
sia riguardo al substrato (accettano solo un monosaccaride ben preciso) che riguardo alla
configurazione del carbonio anomerico che si va formando.
La salicina è una sostanza naturale, contenuta nella corteccia del salice, che è nota già da 3
secoli come antidolorofico. L'acido acetilsalicilico (aspirina) è stato trovato proprio esplorando
gli analoghi della salicina anche se, curiosamente, agisce in un modo completamente diverso.
Un'importante famiglia di antibiotici (antibiotici glicosidici) comprende composti di tipo
glicosidico (ad es. eritromicina, streptomicina, rifamicina). Di seguito è riportata la formula
dell’eritromicina:
7
I determinanti antigenici delle cellule
Gli oligosaccaridi sono oligomeri formati da un numero limitato di monosaccaridi (4-14). Sono
contraddistinti da un grande potenziale di chemiodiversità.
Infatti:
- Vi sono tantissimi monosaccaridi diversi
- Essi possono unirsi con vari tipi di legami glicosidici (1,1 - 1,2 - 1,3 - 1,4, etc.)
- Il legame glicosidico può essere α
β
Quindi anche gli oligosaccaridi, come le proteine e gli acidi nucleici, possono essere
depositari di un vero e proprio codice. La natura usa questo codice per riconoscere le cellule.
Gli oligosaccaridi sono esposti all'esterno della membrana cellulare e rappresentano i
determinanti antigenici (influenzano cioé l'attacco immunitario alle cellule).
I monosaccaridi che costituiscono questi oligosaccaridi sono soprattutto: D-galattosio, Dmannosio, L-fucosio, N-acetil-D-glucosammina, N-acetil-Dgalattosammina, acido sialico (un
amminozucchero a 9 atomi di C).
Gruppi sanguigni
La classificazione più semplice (e più vecchia) è il sistema AB0, che prevede 4 gruppi: A, B,
AB, 0. E' legata ai determinanti antigenici presenti sugli eritrociti (globuli rossi).
- Gli individui del gruppo A possono accettare siero del gruppo A o del gruppo 0
- Gli individui del gruppo B possono accettare siero del gruppo B o del gruppo 0
- Gli individui del gruppo AB possono accettare siero di tutti i tipi
- Gli individui del gruppo 0 possono accettare solo siero del gruppo 0
8
Quindi:
- Se si inietta siero di tipo B ad un individuo del gruppo A o viceversa, il sistema immunitario
riconosce come estranei i globuli rossi e li fa agglutinare.
- Lo stesso accade se si inietta sangue di tipo A, B o AB ad un individuo del gruppo 0.
- Invece il siero di tipo 0 è accettato da tutti perché non contiene monosaccaridi estranei
(donatori universali).
9
- D'altronde gli individui del gruppo AB non riconoscono come estraneo nessun
oligosaccaride (accettori universali).
(Agglutinazione: fenomeno per cui gli anticorpi specifici presenti nel sangue (agglutinine)
possono provocare l'agglomeramento di cellule isolate (batteri, globuli rossi ecc.). Il fenomeno
per solito si presenta in caso di trasfusione ad un paziente di sangue di un donatore
incompatibile (è la reazione che ha permesso nel lontano 1900 al medico americano
Landsteiner di scoprire l'esistenza dei quattro gruppi sanguigni fondamentali A, B, AB e 0); i
globuli rossi del donatore si aggregano con gli anticorpi del paziente, formando dei grumi che
possono ostruire i vasi sanguigni).
10
11
12
13
14