Caso clinico Titolo articolo anche lungo
[ come
s i fa
]
Osteomielite acuta in età pediatrica
L’
osteomielite è un’infezione batterica
dell’osso e/o del midollo generalmente localizzata a livello della metafisi. Il quadro clinico si
caratterizza per la presenza di almeno un dato tra febbre
(T> 37,5°C), leucocitosi (GB> 13000/ml), aumento della
VES (>20mm/h) ed emocoltura positiva, associata ad una
o più delle seguenti: presenza di segni locali di flogosi,
positività della scintigrafia ossea con 99mTc, alterazioni
indicative di osteomielite alla RX, TC o RMN1. Le osteomieliti possono essere distinte in acute, subacute o
croniche. La forma acuta, più frequente in età pediatrica,
è caratterizzata dall’insorgenza acuta di febbre e dolore
osseo che, in caso di coinvolgimento degli arti inferiori o
superiori, può determinare zoppia e/o non uso dell’arto.
L’incidenza di OA nei bambini dei Paesi sviluppati si
aggira intorno a 1:5000 casi/anno, con una frequenza doppia nei maschi rispetto alle femmiAnna Fedi
ne (M:F=2:1); questo si può in parte
Sandra Trapani
attribuire alla maggior incidenza di
Donatella Lasagni
Tommaso Bondi
traumi nel sesso maschile. In generaMassimo Resti
le le osteomieliti sono più frequenti
Dipartimento
di Pediatria – Università
nei bambini più piccoli, in rapido
di Firenze e Azienda
accrescimento osseo, con picco di
Ospedaliero-Universitaria
incidenza intorno a 3 anni. Circa la
Meyer, Firenze
AreaPediatrica | Vol. 16 | n. 1 | gennaio–marzo 2015
Definizione ed epidemiologia
37
La prognosi dell’OA è oggi molto buona: mortalità inferiore all’1% nei Paesi sviluppati
e complicanze piuttosto rare, pur con il rischio di disabilità a lungo termine.
Come si fa Osteomielite acuta in età pediatrica
Tabella 1. Microrganismi isolati da pazienti con osteomielite
e loro associazione clinica
Associazione clinica più frequente
Microrganismo
Microrganismo più frequente in Staphylococcus aureus (meticillino –
ogni tipo di osteomielite
sensibile o resistente)
Infezione associata alla presenza Stafilococchi coagulasi-negativi o
di corpi estranei
Propionibacterium spp.
Forme associate a infezioni
nosocomiali
Enterobacteriaceae, Pseudomonas
aeruginosa, Candida spp.
Associazione con morsi/punture/ Streptococchi e/o batteri anaerobi
ferite, piede diabetico o ulcere
da decubito
Drepanocitosi
Salmonella spp., S. aureus, o
Streptococcus pneumoniae
Infezione da HIV
Bartonella henselae o Bartonella
quintana
Morsi umani o animale
Pasteurella multocida o Eikenella
corrodens
Pazienti immunocompromessi
Aspergillus spp., Candida albicans, o
Mycobacteria spp.
Popolazioni ad elevata
prevalenza di tubercolosi
Mycobacterium tuberculosis
Popolazioni in cui alcuni
patogeni sono endemici
Brucella spp., Coxiella burnetii,
funghi che si trovano in specifiche
aree geografiche (coccidiodomicosi,
blastomicosi, istoplasmosi)
Modificata da Lew DP, Waldvogel FA. Osteomyelitis. Lancet 2004;364:369-379
Tabella 2. Meccanismi patogenetici dell’osteomielite acuta
in età pediatrica
Via ematogena
focolai infettivi distanti (cute, vie respiratorie
e urinarie, etc.), colonizzazione cateteri
intravascolari
Contaminazione diretta
o per continuità
traumi di entità più o meno rilevante e
microtraumi ripetuti, lesioni causate da ferite
profonde e penetranti, punture e morsi di
animali, procedure terapeutiche (es:
vaccinazioni), diagnostiche (es: prelievi di
routine) o chirurgiche e manovre invasive in
generale
AreaPediatrica | Vol. 16 | n. 1 | gennaio–marzo 2015
38
Contaminazione indiretta processo infettivo dei tessuti molli circostanti
o per contiguità
(cellulite, sinusite, mastoidite, etc.)
metà dei casi si verifica al di sotto dei 5 anni e, di queste, il
25% in bambini al di sotto di un anno2,3. L’osteomielite del
bambino più piccolo, spesso acuta, per cause anatomiche e
di vascolarizzazione dell’epifisi può complicarsi con artrite
settica, infezioni dei tessuti molli e pseudoparalisi delle
estremità coinvolte. Inoltre nei neonati e nei lattanti l’OA
può più spesso essere multifocale4.
Eziopatogenesi
A
tutte le età, l’agente eziologico più frequente è Staphylococcus aureus seguito da Streptococco
β emolitico di gruppo A (SβEGA) e Haemophilus influenzae tipo b (Hib), che riveste un ruolo maggiore nei Paesi
economicamente meno sviluppati, dove il vaccino non è
disponibile. La percentuale di emocolture e colture ossee
positive varia dal 20% al 90% e S. aureus è generalmente
responsabile di oltre l’80–90% di questi casi. L’epidemiologia dell’OA si è recentemente modificata, per l’aumentata
incidenza di forme causate da S.aureus meticillino-resistente
acquisito in comunità (CA-MRSA), che si caratterizzano
per interessamento osseo multifocale, decorso più aggressivo
e maggior frequenza di complicanze3. CA-MRSA causa
circa il 10% delle osteomieliti nella maggior parte dei Paesi,
ma sta assumendo crescente importanza negli USA, dove è
responsabile di circa il 40-50% dei casi di OA . Altri agenti
eziologici sono: Streptococcus pneumoniae (soprattutto sotto
i 2 anni di età), Pseudomonas aeruginosa (bambini immunocompromessi o forme di OA del piede, da ferite penetranti),
enterobatteri Gram-negativi, streptococchi di gruppo B e
più raramente Kingella kingae, Bartonella henselae e Brucella
melitensis nelle forme a localizzazione vertebrale, Salmonella
spp (pazienti con drepanocitosi), Candida spp e Aspergillus spp (bambini immunocompromessi e neonati), Yersinia
enterocolitica nei talassemici e Mycobacterium tubercolosis,
raro nei Paesi economicamente più sviluppati, ma ancora
frequente in quelli meno sviluppati, soprattutto dopo la
rapida diffusione dell’infezione da HIV. M. tuberculosis ha
un elevato tropismo per la colonna vertebrale (nel 50% dei
casi si localizza in tale sede) e per la sinovia, ma interessa anche segmenti ossei al di fuori delle scheletro assiale2.
Un’eziologia polimicrobica è più comune nei bambini con
OA da traumi o da infezioni dei tessuti molli contigui (Tabella 1). La patogenesi dell’OA è ampiamente conosciuta; la
diffusione dell’infezione all’osso avviene attraverso tre vie:
ematogena, più frequente nel neonato e nel bambino con normale assetto immunitario;
continuità o contaminazione diretta, più comune
nei bambini più grandi e negli adulti;
·
·
L’OA è una patologia in aumento negli ultimi anni, specie in età
pediatrica. Talora diagnosticata con ritardo, dovrebbe considerarsi
una “urgenza clinica”, dal momento che un suo tempestivo
riconoscimento e un’adeguata terapia antibiotica ne determinano
la guarigione, evitando cronicizzazione e complicanze.
Come si fa Osteomielite acuta in età pediatrica
Localizzazione e sintomatologia
L
e più frequenti localizzazioni sono femore e
tibia (⅔ dei casi), seguiti dagli arti superiori (20%)
che, insieme al calcagno costituiscono le seconde sedi per
frequenza; cranio, bacino e rachide costituiscono il restante
10%. L’osteomielite pelvica non è molto comune e si riscontra in circa il 2–11% dei casi e in bambini più grandi
(> 7 anni). La localizzazione è in genere unica, ma sono
possibili focolai multipli in caso di grave processo setticemico. La sede è in genere la metafisi. Nei bambini con
anemia falciforme, sono invece tipicamente interessate le
diafisi delle ossa lunghe, probabilmente come conseguenza
di precedenti infarti ossei associati a impilamento dei globuli rossi e vasocclusione. Può concomitare artrite dell’articolazione adiacente che può essere sterile (se la metafisi
ossea, sede primaria di infezione, è extra-articolare come
in caso di OA di tibia e femore) oppure settica (in caso
di metafisi intra-articolare, come accade se è interessata
l’anca). La OA si presenta con insorgenza acuta di dolore
osseo molto vivo alla digitopressione, zoppia e/o non uso
dell’arto interessato, calore e rossore sovrastante se il pus
ha perforato il periostio, febbre di tipo settico; non sempre
però quest’ultima è presente fin dall’inizio con tali caratteristiche. Il dolore spontaneo o evocato è presente dal 65%
al 100% dei casi. La limitazione funzionale si verifica nel
50% circa dei bambini, mentre la pseudoparalisi in percentuale variabile dal 52% all’84%. I segni locali di flogosi
possono o meno essere presenti all’esordio: la tumefazione
è riferita dal 54% al 79% dei casi; il calore e l’iperemia nel
Diagnosi
L
a diagnosi di osteomielite, principalmente
clinica, si pone in presenza di due dei seguenti aspetti: segni clinici (febbre, dolorabilità localizzata, eritema,
edema); aspirazione di materiale purulento dall’osso; emocoltura o coltura ossea positiva; evidenza di osteomielite a RX, scintigrafia o RMN. L’emocoltura dovrebbe
essere sempre richiesta in caso di dolore osseo e febbre;
se positiva permette di individuare l’agente eziologico
responsabile e confermare la diagnosi. L’esame colturale
su aspirato o biopsia ossea consente una diagnosi definitiva in caso di OA ematogena. Nei casi in cui entrambe
queste metodiche forniscono risultato negativo, un esame istologico su biopsia ossea può rilevare le alterazioni infiammatorie tipiche dell’osteomielite. Si sottolinea
inoltre come le metodiche di biologia molecolare quali
la Polymerase Chain Reaction (PCR), rendano possibile
l’identificazione del genoma batterico su sangue periferico
39
più raramente responsabile dello sviluppo di OA.
In relazione ai tre diversi meccanismi patogenetici,
numerosi sono i possibili fattori di rischio: focolai infettivi
distanti (cute, vie respiratorie e urinarie), traumi più o
meno rilevanti e microtraumi ripetuti (in circa ⅓ dei casi),
ferite profonde e penetranti, punture o morsi di animali,
particolari manipolazioni chirurgiche, procedure terapeutiche (vaccinazioni) e diagnostiche (puntura lombare,
prelievi di routine, puntura dal tallone per esami di screening, etc.), processi infettivi dei tessuti molli circostanti
(cellulite, sinusite, mastoidite, etc). Un rischio maggiore
è associato anche alla concomitanza di patologie quali
diabete mellito, emoglobinopatie come anemia falciforme,
malattie granulomatose croniche e stati di immunodeficienza congenita e acquisita (Tabella 2).
27–68% e nel 16–82% dei casi rispettivamente. Anche per
la febbre, le percentuali variano dal 40% al 93%. Questo
sottolinea come, anche in apiressia, sia possibile il sospetto
diagnostico di OA1‑4. È importante sottolineare, però, che
le manifestazioni cliniche differiscono in base all’età del
paziente e al sito di infezione. L’OA nel neonato si manifesta tipicamente 2–8 settimane dopo la nascita con esordio
subdolo: il neonato può presentarsi apparentemente in
buone condizioni generali senza segni/sintomi sistemici,
con solo tumefazione locale o ridotta mobilità dell’arto interessato (pseudoparalisi); questo è legato principalmente
allo scarso sviluppo del suo sistema immunitario, incapace
di montare un’adeguata risposta immune5. Nel lattante i
sintomi sistemici possono invece prevalere su quelli locali
ed il quadro clinico è più simile alla sepsi.
Le osteomieliti a sede vertebrale e pelvica, benché rare,
pongono particolari difficoltà diagnostiche. L’osteomielite
vertebrale, più frequente a sede lombosacrale e nei bambini
di oltre 8 anni, può infatti essere inizialmente asintomatica
anche per 3–4 mesi, per poi presentarsi acutamente con la
comparsa di febbre e dolore sordo e costante alla schiena5.
Per le osteomieliti pelviche, invece, la difficoltà risiede nella tardiva diagnosi definitiva. La sintomatologia (febbre,
zoppia e dolore localizzato ad anche, glutei, inguine) suggerisce in prima battuta un’artrite settica dell’anca, molto
più frequente dell’osteomielite pelvica. L’esame obiettivo
rivela insorgenza di dolore associato alla mobilizzazione
dell’anca, ma il range di movimento è conservato.
AreaPediatrica | Vol. 16 | n. 1 | gennaio–marzo 2015
o contaminazione indiretta da un focolaio
· contiguità
infettivo adiacente, che costituisce il meccanismo
Come si fa Osteomielite acuta in età pediatrica
AreaPediatrica | Vol. 16 | n. 1 | gennaio–marzo 2015
40
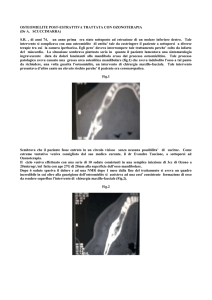
Figura 1a. RX bacino e femore destro in paziente
con quadro di osteomielite acuta da S. aureus a
carico del femore destro e piomiosite dell’arto
inferiore destro.
Figura 1b. RX arto inferiore destro in paziente con
quadro di osteomielite acuta da S. aureus a carico
del femore destro e piomiosite dell’arto inferiore
destro.
Figura 1c. Particolare RX femore distale e ginocchio destro in paziente con quadro di osteomielite acuta da S. aureus a carico del femore destro e
piomiosite dell’arto inferiore destro.
o su materiale infetto, anche in cado
di esame colturale negativo. L’identificazione dell’agente patogeno, con
una qualsiasi delle metodiche sopra
citate, è possibile complessivamente nel 5–60% dei casi.
Gli esami ematochimici, pur aspecifici, sono comunque
molto utili al momento del sospetto clinico e della diagnosi iniziale. La conta dei GB non è un indice molto
sensibile, risultando spesso normale; un loro aumento
non è quindi da considerarsi un indicatore affidabile.
L’emocromo con formula deve comunque sempre essere
eseguito, dato che la leucemia è fra le patologie da porre
in diagnosi differenziale. Nelle diverse casistiche VES e
PCR risultano aumentate in percentuali variabili6,7. La
PCR aumenta nell’arco di 24–48 ore dall’esordio e torna
a valori normali dopo una settimana di adeguata terapia;
la sua rapida cinetica è utile per monitorare la risposta al
trattamento e predire il decorso della malattia con una
sensibilità maggiore rispetto a VES e conta dei GB. La
VES invece aumenta più lentamente e ritorna ai valori
normali in circa 3-4 settimane. Un lavoro di Lorrot sul
ruolo dei marker di flogosi nelle infezioni osteoarticolari,
riporta un aumento della VES e della PCR nell’80% dei
casi o più, rispettivamente6. I risultati di Georgens si discostano poco dai suddetti, mentre quelli di Peltola et al,
mostrano percentuali maggiori: aumento della PCR nel
95% dei casi e della VES nel 94%. Quest’ultimo lavoro
ribadisce il ruolo preponderante della PCR, ma sottolinea
che l’incremento combinato di PCR e VES fornisce una
sensibilità assai elevata (pari al 98%) nella diagnosi di
infezioni osteoarticolari7. Pertanto,
in un quadro di febbre e dolore osseo, l’aumento di uno o di entrambi
questi parametri rappresenta un forte
elemento di sospetto. Di recente anche la procalcitonina
(PCT) è stata proposta come marker utile nel predire
severe infezioni, ma la sua sensibilità in caso di infezioni
osteoarticolari sembra essere bassa6. La diagnosi definitiva di OA si ottiene con gli esami strumentali, utili per
definire sede ed estensione di malattia e rilevare l’eventuale presenza di raccolte purulente o il coinvolgimento
di strutture adiacenti come spazio epidurale, fisi ed epifisi
o articolazioni. In tutti i pazienti con sintomi localizzati
per sospetta OA è raccomandata l’esecuzione di una RX
standard all’esordio, con cui è possibile escludere la presenza di fratture o malignità, condizioni che ne mimano
la sintomatologia3,8. Essa, nella maggior parte dei casi, è
normale e può restare tale per i primi 10–20 giorni. Sono
infatti necessari almeno 3 giorni dopo la colonizzazione
batterica dell’osso per osservare le prime alterazioni a carico dei tessuti molli, almeno una settimana per visualizzare
la tumefazione dei muscoli e dei tessuti sottocutanei e l’obliterazione dei piani fasciali e fino a due settimane perché
si apprezzino scollamento periostale, neoformazione ossea
e lesioni litiche (anomalie specifiche dell’OA): prima che
queste ultime si rendano visibili oltre il 50% della matrice ossea deve essere erosa (Fig. 1a, b, c). La percentuale
di RX patologiche all’esordio riportata in letteratura è
molto variabile e, solo in alcuni lavori, sovrapponibile.
La presenza di risultati così contrastanti può essere at-
Come si fa Osteomielite acuta in età pediatrica
microcircolazione ossea da parte del pus in presenza di
un ascesso. Un quadro scintigrafico “freddo”, da valutare
con attenzione, solitamente è indicativo di malattia più
avanzata o aggressiva, che richiede trattamento più intensivo. La specificità della scintigrafia oscilla fra il 70% e
il 85%1–3 e la quota relativamente elevata di falsi positivi è
legata alla difficoltà nel differenziare l’OA da una flogosi
dei tessuti molli o delle articolazioni adiacenti; la specificità è inoltre ridotta in presenza di recenti traumi, recenti
interventi chirurgici, diabete, protesi. L’introduzione di
metodiche multifase (bifasica o trifasica) ne ha migliorato
la specificità. La scintigrafia trifasica con 99mTc nella OA
mostra un aumento di uptake nelle prime due fasi (fase
angiografica e del blood pool), seguito da un ulteriore
incremento focale di uptake a livello del segmento osseo
interessato (fase osteotropa). Una scintigrafia positiva
nelle tre fasi indica la presenza di osteomielite con una
sensibilità elevata, che oscilla dal 73% al 100%8.
La scintigrafia risulta una tecnica vantaggiosa:
si positivizza precocemente (di solito nelle prime
48 ore dall’esordio);
i risultati sono disponibili rapidamente;
ha un’elevata sensibilità;
è relativamente poco costosa;
di rado richiede la sedazione del piccolo paziente;
consente di visualizzare l’intero scheletro.
Quest’ultimo aspetto è molto utile nei bambini più
grandi in cui si sospetti un’osteomielite cronica multifocale e nei neonati, che spesso hanno localizzazioni multiple
di malattia. Gli svantaggi sono, invece, la bassa sensibilità
nelle forme neonatali (<30%), la bassa sensibilità e specificità nelle forme pelviche e vertebrali e la necessità di
dosi di radiazioni relativamente elevate9.
La RMN è attualmente la migliore indagine strumentale, in termini di sensibilità e specificità, nei pazienti in
cui segni e sintomi siano ben localizzati; se, al contrario,
le manifestazioni cliniche non consentono una precisa
localizzazione, è preferibile in prima istanza l’esecuzione
della scintigrafia ossea total-body. La RM ha il vantaggio
di avere sia elevata sensibilità (82–100%) che specificità
(75–96%). Unici svantaggi sono i costi elevati e i lunghi
tempi di esecuzione che possono richiedere la sedazione.
La diagnosi si pone in presenza di due dei seguenti aspetti:
segni clinici (febbre, dolorabilità localizzata, eritema, edema);
emocoltura o coltura ossea positiva; aspirazione di materiale
purulento dall’osso; evidenza di osteomielite all’imaging diagnostico.
41
·
·
·
·
·
·
AreaPediatrica | Vol. 16 | n. 1 | gennaio–marzo 2015
tribuita alla sua scarsa sensibilità, rispetto alle altre tecniche diagnostiche. L’ecografia, per quanto non invasiva,
è una tecnica operatore-dipendente; in mani esperte le
modificazioni in corso di OA si rendono evidenti non
prima di 48 ore dall’inizio dell’infezione, tempo comunque inferiore a quello della RX. È particolarmente utile
nel mostrare il grado di interessamento di tessuti molli
e muscolari, la presenza di raccolte fluide sottoperiostali
e l’eventuale concomitanza di artrite settica. Nei bambini con drepanocitosi l’ecografia, in grado di distinguere
la flogosi da un infarto osseo, dovrebbe essere eseguita
come primo esame strumentale. Alterazioni ecografiche
precoci e indicative di OA comprendono la tumefazione
dei tessuti molli juxtacorticali associata a sollevamento o
ispessimento del periostio; un’aumentata reazione periostale con successiva formazione di raccolte sottoperiostali
(nei ⅔ dei casi) e, più raramente, di un ascesso periostale;
infine si rendono evidenti brecce ed erosioni corticali9.
Non esiste opinione concorde sulla reale utilità di questa
metodica nell’iter diagnostico dell’OA; numerosi lavori
mostrano la sua scarsa utilità in questo campo, accanto
ad altri che ne documentano una sensibilità e specificità
elevate. Scintigrafia e RMN risultano essere le metodiche
più accurate all’esordio di malattia. Per la scintigrafia,
la maggior parte dei Centri utilizza fosfati o fosfonati,
come il metilene difosfonato, marcati con tecnezio 99-m
(99mTc-MDP); questi composti formano legami covalenti
con i cristalli di idrossiapatite, mentre fluiscono all’interno dell’osso. L’uptake è aumentato in caso di aumentato
flusso sanguigno, infiammazione e attività osteoblastica
alterata. A causa dell’aumentata vascolarizzazione della
regione metafisaria, nei neonati e nei bambini più piccoli, sono necessarie immagini di alta qualità e risoluzione per differenziare l’aumentato uptake fisiologico da
quello patologico. La sensibilità di questa tecnica nella
diagnosi di OA oscilla fra il 60% e il 95%3,8. Oltre il 90%
delle scintigrafie ossee positive mostra immagini “calde”
da incrementato uptake del radiofarmaco causato da un
aumento dell’attività osteblastica e dall’iperemia dell’osso
e dei tessuti molli. Le aree “fredde” (da ridotto uptake),
meno comunemente indicative di OA, sono invece dovute
all’ischemia focale, provocata dalla compressione della
Come si fa Osteomielite acuta in età pediatrica
AreaPediatrica | Vol. 16 | n. 1 | gennaio–marzo 2015
42
A tutte le età, l’agente eziologico più frequente è lo Staphylococcus
aureus. Numerosi altri patogeni devono essere considerati però
qualora dall’anamnesi emergano fattori o patologie predisponenti
allo sviluppo di OA.
La ipointensità del midollo osseo nelle immagini T1pesate (legata a infezione e infiammazione attiva) rappresenta l’alterazione più suggestiva di OAE, con sensibilità
prossima al 100%8. Il reale vantaggio della RMN consiste
nella sua capacità di fornire informazioni anatomiche
molto dettagliate, delineando il coinvolgimento dei tessuti
molli (raccolte fluide, ascessi, tenosinoviti), muscolari e
delle strutture articolari1. È inoltre molto utile in contesti
particolari: nei neonati e nei bambini piccoli permette di
definire con precisione il coinvolgimento cartilagineo (incluse le regioni di accrescimento osseo); nelle osteomieliti
vertebrali e pelviche, individua precocemente la formazione di un eventuale ascesso; nei casi che necessitano di
chirurgia guida gli interventi stessi; permette la diagnosi
nei casi di forte sospetto, con scintigrafia ossea negativa8.
La TC fornisce immagini dell’osso e dei tessuti molli
circostanti ad elevata risoluzione spaziale e di contrasto;
può fornire una dettagliata rappresentazione della zona
corticale e della sua distruzione, della reazione periostale
e delle alterazioni dei tessuti molli. Ha però un ruolo limitato nella diagnosi di OA nel neonato e nel bambino
in generale; è utilizzata primariamente con lo scopo di
delineare con precisione l’estensione del processo flogistico,
soprattutto in zone anatomicamente complesse quali l’articolazione sacro-iliaca e la colonna vertebrale. La sensibilità
e la specificità della TC nella diagnosi di OA non sono note
con precisione, ma risultano certamente inferiori a quelle
della RM. Il suo utilizzo dovrebbe quindi essere limitato a
particolari circostanze e non dovrebbe far parte dell’usuale
iter diagnostico8.
Approccio terapeutico
L
a terapia dell’OA si basa principalmente
sull’utilizzo di antibiotici per via endovenosa, da
somministrare il più precocemente possibile, in quanto
la prognosi dipende essenzialmente dalla rapidità con
cui viene instaurata la terapia. La scelta della terapia
antibatterica è inizialmente empirica, basata sull’età del
paziente e sul più probabile patogeno in causa, tenendo
conto sia del potere battericida del farmaco, sia della sua
capacità di penetrazione nell’osso. Attualmente si ricorre
con sempre maggiore frequenza all’associazione di due
antibiotici ad attività sinergica. L’utilizzo di approcci
terapeutici peculiari e di farmaci antibatterici per coprire
microrganismi Gram-negativi o inusuali dovrebbe essere
riservato a particolari categorie di pazienti come neonati,
immunocompromessi, bambini con drepanocitosi, con
ferite penetranti del piede e fratture scomposte, soggetti
provenienti da zone ad elevata prevalenza di CA-MRSA
o a copertura vaccinale bassa o nulla per Hib. Nel trattamento empirico iniziale, rimanendo lo S. aureus l’agente
eziologico più frequente, si raccomanda l’impiego di una
penicillina anti-stafilococcica semisintetica, penicillinasi-resistente (es: oxacillina). La clindamicina costituisce
un’alternativa per i pazienti allergici alle beta-lattamine;
oltre alla buona attività anti-stafilococcica, la clindamicina ha un’ampia attività anche contro gli anaerobi e può
essere utile in caso di infezioni da ferite penetranti o da
fratture scomposte. L’utilizzo delle cefalosporine di terza
generazione da sole non è considerato sufficiente, data
la loro scarsa copertura per S. aureus, ma trova un’applicazione in associazione alla penicillina. Nelle OA
sostenute da CA-MRSA, la scelta terapeutica iniziale
è controversa e si basa sui pattern locali di suscettibilità;
le opzioni terapeutiche più accreditate sono: teicoplanina, clindamicina come singola terapia; l’aggiunta di
gentamicina a una penicillina β-lattamasi-resistente;
vancomicina (non da tutti raccomandata per il rischio
di emergenza di organismi resistenti); linezolid10.
Condizioni particolari impongono modificazioni all’uso empirico degli antibiotici. Nei pazienti con drepanocitosi, i batteri enterici Gram-negativi (Salmonella) sono
comuni patogeni al pari di S.aureus; le cefalosporine ad
ampio spettro quali il cefotaxime e il ceftriaxone devono
essere aggiunte agli anti-stafilococcici. Per i pazienti immunocompromessi è consigliabile instaurare sempre una
terapia combinata: vancomicina e ceftazidime o piperacillina-clavulanato e un aminoglicoside sono le associazioni
più spesso riportate in letteratura. In seguito all’identificazione dell’agente eziologico, la terapia antibatterica
può essere modificata sulla base dell’antibiogramma. Se il
patogeno non è identificato ma le condizioni del paziente
Come si fa Osteomielite acuta in età pediatrica
la scelta dei pazienti da candidare alla terapia sequenziale
deve essere quindi fatta con attenzione13,14.
Il trattamento chirurgico dell’OA non è ancora stato
oggetto di studi prospettici randomizzati, pertanto non
è attualmente codificato un approccio standardizzato.
Quando si ottiene un aspirato sottoperiostale o metafisario francamente purulento, è generalmente indicata
una procedura di drenaggio chirurgico. Un debridement
chirurgico può essere indicato anche in caso di ferite penetranti, presenza di osso necrotico, o in caso di fallimento
della terapia antibiotica.
Conclusioni
OA risulta essere una patologia di grande
interesse e in aumento negli ultimi anni, specie in
età pediatrica. Tale condizione è talora diagnosticata con
ritardo; è invece da considerarsi una vera e propria “urgenza
clinica”, dal momento che un suo tempestivo riconoscimento e quindi un’adeguata terapia antibiotica ne determinano la guarigione, evitando sia la cronicizzazione che le
complicanze (deformità scheletriche, arresto della crescita e
lesione delle cartilagini articolari). La diagnosi delle patologie muscolo-scheletriche è essenzialmente clinica, basata
su anamnesi e su un’attenta valutazione della sintomatologia generale e dell’obiettività locale. Le manifestazioni
cliniche all’esordio di un quadro di OA, riportate nelle
diverse casistiche in letteratura, sono pressoché sovrapponibili sottolineando come la presenza di dolore, limitazione
funzionale/zoppia e segni locali di flogosi costituiscano un
importante elemento di sospetto. La febbre, pur essendo un importante segno clinico riscontrato in molti casi,
può tuttavia non essere presente. Gli esami di laboratorio
non sono specifici: gli indici di flogosi hanno una buona
sensibilità, ma una bassa specificità e possono, in alcuni
casi, risultare normali. Perciò solo la combinazione di segni
clinici (febbre, dolore, limitazione funzionale) e di VES e
PCR aumentate rendono fortemente sospetta una forma
settica. Dalla nostra analisi della letteratura emerge che,
pur rimanendo la RX standard, l’esame di prima istanza
con cui escludere rapidamente altre condizioni cliniche che
possono mimare la sintomatologia della OA è la RM, in
grado di fornire nella quasi totalità dei pazienti la conferma
precoce del sospetto diagnostico. Anche la scintigrafia si è
rivelata un’indagine sensibile che fornisce indicazioni utili,
specie in situazioni particolari. In conclusione, pur essendo
gli esami di laboratorio e strumentali un utile supporto per
la diagnosi e il monitoraggio del processo infettivo, il gold
43
L’
AreaPediatrica | Vol. 16 | n. 1 | gennaio–marzo 2015
migliorano, si prosegue la terapia antibiotica intrapresa; al
contrario, in assenza di riduzione della PCR o di miglioramento clinico entro 48–72 ore si impone una revisione
della scelta terapeutica e deve essere valutata la possibilità di una aspirazione, biopsia o intervento chirurgico,
così come di una patologia non infettiva. Pertanto, nei
primi giorni di terapia parenterale, la valutazione delle
condizioni cliniche resta lo strumento più importante per
stimare la risposta alla terapia, associata alla valutazione
dei parametri di laboratorio – conta dei globuli bianchi,
VES, PCR6,7. Tradizionalmente, la terapia parenterale viene
eseguita per un periodo di 4–6 settimane. Attualmente
in letteratura non c’è unanime consenso a proposito della via di somministrazione e della durata adeguata della
terapia antibiotica per l’OA nei bambini, passando dai 3
giorni di Cole11 ai 21–50 di Dich e Nelson12. Nei bambini
sono stati da tempo suggeriti trattamenti più brevi e con
una terapia sequenziale parenterale-orale. Alcuni studi
osservazionali datati mostrano un’associazione fra breve
durata della terapia antibiotica (inferiore a tre settimane)
e peggiore outcome o ricadute più frequenti12. Al contrario, altri studi dimostrano come si ottenga una completa
guarigione con assenza di fallimenti terapeutici, dopo una
terapia endovenosa di breve durata seguita da un ciclo di
terapia antibiotica orale per 3–4 settimane13 e come non si
riscontrino differenze nel tasso complessivo di guarigioni
dopo 6 mesi di follow-up fra gruppi di pazienti trattati
con terapia antibiotica parenterale di breve e lunga durata
prima della transizione alla terapia orale. Sebbene si sia
cercato di dimostrare, con risultati incoraggianti, l’efficacia e
la sicurezza di una terapia endovenosa di breve durata (3–7
giorni), è importante sottolineare che non sono stati mai
condotti trial randomizzati controllati né studi comparativi
e che i dati a nostra disposizione derivano solo da studi
osservazionali o retrospettivi. Pertanto un trattamento della
durata di 4–6 settimane è considerato ancora lo standard
terapeutico14. La maggior parte degli autori concorda nel
sostenere che la durata del trattamento deve essere individualizzata e che la decisione di iniziare la terapia orale
dovrebbe essere presa sulla base delle condizioni del singolo
paziente, dopo attenta valutazione del miglioramento di
segni clinici e di laboratorio. I pazienti con presentazione
atipica di malattia, immunocompromessi o con patologie sottostanti, con infezioni fungine o micobatteriche,
con indizi di cronicità, complicanze o risposta ritardata
alla terapia, sono sottoposti a un trattamento parenterale
e orale di maggiore durata e ad uno stretto follow-up, per
evitare l’insorgere di complicanze. Viste le conseguenze che
possono derivare da un eventuale fallimento terapeutico,
Come si fa Osteomielite acuta in età pediatrica
standard per la diagnosi di forme settiche osteo-articolari
si fonda sul sospetto clinico del pediatra di fronte ad un
bambino con dolore osseo.
Caso Clinico
F.
6 anni, si reca dal curante per febbre e dolore
alla gamba sinistra da 3 giorni. Negati traumi; non
segni locali di flogosi. Viene prescritta terapia antibiotica,
antiinfiammatoria e steroidea.
Successivamente scompare la febbre ma aumenta il
dolore, anche notturno e compaiono iperemia cutanea
e tumefazione sotto il ginocchio sinistro per cui viene
condotta al PS dove esegue:
esami ematici: VES 75 mm/h; PCR 4,48 mg/dl;
RX gamba: rarefazione alla metafisi prossimale
della tibia sinistra;
ecografia ginocchio: falda fluida e imbibizione dei
tessuti molli.
La paziente viene ricoverata. All’ingresso è febbrile; l’esame articolare mostra area calda, arrossata, tumefatta, dolente alla palpazione a livello del 3° prossimale tibia sinistra.
Nel sospetto di osteomielite si inizia terapia con ceftriaxone
e oxacillina. L’emocoltura è positiva per Staphylococcus aureus. Nei primi giorni l’area di flogosi si estende, la febbre
persiste e la PCR incrementa (11 mg/dL). Per tale motivo si sostituisce oxacillina con vancocina. La RM della
gamba mostra estesa disomogenea alterazione di segnale
al terzo prossimale tibia sinistra con aree più ipointense
nelle immagini T1-pesate con più sfumata iperintensità
estesa alla fisi; reazione periostale con interposizione di
materiale purulento che si estende anteriormente ai tessuti
AreaPediatrica | Vol. 16 | n. 1 | gennaio–marzo 2015
44
·
·
·
Bibliografia
1. Goergens ED, McEvoy A, Watson M et
al. Acute osteomyelitis and septic arthritis in
children. J Paediatr Child Health 2005;41:59-62.
2. Steer AC, Carapetis JR. Acute
hematogenous osteomyelitis in children.
Recognition and Management. Pediatr Drugs
2004;6(6):333-346.
3. Karmazyn B. Imaging approach
to acute hematogenous osteomyelitis in
children: an update. Semin Ultrasound CT MRI
2010;31:100-106.
4. Kaplan SL. Osteomyelitis in Children.
Infect Dis Clin N Am 2005;19:787-797.
5. Offiah AC. Acute osteomyelitis, septic
arthrits and discitis: differences between
neonates and older children. Eur J Radiol
2006;60(2):221-32.
molli con distruzione della corticale; alterazione di segnale
delle strutture muscolari e cutaneo-sottocutaneo adiacenti
(reperti compatibili con osteomielite acuta con reazione periostale e raccolta ascessualizzata anteriormente in sede extraossea). Viene effettuato intervento di toilette chirurgica.
La ricerca di genoma batterico (mediante PCR) e l’esame
colturale su materiale prelevato sono positivi per S. aureus.
Data la positività della ricerca di tossina Leucocidina Panton Valentine viene aggiunta clindamicina, con successivo
sfebbramento, progressivo miglioramento dei segni locali di
flogosi, riduzione del dolore e ripresa dei movimenti della
gamba. Per comparsa di rash durante infusione di vancocina, l’allergologo consiglia infusione lenta del farmaco e
somministrazione di antistaminico. Dopo una settimana,
per la ricomparsa di rash pruriginoso, si reintroduce oxacillina in associazione a rifampicina, in accordo con l’allergologo. Viene inoltre intrapreso programma fisioterapico
riabilitativo con ripresa della deambulazione con canadesi
con sfioro a terra. Dopo 3 settimane F. sta bene: non dolore
né segni di flogosi a livello della gamba, indici di flogosi
negativi; la RX mostra ancora disomogenea composizione
ossea metadiafisaria prossimale della tibia e apposizione
periostea. La bambina viene dimessa con rifampicina per
15 giorni, deambulazione con canadesi e programma di
follow-up pediatrico, ortopedico e fisioterapico per 6 mesi.
Al controllo dopo 3 mesi F. non ha più presentato dolore,
ha ripreso a deambulare autonomamente, gli esami ematici
sono negativi e la RM evidenzia significativa evoluzione
riparativa del focolaio osteomielitico; a 6 mesi la RX è
pressoché normalizzata
6. Lorrot M, Fitoussi F, Faye A et al.
Marqueurs de l’inflammation et infection
ostéoarticulaire [Laboratory studies in pediatric
bone and joint infections]. Arch Pediatr
2007;14:S86-90.
7. Azam Q, Ahmad I, Abbas M et al.
Ultrasound and colour Doppler sonography in
acute osteomyelitis in children. Acta Orthop
Belg 2005;71:590-596.
8. Blickman JG, van Die CE, de Rooy
JW. Current imaging concepts in pediatric
osteomyelitis. Eur Radiol 2004;14:55-64.
9. Jaramillo D, Treves ST, Kasser JR et al.
Osteomyelitis and septic arthritis in children:
appropriate use of imaging to guide treatment.
AJR Am J Roentgenol 1995;165:399-403.
10. Saphyakhajon P, Joshi AY, Huskins
WC et al. Empiric antibiotic therapy for
acute osteoarticular infections with suspected
.
Gli autori dichiarano di non avere
nessun conflitto di interesse.
methicillin-resistant Staphylococcus aureus or
Kingella. Pediatr Infect Dis J 2008;27(8):765-7.
11. Cole WG, Dalziel RE, Leitl S. Treatment
of acute osteomyelitis in childhood. J Bone
Joint Surg Br 1982;64-B:218-23.
12. Dich VQ, Nelson JD, Haltalin KC.
Osteomyelitis in infants and children. Am J Dis
Child 1975;129:1273-8.
13. Peltola H, Pääkkönen M, Kallio P
et al. Short- versus long-term antimicrobial
treatment for acute hematogenous
osteomyelitis of childhood: prospective,
randomized trial on 131 culture-positive cases.
Pediatr Infect Dis J 2010;29(12):1123-8.
14. Weichert S, Shalarand M, Clarke NMP
et al. Acute haematogenous osteomyelitis
in children: is there any evidence for how
long we should treat? Curr Opin Infect Dis
2008;21(3):258-62.