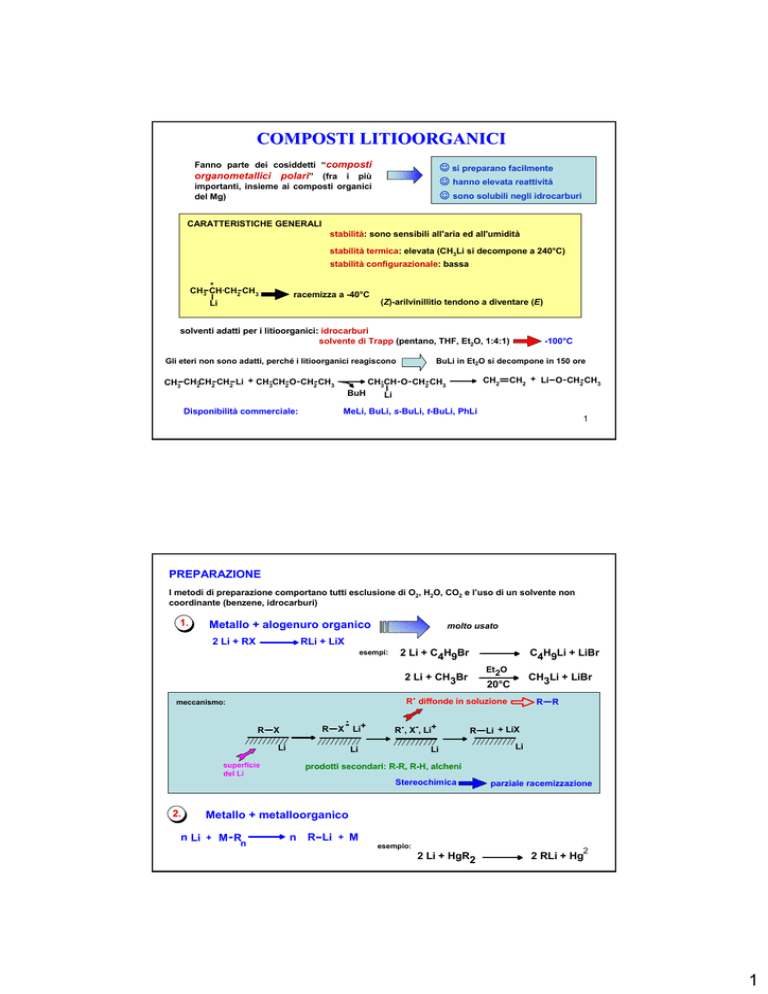
COMPOSTI LITIOORGANICI
Fanno parte dei cosiddetti “composti
organometallici polari” (fra i più
☺ si preparano facilmente
☺ hanno elevata reattività
☺ sono solubili negli idrocarburi
importanti, insieme ai composti organici
del Mg)
CARATTERISTICHE GENERALI
stabilità: sono sensibili all'aria ed all'umidità
stabilità termica: elevata (CH3Li si decompone a 240°C)
stabilità configurazionale: bassa
*
CH3 CH CH2 CH3
racemizza a -40°C
Li
(Z)-arilvinillitio tendono a diventare (E)
solventi adatti per i litioorganici: idrocarburi
solvente di Trapp (pentano, THF, Et2O, 1:4:1)
Gli eteri non sono adatti, perché i litioorganici reagiscono
CH3 CH2CH2 CH2 Li + CH3CH2 O CH2 CH3
Disponibilità commerciale:
BuH
-100°C
BuLi in Et2O si decompone in 150 ore
CH2
CH3CH O CH2 CH3
CH2 + Li O CH2 CH3
Li
MeLi, BuLi, s-BuLi, t-BuLi, PhLi
1
PREPARAZIONE
I metodi di preparazione comportano tutti esclusione di O2, H2O, CO2 e l’uso di un solvente non
coordinante (benzene, idrocarburi)
1.
Metallo + alogenuro organico
2 Li + RX
molto usato
RLi + LiX
esempi:
2 Li + C4H9Br
C4H9Li + LiBr
Et2O
2 Li + CH3Br
.
R diffonde in soluzione
meccanismo:
R
R
X
.
X - Li+
Li
.
R , X-, Li+
Li
superficie
del Li
2.
CH3Li + LiBr
20°C
R
Li
R
R
Li + LiX
Li
prodotti secondari: R-R, R-H, alcheni
Stereochimica
parziale racemizzazione
Metallo + metalloorganico
n Li + M R
n
n
R Li + M
esempio:
2 Li + HgR2
2
2 RLi + Hg
1
3.
Metalloorganico + metalloorganico (scambio di metallo)
n R' Li + M Rn
n R Li + M R'n
E’ sinteticamente utile solo se si riesce a spostare l’equilibrio
esempi:
4 PhLi + (CH2=CH)4Sn
HC C CH2 O
O
Bu3SnH
SnBu3
-78°C
R CH OR' + BuLi
4 CH2=CH-Li + Ph4Sn
N CH2 SnBu3 + BuLi
H
BuLi
Li
Li
R CH OR'
R
R
O
CH2 O
H
C C
Bu3Sn H
O
CH2 O
C C
H
(1975)
(1978)
R
0°C
R
(1971)
N CH2 Li
la reazione di scambio di α-alcossistannani avviene con ritenzione di configurazione
R CH2 H
C OCH2OR'
R CH2 H
C OCH2OR'
RLi
SnBu3
4.
3
Li
Metalloorganico + alogenuro arilico (scambio metallo-alogeno)
particolarmente utile per convertire alogenuri alchenilici ed arilici nei
corrispondenti composti con litio.
RLi + R'X
RX + R'Li
Come alogenuro: X = I, Br, raramente Cl, mai F
la reazione procede nella direzione che forma il litioorganico più stabile, cioè quello che deriva dalla
struttura organica più acida
esempi:
BuLi + PhX
la reazione è un equilibrio spostato verso destra
perché Ph ospita la carica negativa meglio di Bu
BuX + PhLi
Cl
Cl
Cl
Cl
+ BuLi
Cl
H
H
C C
Br
t-BuLi, -120°C
pentano-THF-Et2O
H 3C
H
Cl
Cl
Li
(1976)
H
C C
Cl
+ BuCl
T <-35°C
Cl
Cl
H
H
C C
Li
THF
Cl
+ t-BuLi
Br
-120°C
H3C
H
H
C C
Li
(1976)
4
2
-70°C
Br
Li
+ BuLi
H3C
C C
H
Si(CH3)3
(1975)
Br
O
H 3C
+ t-BuLi
C C
Br
(1975)
(1979)
Li
H
Li
Si(CH3)3
-70°C
+ s-BuLi
O
lo scambio metallo-alogeno è una reazione veloce, di solito eseguita a bassa temperatura (da -60°C a
-120°C). Questo rende possibile preparare arillitio con gruppi funzionali (CN, NO2),che reagirebbero
nelle condizioni nelle condizioni di sintesi da Li metallico
N
C
Br + BuLi
N
-100°C
C
Li
(1976)
NO2
Br + BuLi
Br
Reattività di RX
NO2
-100°C
Br
Li
Br
I > Br > Cl > F
(1977)
Li
F BuLi, -80°C
F
Et2O-esano
Cl
Cl
5
ArCH2Br > ArBr > Ar(CH2)nBr [n>2]
nella reazione con BuLi in THF a -100°C
Si osserva ritenzione di configurazione, bassa con gli alogenuri alchilici, ma elevata con
gli alogenuri alchenilici e ciclopropilici
CH3 BuLi
CH3
Br
Li
Il meccanismo non è chiaro. Fra quelli
meccanismi proposti:
con Li° si ha perdita della
stereochimica
Ar--------X
=/
[R--------Br--------Ar] =/
Li--------R
5.
Metalloorganico + acido al C (metallazione)
R Li + R' H
R H + R' Li
l'equilibrio acido-base è tanto più spostato verso destra, quanto più acido è R'H
Però è importante considerare
anche l'acidità cinetica
H
+ BuLi
Li
+ BuH
reazione così lenta,
che in pratica non si6
può misurare
3
aggiungendo TMEDA, la reazione avviene
(BuLi)6
H
N...
+
...Li Bu veloce
N
cicloesano
6 TMEDA
N... +
...Li
N
BuH
-
metodo importante per ottenere gli alchinuri di litio
Li C C R + R' H
HC C R + R' Li
La posizione della litiazione è determinata dalle acidità relative dei legami C-H e dall'effetto orientante dei sostituenti.
sostituenti che possono coordinare il catione litio (alcossi, ammido, solfonil) influiscono
notevolmente sulla posizione e sulla velocità della litiazione di composti aromatici.
OCH3
esempi:
+ BuLi
O
O
THF, -78°C
+ BuLi
(1966)
CH2 CH3
N
C
CH2 CH3
Li
(1979)
H3C
N
N
CH3
+ BuLi
+
secondario
TMEDA, 25°C, 1h
H3C
OCH3
Li
principale
CH2 CH3
N
C
CH2 CH3
S
OCH3
Li
etere, 35°C
+ BuLi
etere, TMEDA
25°C, 7h
N
Li
N
CH3
(1979)
7
THF, 30°C
Li
S
1h
(1970)
H2C CH O CH3 + t-BuLi
O CH3
THF, 0°C
H2 C C
(1974)
Li
H
H2C CH CH2 O Si(CH3)3 + s-BuLi
THF, HMPA
-78°C, 5min
O
+ BuLi
Si
C
H2C
Li
C
H
(1976)
O Si(CH3)3
THF, -78°C
Si O
4h
(1976)
Li
idrocarburi senza sostituenti coordinanti non sono molto reattivi nella metallazione.
BuLi + (CH3)3COK
H2C
H3C
C C
CH3
CH2
BuLi
dà anioni allilici da alcheni
H2C
(CH3)3COK
H3C
C C
CH2 Li
CH2
H2 C C
CH3
CH3
BuLi
(CH3)3COK
H2 C C
CH3
CH2 Li
8
4
Anche le litio ammidi (compresa la diisopropilammide di
litio, LDA, e 2,2,6,6-tetrametilpiperidide di litio, LTMP,
sono usate per la litiazione mediante deprotonazione,
data la loro basicità. Diventano importanti quando ci
sono problemi di nucleofilicità con i litioorganici.
Li+ - N
H3C
H3C
LTMP
LDA
O
O
N
N
N
CH3
CH3
N
Li+
Sono state preparate litioammidi chirali
per la deprotonazione enantioselettiva
N
(2003)
(2001)
Reattività nella deprotonazione
C C H
C
C
R
O
C
H
H
Facilità di
deprotonazione
C H
R
C
C H
O
S
C
R
H
DG
S
C
R
R Si H
R
C
O
H
H RO P
C
C
RO
O
O
H
H
R P
H
R
C
R N
H
R
C
R
R
O
C
S
C
H
H
H
9
DG = gruppo con eteroatomo
6.
Riduzione di solfuri
per preparare α-litio eteri, α-litio solfuri, α-litiosilani
agente riducente
H3 C
anione radicale del dimetilamminonaftalene
N
H 3C
CH3
CH3
N
.
Li+
Li°
LDMAN
lithium dimethylaminonaphthalene
esempi:
S
LDMAN
O
CH3
LDMAN
S C Si(CH3)3
CH3
Li
O
CH3
Li C Si(CH3)3
CH3
10
5
REAZIONI DEI COMPOSTI LITIOORGANICI
fonte di carbanioni
R-Li
base (per formare ilidi, alcossidi, basi da ammine)
fonte di intermedi reattivi (carbeni, arini)
I composti litioorganici sono usati per formare legami C-H (C-D), C-C, C-O,C-S, C-N, C-M (M=metallo), C-E
(E=elemento)
1. FORMAZIONE DI LEGAMI C-H
R-Li + HA
R-H + LiA
H2O
Qualunque acido più forte di R-H è in grado di protonare RLi
R'OH
R-Li
R'CO2H
HX
La reazione è sinteticamente utile per introdurre D o T
R-H
esempi:
R'NH2
R-L + D2O
R D
R T
R-Li + HOT
Br
CH2 CH2 Br
Oppure per rimuovere
un alogeno arilico in
presenza di un
alogeno alchilico
CH2 CH2 Br
BuLi
THF-esano
-100°C
Br
Li
BuLi
D
D2O
CH2 CH2 Br
H2O
11
(1976)
Li
2. FORMAZIONE DI LEGAMI C-C
a. ADDIZIONE A LEGAMI MULTIPLI C-O
O
O
R-Li + R' C R"
aspetti importanti della reazione:
esempi:
R' C R"
R
R' C R"
R
19%
2. H2O
O
CH3 2. H O
2
H2C CH CH2 Li + CH3 C CH2 CH
CH3
CH3 CH2CH2CH2 Li +
OH
OH
O
O
H2O
☺ maggiore reattività rispetto ai reattivi di Grignard
☺ meno sottoprodotti
☺ utili con chetoni stericamente impediti
Li
1.
Li
HO
OH
CH3
H2C CH CH2 C CH2 CH
70-72%
CH3
CH3
(1973)
CH2 CH2 CH2 CH3
89%
(1973)
12
6
Li
1. CH3 CH O
+
N
H3 C O
H3C O
CH3
CH2 Li
N
H3 C O
O
2. H2O
H3C O
H
C
O
O
t-BuLi
C
N CH2 CH3
H3C O
CH2 CH3
C
N CH2 CH3
Li CH CH
2
3
OH
CH2 CH CH3
44-50%
N
CH2 CH3
CH3
CH3 CH2 N
O
C O
CH3
O
H3C
CH3
O CH3
2. H2O
H3C
63%
O
OH O
(1979)
CH3
Con i composti α,β-insaturi si ha addizione 1,2 (per avere addizione coniugata serve un nucleofilo
meno reattivo
Particolarmente utili sono la reazione con N,N-dimetilformammide (formilazione) e con biossido di
carbonio (carbossilazione) di R
O
R-Li + H C
N CH3
CH3
R-Li + O
O Li
R CH
N CH3
CH3
H3O+
O
R C O-
C O
O
+
R C H + H2N(CH3)2
H3O+
O
R C OH
13
b. ACILAZIONE
Di acidi carbossilici
a chetoni
(CH3)3CCO2H + 2
H3C
CO2Li
esempi:
+ CH3Li
C
O
91%
2. H2O
(1969)
O
Li
(1976)
CO2H
CH3
65%
C C(CH3)3
2. H2O
O
C
1. 2 CH3Li
CH3
CH3
2. H2O
90% (1966)
Di cloruri acilici a chetoni
COCl
H 3C
O
Br
CO2H
2 BuLi
-100°C
H 3C
O
Li
H3C O
CO2Li
H 3C
O
O
C
CO2H
O
78%
CH3
(1981)
14
7
Di anidridi carbossiliche a chetoni
C
N
Br
O
CO2H
1. BuLi. -100°C
O
2.
N
O
71%
C
(1976)
O
c. ADDIZIONE A LEGAMI MULTIPLI C-N (tripli e doppi)
R
R'Li
R C N
R'
C N Li
R'
C N H
H
-
H
N
N
N
-
R
idrolisi
R'
-
Li
+
R
idrolisi
∆
N
H
N
1. CO2
2. H2O
C O
HO
O
C
N
15
d. ADDIZIONE A LEGAMI MULTIPLI C-C
la tendenza dei composti organometallici ad addizionarsi a
legami multipli C-C varia nell'ordine
RMgX < RLi < R3B (R3Al)
La reazione non è utile sinteticamente, a meno che non si vogliano polimeri
C C
R-Li +
C C
BuLi/TMEDA
R C C Li
polimerizzazione
iniziatore per la polimerizzazione di CH2=CH2
Con substrati particolari la reazione diventa utile
C
Br
C
C
Li
C
Li
BuBr
16
8
δ+ C O δ-
e. UMPOLUNG DI
R
C
H
OH
Nu
1. Nu2. H+
R
R
C
C O
C
Y
H
H
R
X
M
X E+ R
Y
C
E
X
R
Y
E
C O
Esempi:
O
CH3 CH2 C
+
H
HS CH2
HCl
CH2
HS CH2 anidro
CH3 CH2
S
BuLi
CH3 CH2 S
H S
Li S
CH3
CH3 CH I
CH3 CH2 S
H2O
CH3 CH S
CH3
H+
O
CH3 CH2 C CH CH3
CH3
O
CH3 CH2 S
Li S
OH O
OH
1.
C
2. H2O
H2O
H+
S
CH S
C
C CH2 CH3
2
CH3
17
f. ALCHILAZIONE (Cross-coupling)
R M + R' X
R R'
La reazione richiede solventi polari (HMPA) e temperatura relativamente elevata
reazione secondaria: scambio metallo-alogeno
Reattività di R'-X:
I > Br >> Cl
con R' = arile, alchenile, alchinile, la reazione è catalizzata da sali di Cu(I)
La facilità di formazione di prodotti di
accoppiamento dipende da R'-X
Fatti sperimentali:
cinetiche del secondo ordine
inversione di configurazione
meccanismo?
CH2 Li
3
+
2
(R)
Li
primario > secondario > terziario
*
+ CH3 CH2 CH2 CHDCl
C(CH3)3
Cl
H 1
2 C(CH
THF
25°C
3
CH2
*
CH3 CH2 CH2 CHD
H
)
3 3
1
(S)
(1982)
(1959)
18
9
2
2
CH2 Li
+
3
H3 C
H
CH2 CH3
C
Br
(R)
1
CH2
CH2 CH3
C
H
1
CH3
3
resa 58%
100% inversione
(S)
però con RM primario e secondario e R'X primario si ha racemizzazione
il prodotto di alchilazione è accompagnato da prodotti di disproporzione e da
prodotti di accoppiamento del solvente, da cui viene strappato un H
CH3
CH
CH3
CH3 CH2 CH2 CH2 Li
+
CH3 CH2 CH2 CH2 Br
CH3 CH2 CH2 CH2 CH2 CH2 CH2 CH3 +
ottano
CH3 CH2 CH CH2
3%
CH3 CH3
43%
+ CH3 CH2 CH2 CH3 +
C
C
18%
CH3 CH3
19%
Meccanismo radicalico
esempi:
O
CH3
OSiR3
O
BuLi
CH3
Br CH2 CH C
CH3
H3 C O
Li
OSiR3
H3C O
CH3
H3C O
H3C C C CH CH CH2
H3C
Li
+
H 3C
CH3
19
H3C C C CH CH CH2 CH2 CH2 CH2 CH2 CH2 CH3
CH3
Li+
H3C O .................
H3C C C CH CH CH2
H3C
CH3
O
CH2OSiR3
CH3
O
CH3
OSiR3
H3C O
CH3 CH2 CH2 CH2 CH2 CH2 Br
H3C CH3
H3C O
H3C
C CH CH2
H3 C
H3 C O
+
CH2OSiR3
O
O
H3 C
CH2
CH2OSiR3
CH2OSiR3
OTHP
CH3
65%
H 3C
CH3
OH
O
+ BuLi/BF3
(3equiv)
97%
20
10
L'alchilazione ad opera di alogenuri allilici (più soddisfacente dal punto di vista sintetico) può
procedere attraverso uno stato di transizione ciclico:
H 2C
CH
*
*
CH2 CH CH
2
CH2
Cl
Li
CH3
H3C
C C
H
Br
CH3
H3C
1. Li
C C
H
CH3 CH2 CH2
2. CH3(CH2)3I
77%
1,3-, 1,4- e 1,5- diiodoalcani con t-BuLi danno chiusura d'anello (invece con 1,6- si ha poca
ciclizzazione).
CH2 I
t-BuLi
97%
CH2 I
CH2 CH2 Br
CH2 CH2 Br
25°C
BuLi
Et2O, -100°C
Br
S
1. BuLi
S
S
2. Br(CH2)nCl
S
(1984)
(CH2) Cl
n
Li
BuLi
S
(CH2)nCl
Li
S
S
(CH2)n
S
21
APPLICAZIONI INDUSTRIALI DEI COMPOSTI LITIOORGANICI
Brevetti riguardanti composti litioorganici:
Produzione commerciale di BuLi
46 brevetti/anno
62 brevetti/anno
89 brevetti/anno
1970-1980
1981-1985
1986-1990
circa 1000 tonnellate annue
Applicazioni principali
industria della gomma
sintesi organica industriale (prodotti farmaceutici ed "agrochimici")
industria della gomma
Li
Li +
C4H9Li +
Li
isoprene
polibutadiene
poliisoprene
90-92% cis
0.1-0.2 mmolI di litioalchile per 100 g di isoprene in pentano o esano
"living polymer“: distribuzione molto stretta dei pesi molecolari (e quindi ottime proprietà
tecnologiche), regolabile variando la concentrazione del catalizzatore BuLi.
22
11
sintesi organica industriale
Vantaggi dell'uso di composti litioorganici nella sintesi industriale di prodotti
farmaceutici, per l'agricoltura o per l'industria dei cosmetici:
☺ condizioni di reazione blande
☺ rese elevate
☺ pochi sottoprodotti
☺ facile separazione dai sali di litio.
☺ Possibilità di riciclare i sali di litio risultanti.
Esempi di sintesi industriali:
BuL
i
S
Cl
O
S
Li
N
OH
S
S
deprotonazione
Ticlopidina
inibitore dell'aggregazione delle piastrine
farmaco anticancro
O
O
Li
Br
BuLi
O
CO2H
O
HO
OH
S
S
BuBr
S
scambio litio-alogeno
Li
BuBr
23
Cetiedile
vasodilatatore
Br BuLi
N
N
S
CH2R
OH
CH2R
O=C(CH2R)2
N
Fungicidi
Inibitori della crescita di
piante acquatiche
N
scambio litio-alogeno
CH-PPh3
CH2-CH2-N(CH3)2
Y Y'
Reazione di Wittig
O
Y Y'
Antistaminici
Antiasmatici
CHCH2CH2N(CH3)2
Y-Y' = -CH2-CH2-; -CH2-O- ; -O-CH2n = 0-7
O
Addizione al
carbonile:
HO
CH3 CH Li
3
CH3
O
H3 C
CH3
CH3
+
H3 C
H 3C
Reazioni di accoppiamento:
(H3C)2SiCl2 + LiC(CH3)3
H 3C
CH3
Cl Si C(CH3)3
CH3
OH
Trova applicazione industriale nella
sintesi di antibiotici:
olio di
Patchouli
O
H
reagente per introdurre
gruppo protettore (OH e NH2)
OH
S
N
Penem
CO2H
O
H R'
N
R
CO2H
Carbapenem
24
12
SINTESI INDUSTRIALE DEI COMPOSTI LITIOORGANICI
RCl + 2 Li
RLi + LiCl
Aspetti importanti per la realizzazione su scala industriale:
La reazione è fortemente esotermica e la temperatura deve essere controllata
accuratamente. La velocità della reazione è determinata dalla velocità dell'aggiunta
dell’alogenuro ed è limitata dalla capacità del refrigerante.
Qualità del litio metallico usato (per l'economia del processo). Una resa
soddisfacente ed una velocità elevata si ottengono se il litio (fine dispersione)
contiene 0.5-2% di Na.
Rimozione dell'eccesso di Li e di LiCl.
La soluzione idrocarburica ottenuta dalla sintesi di BuLi e sec-BuLi si concentra a >90%. Il
concentrato viene conservato e può essere diluito con solventi differenti, a diverse concentrazioni,
su richiesta dei clienti. Le rese di terz-BuLi sono inferiori, perché terz-BuLi reagisce con terz-BuCl,
dando sottoprodotti idrocarburici. MeLi si produce normalmente in dietil etere.
DISPONIBILITA‘ COMMERCIALE
butillitio
sec-butillitio
terz-butillitio
metillitio
fenillitio
acetiluro di litio
15%, 23%, 50% e 90% in esano; 20% in cicloesano; 20% in toluene
10% in isopentano; 12% in cicloesano
15% in pentano; 15% in esano
5% in dietil etere; 6.4% in dietil etere contenente 10% LiBr;
2.6% in isopropilbenzene-THF contenente 0.5% di metilmagnesio
20% in cicloesano- dietil etere
complesso solido con etilendiammina
25
PROPRIETA' DEI COMPOSTI LITIOORGANICI, IMPORTANTI PER L'INDUSTRIA
STABILITA' e SOLVENTI
I composti litioorganici non sono stabili termicamente, decomponendosi ad idruro di litio e 1-butene
(β-eliminazione)
C4H9Li
CH3CH2CH=CH2 + LiH
In un sistema chiuso si formano anche butano e materiale polimerico da butadiene:
CH3 CH2 CH CH2 +
C4H9Li
Li
CH3 CH CH CH2 +
C4H10
Li
CH3 CH CH CH2
CH2 CH CH CH2 +
LiH
stabilità termica nei solventi idrocarburici
La velocità di decomposizione di un composto litioorganico dipende:
dalla concentrazione
dal solvente
dalla temperatura
dal contenuto di alcossido di litio
26
13
Velocità di decomposizione (% di materiale perso al giorno)
Temperatura di
consevazione
(°C)
BuLi 15-20%
in esano
0
5
10
20
35
BuLi 90%
in esano
sec-BuLi 10-12%
in isopentano
0.003
0.006
0.012
0.047
0.32
0.0005
0.0011
0.0025
0.013
0.11
0.00001
0.0002
0.0004
0.0018
0.017
L'aggiunta di solventi donatori, rompendo gli aggregati, aumenta la nucleofilicità, con risultante
rottura del legame O-C:
CH2=CH2 e CH3OLi
con Et2O
con THF
CH2=CH2 e CH2=CHOLi
Decomposizione del butillitio in eteri
Etere
Dietil etere
Diisopropil etere
1,2-dimetossietano
THF
temperatura (°C)
25
35
25
25
0
-30
t1/2
6 giorni
31 ore
18 giorni
10 min
23.5 ore
5 giorni
27
COMPORTAMENTO CON ARIA ED ACQUA
I composti litioorganici reagiscono con l'ossigeno dell'aria, formando alcossidi di litio,
e con l'umidità dell'aria, formando idrossido di litio e l'idrocarburo corrispondente.
Il rischio di auto-ignizione, dovuto alle proprietà piroforiche dei composti litioorganici
dipende da:
natura del composto litioorganico
concentrazione della soluzione
umidità dell'aria
superficie su cui si versa la soluzione
età della soluzione
BuLi 15% in esano: versato in capsula di porcellana reagisce con l'aria, senza
auto-ignizione; carta da filtro immersa nella soluzione ed esposta all'aria si
carbonizza, ma senza prender fuoco.
BuLi 50% in esano: la soluzione non prende fuoco, ma la carta da filtro sì,
immediatamente.
Se la superficie su cui si versa è abbastanza grande, così che l'evaporazione del solvente, è
possibile auto-ignizione: attenzione a non rovesciare litioorganici su materiali con grande
area superficiale specifica (vestiti, lana di vetro o carta da filtro).
Il rischio di auto-ignizione aumenta con l'età della soluzione (accumulo di LiH).
L'aggiunta di acqua dà idrolisi immediata, con incendio, se c'è ossigeno.
vanno conservati in atmosfera inerte
28
14
TOSSICOLOGIA
Le proprietà tossicologiche dei composti litioorganici riguardano i prodotti di idrolisi.
LiOH
irritazione della pelle, delle mucose, degli occhi e dell'apparato respiratorio.
Il litio è più tossico del sodio, ma LiCO3 è usato nella cura di malattie maniaco-depressive.
RICICLAGGIO e SMALTIMENTO DEI RIFIUTI
Alla fine di una reazione con reagenti litioorganici si effettua di solito una lavorazione con acqua
o acido. Il litio va in fase acquosa sotto forma di idrossido di litio o alogenuro di litio; il prodotto
desiderato resta in fase organica.
Che cosa fare del litio in soluzione acquosa?
riciclaggio
Problema: contaminazione organica (solvente, prodotti organici)
Il contenuto di C organico in soluzione di LiCl 30% dalla sintesi di composti
farmaceutici va da 1 000 a 20 000 mg/litro TOC (Total Organic Carbon): con
quantità del genere è impossibile recuperare LiOH o LiCl con la purezza
necessaria per altre operazioni.
29
E’ necessario sviluppare tecniche specifiche per la purificazione di soluzioni molto concentrate di LiCl. Inoltre
ogni reazione organica produce un tipo diverso di impurezze ed il metodo di ricilo va adeguato di conseguenza.
Protocollo generale per il riciclo del Li
Li metallico
R-Li
sintesi
organica
LiCl, LiOH
contaminati
Riciclaggio
del litio
elettrolisi
LiCl, LiOH
purificazione
altre
applicazioni
30
15
Smaltimento dei composti litioorganici inutlizzati o di soluzioni versate
(quantità piccole)
Lenta e controllata addizione all'acqua (o di acqua) con agitazione
vigorosa e raffreddamento in atmosfera inerte. La soluzione
acquosa di LiOH risultante si rimuove dal solvente per separazione
di fase.
Le soluzioni versate dovrebbero essere ricoperte con sabbia o bicarbonato di sodio,
che le assorba. Il materiale deve essere poi messo in un'area aperta, in cui il solvente
possa evaporare ed il composto litioorganico essere ossidato o idrolizzato all'aria.
Successivamente il residuo può essere lavato nel sistema di trattamento delle acque.
IN CASO DI INCENDIO
Quando si lavora con i composti litioorganici si deve sempre
tener presente la possibilità di ignizione spontanea:
tutto l'equipaggiamento necessario per combattere il fuoco
deve essere a portata di mano: estintori portabili e mobili,
recipienti con sabbia.
Gli incendi NON si devono combattere con acqua, estintori ad anidride carbonica
o ad idrocarburi alogenati.
Sistemi adatti per combattere il fuoco da composti litioorganici sono:
sabbia, estintori a base di bicarbonato ed estintori a base di cloruro di
sodio (per es., Totalit M).
31
16












