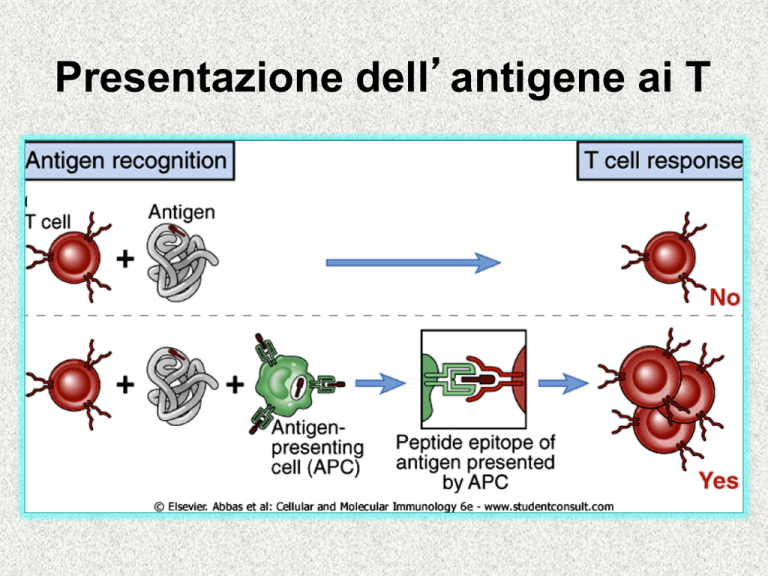
Presentazione dell’antigene ai T
PROCESSAZIONE E PRESENTAZIONE
DELL'ANTIGENE PROTEICO AI LINFOCITI T
L’antigene, per essere presentato ai linfociti T, deve
essere prima processato.
Processazione e Presentazione avvengono nelle
Cellule Presentanti l'Antigene (APC):
• APC Professionali : presentano ai TCD4+
• Tutte le cellule dell'organismo: presentano ai TCD8+.
APC Professionali
Linfociti B Macrofagi
Cellule
Dendritiche
Capacità endocitica
+ (++)
+++
+++
Capacità fagocitica
+
+++
++
MHC II
+++
+(++ INF)
++(+++IFN)
molecole
costimolatorie e di
adesione
+++
+(++)
++(+++)
Presentazione Ag ai
T
+++
+
+++
Capacità migratoria
++
-
+++
Capacità regolatoria
dei T
++
+
+++
Funzioni delle APC professionali
Processazione dell’Antigene
Ø Trasformazione di proteine, provenienti dai patogeni
o dalle cellule trasformate, in peptidi che si legano
alle molecole MHC.
Ø Processo fondamentale per formare la risposta
protettiva dei Linfociti T.
Ø Le cellule usano una varietà di meccanismi per
acquisire e degradare le proteine antigeniche
Ø Gli stessi meccanismi di processazione sono usati
anche dalle proteine self e sono necessari per
stabilire e mantenere la tolleranza
FASI DELLA PROCESSAZIONE E
PRESENTAZIONE DELL'ANTIGENE
Antigene
nativo
Antigene nativo
ê
ê
Processazione
Processazione
ê
êdel Peptide
Formazione
Formazione del Peptide
ê
Legame con l'MHC
ê
Legame con
l'MHC
ê
Presentazione ai Linfociti T
ê
Presentazione ai Linfociti T
MHC I e MHC II si legano a peptidi
derivati da:
PROTEINE ENDOGENE
Residenti nel Cytosol e sintetizzate:
- dalle stesse cellule
- normali
- infettate da virus
- trasformate da neoplasia
- da microrganismi viventi estranei penetrati nel Cytosol
PROTEINE ESOGENE
Provenienti da una sorgente esogena tramite:
- endocitosi
- fagocitosi
- macropinocitosi
§
§
Il polimorfismo delle molecole MHC regola il legame con il peptide.
Sistemi Proteolitici Cellulari:
§ 1. Sistema Cytosolico: dove la maggior parte
della proteolisi è localizzata nel
PROTEASOMA
§ 2. Sistema Endosomiale: dove la maggior
parte della proteolisi è localizzata nei
LISOSOMI
Enzimi della degradazione
delle Proteine
Ø nel Cytosol:
§ Proteasi del Proteasoma
§ Peptidasi Citosoliche
Ø nel R.E:
§ Peptidasi Residenti nel R.E. (ERAP)
Ø negli Endosomi/Lisosomi:
§ Proteasi Lisosomiali
Vie di processazione di proteine esogene ed endogene
MHC e Peptidi
§ MHC I si lega a peptidi derivati perlopiù
dalla Proteolisi Citosolica
§ MHC II si lega a peptidi derivati dalla
Proteolisi Lisosomiale
Origine delle proteine degradate nel
Proteasoma
Cytosol
Struttura del PROTEASOMA 20S
con proteasi
Sito catalitico
Degradazione delle proteine nel cytosol :
Le proteine cellulari presenti nel cytosol prima si legano alla catena di
Poli-Ubiquitina poi sono degradate nel:
PROTEASOMA 26S:
grosso complesso proteolitico ATP-dipendente localizzato nel cytosol
e formato da:
Proteasoma 20S:
2 anelli α ! 7 subunità strutturali e regolatorie
2 anelli β ! 7 subunità di cui 3 catalitiche (β1,β2,β5)
+ 2 complessi regolatori e attivatori con attività ATP-asica (19S)
Ha la funzione di idrolizzare copletamente le proteine fino a corti
oligopeptidi ( da 10 a 24 residui )
+ IFN γ
Immunoproteasoma
Ø Indotto da citochine immuni (IFNγ e TNFα)
Ø Proteasoma 20S + 2 (11S)
Ø Sostituisce le 3 subunità β catalitiche con subunità in
parte polimorfiche e selettive (β1i, β2i, β5i )
Ø Degradazione ATP-indipendente di proteine isolate
Traslocazione dei peptidi nel RE
Peptidi prodotti dalla digestione del Proteasoma
• degradazione ulteriore tramite Peptidasi Citosoliche
• trasporto attivo e selettivo tramite proteine trasportatrici
polimorfiche ATP-dipendenti: TAP1 e TAP2
• traslocazione nel R.E.
• ulteriore degradazione da parte di peptidasi del RE (ERAP)
in peptidi di 8-10 aa
Struttura TAP
N
N
NBD
peptide
TAP1 e TAP2
Dinamica del Trasporto Attivo di Peptidi
ERp57
Struttura
dell’eterodimero
Tapasina /ERp57
Tapasina
Complesso di Carico del Peptide
(PLC)
Componenti del PLC
Complesso di Carico del Peptide (PLC)
Ø È un complesso che facilita il caricamento del peptide
su MHC-I e che è formato da: 2 x (MHC-I+β2microglobulina, TAP, Tapasina+ERp57 e CRT).
Ø La Tapasina è una glicoproteina transmembranaria che
si associa con TAP e che recluta il dimero MHC-I/β2-m
e la CRT al PLC
Ø La Tapasina è legata stabilmente con l’enzima ERp57
Ø ERp57 si associa a CRT
Ø Calreticulina (CRT) e Calnessina (CNX) sono molecole
chaperon importanti per l’assemblaggio di MHC-I
Biosintesi dell’MHC I
MHC-I
biosynthesis
and antigenic
peptide
binding in the
endoplasmic
reticulum (ER
Legame tra MHC-I e Peptide
1. Dopo il reclutamento di MHC-I al PLC, si
forma un legame diretto tra Tapasina e
MHC-I
2. Il successivo legame MHC/peptide induce
la dissociazione di MHC-I dalla Tapasina
3. Se l’affinità del peptide è alta, il
complesso MHC-I/peptide è trasportato
alla superficie cellulare,
4. Se l’affinità è bassa MHC-I si riassocia con
CRT e PLC
Origine
delle
proteine
degradate
nel sistema
lisosomiale
Clatrina o
Caveolina
Origine delle proteine degradate nel
sistema lisosomiale
Proteine Esogene catturate da molti recettori di
membrana (BCR, FcR, CTLR, MR,TLR …) e
internalizzate tramite:
Ø Fagocitosi di patogeni e antigeni particellati
Ø Endocitosi mediata da Clatrina, di proteine di
membrana e macromolecole solubili
Ø Macropinocitosi di grandi quantità di
materiale extracellulare
Proteine Endogene tramite:
Ø Autofagia di materiale citoplasmatico e
nucleare
Traffico Intracellulare degli antigeni durante la
presentazione con MHC II
2015
Degradazione lisosomiale
Ø Le proteine e le particelle internalizzate sono
degradate in vescicole che presentano un
progressivo aumento di acidità e di proteolisi
Ø gli Endosomi e i Fagosomi si fondono con i
Lisosomi contenenti enzimi proteolitici e diventano
Endosomi tardivi e Fagolisosomi con Ph 4/4.5 e
elevato contenuto di proteasi (catepsine).
Ø Qui si generano i peptidi che si legano all’MHC
Autofagia
I peptidi legati all’MHC-II derivano per il
10/30% da proteine citoplasmatiche o nucleari
tramite tre vie di autofagia:
– Macroautofagia: importazione non-selettiva
(piccole porzioni di cytosol importate nei
Lisosomi)
– Autofagia Mediata da molecole chaperon
(Hsc70 e Lamp2)
– Microautofagia: importazione diretta di
proteine negli endosomi
Vie dell’Autofagia
i peptidi derivati dall’Autofagia competono con
quelli derivati dalle proteine endocitate
Autofagosoma
Formazione nel RE del complesso
MHC II/Catena Invariante
catena α + catena β
+ Calnessina
+ Catena Invariante.
§
formazione del Nonamero :
3 x (catena α + catena β + catena invariante.)
Catena Invariante (I chain)
Ø È una glicoproteina transmembranaria nonpolimorfica
Ø Ha un’azione "chaperon" durante la biosintesi
del MHC-II, promuovendo il ripiegamento
della molecola
Ø Protegge la tasca dell’MHC-II, impedendo il
legame con i peptidi presenti nel R.E.
Ø Trasporta l'MHC-II complessato al
compartimento endocitico
Invariant Chain Structure
Models of the I Chain Trimer and the MHC Class II–i Chain Complex
The left panel shows a schematic representation of an i chain trimer,
while the right panel shows a model of the class II– i chain complex
with two of three class II αβ dimers
Cell Volume 84, Issue 4 1996 505 - 507
Formazione del complesso
MHC-II /catena Invariante nel RE
Processazione della Catena Invariante e
legame con il peptide
Associazione del peptide con MHC II
Ø Trasporto del nonamero tramite la via
endocitica negli endosomi
Ø Degradazione enzimatica della catena
invariante fino alla formazione del “peptide
della catena invariante (CLIP)” legato alla
tasca dell' MHC II
Ø Dissociazione del CLIP tramite l'enzima
HLA-DM e sostituzione del CLIP con il
peptide
Gli Endosomi tardivi (MIIC) sono
ricchi di complessi MHC-II e di HLA-DM
Alla superficie
cellulare
Ann.Rev.Immunol
2005,23:975
Funzioni di HLA-DM
Ø HLA-DM è una glicoproteina omologa a MHC-II
ma ha un limitato polimorfismo
Ø Si lega con il complesso MHC-II/ CLIP negli
endosomi tardivi, formando un PLC (peptide
loading complex)
Ø Induce la rimozione di CLIP permettendo
l’attacco del peptide antigenico
Ø HLA-DM rimuove i peptidi a bassa affinità da
MHC-II, favorendo quelli ad alta affinità
Ø La funzione di HLA-DM è inibita da HLA-DO
HLA-DR1 and HLA-DM ectodomains are aligned parallel to each other.
Major
histocompatibility
complex
(MHC)-II
biosynthesis and
antigenic peptide
binding in the
endocytic
pathway
I Principi chiave del legame con il peptide
sono molto simili per MHC-I e MHC-II
Ø Molecole Chaperon particolari stabilizzano le
molecole MHC vuote e accelerano il legame con il
peptide
Ø L’associazione Tapasina/MHC-I ha la stessa
funzione di HLA-DM/MHC-II
Ø Un rapido scambio del peptide favorisce
l’acquisizione di peptidi ad alta affinità
Ø Il legame con il peptide induce la dissociazione del
MHC dal PLC
Presentazione Crociata
Premessa: i Linfociti TCD8+ vergini per diventare
Linfociti T effettori citotossici devono prima essere
attivati dalle APC
Ø Peptidi derivati da antigeni di patogeni
internalizzati nelle APC (CD) sono presentati
su MHC I ai TCD8+ vergini
Presentazione Crociata nelle
C.D.
C.D.
TCD4+
Vie della Presentazione Crociata
di antigeni esogeni
Dopo l’internalizzazione l’antigene esogeno può seguire
due vie:
1. Via Citosolica – esportato (transcitosi) nel cytosol
dove è processato dal proteasoma. I peptidi possono
essere importati nel R.E per essere legati all’MHC-I
2. Via Vacuolare o Endocitica – degradato direttamente
nel fagosoma e poi legato a MHC-I riciclato dalla
membrana cellulare
Vie
intercellulari
della
presentazione
crociata
nelle Cellule
Dendritiche
Vie della Presentazione Crociata
con vie di Trasporto dell’MHC I
Traffico
Intracellulare
degli antigeni
durante la
presentazione
crociata su
MHC I.
Influenza dei
Recettori leganti
l’antigene
2015
Fattori che influenzano la
Presentazione Crociata
Tutte le sottopopolazioni di CD possono avere
la presentazione crociata che dipende da:
Ø Tipo di antigene
Ø Fattori stimolatori
Ø Stadio della risposta immune
Fattori che
influenzano la
Presentazione
Crociata
La Presentazione Crociata
Ø E’ fondamentale per indurre una risposta immune
citotossica
Ø verso virus e batteri che non hanno infettato le APC
Ø verso cellule tumorali (immunoterapia antitumorale)
Ø E’ fondamentale per indurre la tolleranza
crociata, eliminando i TCD8+ autoreattivi
Riconoscimento degli antigeni
da parte delle Cellule T
§ CD8+ T riconoscono peptidi (esogeni ed
endogeni) presentati da molecole MHC-I
§ CD4+ T riconoscono peptidi (esogeni ed
endogeni) presentati da molecole MHC-II
§ Cellule T riconoscono antigeni lipidici
associati con molecole CD1 .
RICONOSCIMENTO SPECIFICO DEL COMPLESSO
MHC/PEPTIDE :
TASCA + PEPTIDE --------------------------------------è TCR
dominio α 3 della catena α (MHC I)-------------------è CD8
TASCA + PEPTIDE ---------------------------------------è TCR
domini α 2 e β 2 delle catena α e β (MHC II)---------è CD4
SCOPO della PRESENTAZIONE ai LINFOCITI T
del complesso
MHC + PEPTIDE
sulla membrana delle cellule APC:
1) se è un peptide SELF
a) durante la maturazione intratimica
- induce la TOLLERANZA
b) in periferia
- mantiene la TOLLERANZA
2) se è un peptide NON-SELF
induce la RISPOSTA IMMUNE
Molecole CD1
Ø Presentano lipidi e glicolipidi (microbici e self) ai
Linfociti T e ai NKT invarianti
Ø Struttura 2aria uguale all'MHC I : catena α + β2m
Ø 5 Geni su cromosoma 1 (CD1-A-B-C-D-E) codificanti per:
Ø gruppo 1 (CD1a, CD1b, CD1c): su timociti e APC
Ø gruppo 2 (Cd1d): su epitelio gastrointestinale,DC, monociti
Ø Non sono polimorfiche
Analisi Cristallografica del CD1
Traffico intracellulare del CD1
Ø Durante la formazione nel R.E. si associano a molecole
chaperon per stabilizzarsi
Ø per una maggiore sorveglianza, appena sintetizzate vanno
sulla membrana cellulare per poi essere internalizzate negli
endosomi e riciclare
Ø Sono associate a microdomini di membrana resistenti alla
degradazione e ricchi di colesterolo e lipidi
Ø Attività importante nell’immunità antibatterica e antivirale
Internalizzazione dei lipidi
Recettori(PRR)
per lipidi Esogeni
Lipidi endogeni
Lipidi endogeni
Origine dei Lipidi
§ Lipidi esogeni:
§ Sono di derivazione microbica o self
§ Sono fagocitati o internalizzati (tramite recettori PRR)
§ Si legano al CD1 negli endosomi o sulla superficie
cellulare
§ Il loro riconoscimento contribuisce all’immunità
adattativa: antimicrobica e antitumorale.
§ Utilità per i vaccini.
§ Lipidi endogeni:
§ Sono di derivazione microbica (micobatteri) o self (Lipidi
di membrana, lipidi endocellulari)
§ Si legano al CD1 nel sistema endocitico e nel RE.
§ Sono importanti per evidenziare i lipidi alterati,
sorvegliando l’integrità metabolica della cellula
§ I lipidi sono processati nei lisosomi ad opera di idrolasi
Meccanismo dell’attivazione dei T da parte dei
lipidi esogeni ed endogeni
T cell recognizing
self lipid alterations
Tolleranza
Immunosorveglianza
Applicazione pratica nei vaccini:
• le molecole CD1 non sono polimorfiche
quindi non esiste la variabilità
individuale nella risposta immune
• non subendo mutazioni, i lipidi sono
bersagli stabili
IMPORTANZA DELLA RICERCA
E’ importante studiare il meccanismo di azione delle molecole
coinvolte nella processazione e nella presentazione degli antigeni in
condizioni fisiologiche e patologiche per due scopi :
1) nella
risposta verso antigeni non-self
per trovare sistemi di vaccinazione sempre migliori
2) nella
risposta patologica (autoimmune) verso antigeni self
per rimuovere i peptidi autologhi rapidamente e interrompere
il fenomeno autoimmunitario.
EFFETTI DEI VIRUS SULLA
PROCESSAZIONE DEGLI ANTIGENI
I Virus possono contrastare l’azione antivirale
dei linfociti T, bloccando la Presentazione
PERSISTENZA VIRALE
Persistenza virale
I Virus impediscono la presentazione dei peptidi virali da parte
dell'MHC producendo proteine che inibiscono:
• la proteolisi del proteasoma (EBV, HSV),
• la funzione dei TAP(EBV, HSV)
• il trasporto dell'MHC sulla membrana (HCMV,HIV)
La conoscenza della struttura e della funzione di tali proteine
virali può essere importante per progettare una terapia genica
o un vaccino.












