Principali categorie di disordini
genetici
• Difetti monogenici
- Mendeliani
- Atipici
• Difetti cromosomici
• Ereditarietà Complessa (multifattoriale)
• Difetti genetici somatici
Età di espressione delle malattie
genetiche
Alberi Genealogici - Simboli
Terminologia genetica
B1
A1
loci
B2
A2
alleli
alleli
A
a
Cromosomi omologhi
a
A
(car.dominante)
a
a
(car.recessivo)
genotipo
A
A
A
A
a
a
omozigoti
fenotipo
a
a
gameti
eterozigote
Familiarità
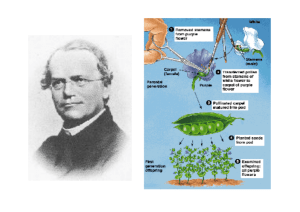
Modelli di ereditarietà monogenica
mendeliana
Dominante
Recessiva
Autosomica
Autosomica
dominante
Autosomica
recessiva
Legata alla X
Legata alla X
dominante
Legata alla X
recessiva
Legata all’Y
Dominanza e Recessività
• Dominanza incompleta
• Relatività del termine Dominanza (sono i
caratteri e non i geni ad essere dominanti
o recessivi)
• Perdita e acquisto di funzione
• Aplo-insufficienza e dominanti negativi
• Perdita casuale del secondo allele
Elevata frequenza di casi isolati
Calcolo della frequenza dei portatori
Incidenza Fibrosi cistica
(Caucasici)
Frequenza allelica
Frequenza eterozigote
q2=0.0005 (1/2000)
q=0.022
2pq=0.043 (1/23)
Consanguineità
Omozigosità per discendenza
La probabilità che III sia omozigote è ½ x ½ = ¼
Coefficiente di Inbreeding (F) tra I e II = 1/4
Coefficiente di inbreeding
(probabilità di generare un figlio omozigote –
omozigosità per discendenza)
Tipo
Grado di
parentela
Geni in comune
Coeff.
Inbreeding figli
Gemelli
monozigoti
-
1
-
Genitore-Figlio
1° grado
½
¼
Fratello-Sorella
1° grado
1/2
1/4
FratelloSorellastra
2° grado
1/4
1/8
Zio-Nipote
3° grado
1/8
1/16
Primi cugini
3° grado
1/8
1/16 (0.0625)
Cugini 2° gr.
5° grado
1/32
1/64 (0.016)
Rischio di omozigosità per uno specifico allele
da un accoppiamento tra parenti stretti
La probabilità che da un accoppiamento tra cugini primi
nasca un figlio omozigote per un allele raro è:
p x F cioè p/16
Per p = 0.001, c’è 1 probabilità su 16000 (0.0000625) di
far nascere un omozigote dall’accoppiamento tra cugini
primi, rispetto a 1 su milione (0.001 x 0.001)
dall’accoppiamento tra individui non imparentati.
Per p = 0.023, c’è 1 probabilità su 696 (0.0014) di far
nascere un omozigote dall’accoppiamento tra cugini primi,
rispetto a 1 su 1890 (0.00053) nell’accoppiamento tra
individui non imparentati.
• Rischio di omozigosità per discendenza
• Coefficiente di inbreeding
• Importanza della frequenza eterozigoti nella popolazione
(per p=0.023 Rischio relativo solo + 2.7 volte nell’accoppiamento
tra cugini primi)
• Isolati genetici
Coefficienti di inbreeding per alcune
popolazioni umane
Canada cattolico
Stati Uniti
Cattolici
Hutterites
Dunkers
America latina
Europa meridionale
Giappone
Samaritani
0.00004-0.0007
0-0.0008
0.02
0.03
0-0.003
0.001-0.002
0.005
0.04
Complementazione di tratti recessivi
Test di complementazione
Un locus
Due locus
a1a1 x a2a2
aaBB x AAbb
Progenie
a1a2
AaBb
Fenotipo
Mutante
Selvatico
Incrocio parentale
Se due caratteri recessivi sono dovuti a mutazioni nello
stesso gene, la progenie di un incrocio tra omozigoti avrà
fenotipo mutante. Se invece sono dovuti a mutazioni in
geni diversi, la progenie di un incrocio tra omozigoti avrà
fenotipo selvatico.
Ereditarietà autosomica recessiva
• Il fenotipo si presenta in genere in una o
poche generazioni (pedigree orizzontale)
• Maschi e femmine hanno la stessa
probabilità di manifestare il fenotipo
• I genitori sono generalmente portatori
asintomatici
• Possibile presenza di matrimoni tra
consanguinei (soprattutto se l’allele è raro)
• Probabilità di ricorrenza nei fratelli: 1/4
Ereditarietà autosomica dominante
•Un individuo affetto ha il 50% di
probabilità di trasmettere il
carattere
•La probabilità che più figli siano
affetti è il prodotto delle loro
probabilità indipendenti
Nuove mutazioni
Disorder
Frequency of
new mutations
Cleidocranial dysostosis
30%
Neurofibromatosis Type I
50%
Achondroplasia
75%
Apert's Syndrome
99%
Relazione inversa tra la fitness di un certo disordine
autosomico dominante e la proporzione di nuove
mutazioni
Penetranza incompleta
Variabilità nel fenotipo dei geni mutanti
• espressività variabile: la severità di una
patologia differisce all’interno di persone
con lo stesso genotipo
• pleiotropia: le manifestazioni del
disordine interessano diversi organi e
tessuti e variano negli individui portatori
del gene mutante
Difetto nel gene per la fibrillina
Esempio di espressività variabile
e pleiotropia
Omozigosità per un tratto autosomico
dominante
• Effetto del dosaggio genico
• Fenotipi più gravi che negli eterozigoti
• Es. Acondroplasia, Ipercolesterolemia
familiare
• Eccezioni: Malattia di Hungtinton,
Neoplasia Endocrina Multipla II (MENII)
Fenotipi limitati al sesso
Albero della pubertà precoce limitata ai maschi
Ereditarietà autosomica dominante
• Il fenotipo si presenta in genere ad ogni
generazione
• Maschi e femmine hanno la stessa probabilità di
manifestare e trasmettere il fenotipo
• Uno dei genitori generalmente manifesta il
fenotipo (ecc. penetranza incompleta)
• Casi isolati possono essere dovuti a nuove
mutazioni (soprattutto se la fitness è bassa)
• Probabilità di ricorrenza nei fratelli: 1/2
04_02.jpg
04_02.jpg
Ereditarietà X-linked recessiva
I:1
II:1
IV:1
II:1
II:2
III:2
III:3
I:2
II:3
III:4
II:4
III:5
II:5
III:6
III:7
IV:2
Femmina portatrice
II:6
III:8
III:9
IV:3
Incroci
Inattivazione del cromosoma X
10_26.jpg
10_26_2.jpg
Mosaicismo funzionale nelle femmine
portatrici della DMD
normale
portatrice
affetto
Ereditarietà X-linked recessiva
• Il fenotipo è più frequente nei maschi
• Le femmine non mostrano il fenotipo o lo
esprimono con severità variabile
• Il gene responsabile non è mai trasmesso da
padre a figlio, ma lo è a tutte le figlie
• Un figlio di una portatrice ha il 50% di probabilità
di ereditare il gene responsabile
• Casi isolati possono essere dovuti a nuove
mutazioni (soprattutto se la fitness è bassa)
• I maschi affetti di una famiglia sono legati
attraverso le femmine
Ereditarietà X-linked dominante
Ereditarietà X-linked dominante
• Il fenotipo si presenta in genere ad ogni
generazione
• Il fenotipo è più frequente anche se più lieve
nelle femmine
• Il gene responsabile non è mai trasmesso da
padre a figlio, ma lo è a tutte le figlie
• Figli maschi e femmine di una portatrice hanno il
50% di probabilità di ereditare il fenotipo
Letalità nei maschi
04_02.jpg
04_02.jpg
Regioni pseudo-autosomiche
Ereditarietà pseudoautosomica
presenza di
trasmissione
maschio-maschio
Discondrosteosi
Modelli Atipici di Ereditarietà
• Imprinting genomico
• Mosaicismo
• Ereditarietà mitocondriale
Imprinting genomico
espressione dipendente dall’origine gametica
Paternal allele
GENE 1
ON
non Imprinted
Maternal allele
GENE 2
GENE 3
ON
OFF
Imprinted
Imprinted
GENE 1
GENE 2
GENE 3
ON
OFF
ON
10_25.jpg
Modificazioni epigenetiche dei geni imprinted
Reik & Walter, 2001
Perpetuazione
della metilazione
del DNA
Difetti dei geni Imprinted.
1. Disomia Uniparentale
Conseguenze della UPD
sull’espressione dei geni imprinted
2. Mutazioni. Il fenotipo dipende
dall’origine parentale dell’allele mutato
Abnormal
M
Normal
M
3) Epimutazioni.
Errori nel ciclo dell’Imprinting
Difetti molecolari differenti degli stessi
geni imprinted causano spesso fenotipi
contrastanti
Regione cromosomica 11p15.5
Ipermetilazione/
Duplicazione paterna
Beckwith-Wiedemann
Syndrome
(gigantismo)
Ipometilazione/
Duplicazione materna
Silver-Russell
Syndrome
(nanismo)
15q11-q13 and Prader-Willi and
Angelman Syndromes
Sindrome di Prader-Willi
• obesity
• short stature
• hypotonia
• mental retardation
Defect of paternally
expressed genes
Sindrome di Angelman
• hyperactivity
• ataxia
• mental retardation
• happy disposition
Defect of maternally
expressed genes
Mosaici e Chimere
04_10.jpg
Mosaicismo
mosaicismo somatico
mosaicismo della linea germinale
Ereditarietà mitocondriale
Eteroplasmia
Collo di bottiglia
mitocondriale
Penetranza incompleta, espressività variabile, pleiotropia
recessiva
(ecc. aplo-insufficienza)
Effetto delle mutazioni
sull’espressione
del fenotipo
recessiva
dominante
Effetto delle mutazioni sulla funzione proteica
• Perdita di funzione (concentrazione o attività ridotta)
Es. α- e β-talassemie, retinoblastoma, fenilchetonuria
• Aumento di funzione (concentrazione o attività aumentata)
Es. Acondroplasia, alcune emoglobinopatie, Down,
Charcot-Marie-Tooth
• Acquisizione di nuova proprietà
Es. Anemia falciforme
• Espressione non corretta (nel tempo o nel luogo)
Es. Tumori, HPFH
Stadi ai quali una mutazione può alterare
la formazione di una proteina normale
•
•
•
•
•
•
•
•
Trascrizione
Traduzione
Acquisizione della struttura sec. e terz.
Localizzazione sub-cellulare
Acquisizione della struttura quaternaria
Interazione col cofattore o gruppo prostet.
Funzione biologica
Degradazione proteolitica
Anomalie primarie
Cambiamenti della sequenza del DNA del
gene strutturale che comportano difetti nella
formazione della proteina
Anomalie secondarie
Cambiamenti negli eventi di modificazione o
nella sintesi di molecole associate, richieste
per la normale funzione
Relazioni tra Genotipo e Fenotipo
nelle malattie genetiche