Il modello atomico
1. L'esperienza di Rutherford
•
•
•
Dal Seicento all'Ottocento si sviluppò lo studio
delle strutture microscopiche, grazie ai
microscopi ottici.
I microscopi ottici, tuttavia, non vedono
attraverso corpi opachi e distinguono dettagli di
circa 1 µm. Questo è dovuto alla lunghezza
d'onda della luce, in media λ ≅ 0,5 x 10-3 mm.
Per esaminare dimensioni più piccole si
utilizzano i raggi X, gli ultrasuoni o fasci di
particelle subatomiche.
Il modello atomico di Thomson
•
•
•
•
Alla fine dell'Ottocento l'ipotesi atomica era
ritenuta fondata;
gli studi sull'elettricità avevano evidenziato
l'esistenza di particelle leggere e negative, poi
chiamate elettroni;
poiché gli atomi sono neutri, J.J. Thomson ideò
un modello “a panettone”: una sfera omogenea
di carica positiva in cui sono
disseminati gli elettroni.
Descrizione dell'esperimento di Rutherford
•
•
Nel 1911 E. Rutherford portò a termine gli
esperimenti per verificare il modello di Thomson:
un fascio di particelle α (nuclei di elio con carica
+2e) veniva sparato contro una sottile lamina
d'oro.
Descrizione dell'esperimento di Rutherford
•
•
Per ricostruire la forma dell'atomo senza poterlo
vedere, Rutherford pensò di lanciargli contro
delle “palline”, come se si volessero informazioni
su un oggetto in una scatola:
Descrizione dell'esperimento di Rutherford
•
•
•
•
•
•
Misurando gli angoli di diffusione delle particelle
α si ottengono informazioni sui bersagli (gli
atomi d'oro), anche senza vederli.
Gli elettroni sono circa
10000 volte più leggeri
delle particelle α: gli angoli
di deviazione dipendono solo
dalla carica positiva contenuta nell'atomo.
Descrizione dell'esperimento di Rutherford
•
•
Nel modello di Thomson la carica positiva è
diffusa: le particelle α dovrebbero essere deviate
solo leggermente;
invece negli esperimenti si ottennero risultati
molto diversi dal previsto.
Il risultato dell'esperimento di Rutherford
•
•
Alcune particelle α (circa 1 su 8000) venivano
riflesse dalla lamina d'oro;
per spiegare il risultato, Rutherford ipotizzò un
atomo con un piccolissimo nucleo positivo al
centro di una sfera, dove la carica degli elettroni
è distribuita in modo circa uniforme.
−
raggio dell'atomo:
dell'ordine di 10-10 m;
−
raggio del nucleo:
dell'ordine di 10-14 m.
Il risultato dell'esperimento di Rutherford
•
•
•
•
•
•
•
•
La riflessione all'indietro è data dall'interazione
di alcune particelle α con il nucleo dell'atomo;
tutte le altre hanno deviazioni molto piccole o
nulle.
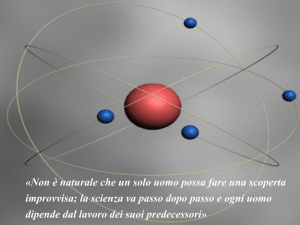
Nel modello di Rutherford,
viste le analogie tra forza di
Coulomb e forza gravitazionale, gli elettroni orbitano
attorno al nucleo come i
pianeti attorno al sole:
modello planetario dell'atomo.
2. Il modello di Bohr
•
•
•
•
•
Nel 1912 N. Bohr capì che il modello di
Rutherford non era corretto:
se un elettrone percorre un'orbita chiusa, esso
possiede un'accelerazione centripeta;
è noto che una carica accelerata emette
energia come onde elettromagnetiche;
quindi un elettrone atomico perderebbe la sua
energia (in un tempo di circa 10-7 s) e cadrebbe
sul nucleo.
L'atomo di Rutherford non poteva essere stabile.
Il modello di Bohr
•
•
•
•
Per spiegare la stabilità degli atomi, Bohr
ipotizzò che:
il raggio delle orbite attorno al nucleo può
assumere solo alcuni valori permessi;
su queste particolari orbite l'elettrone non
irraggia, quindi non perde energia.
Nell'atomo di Bohr le orbite sono quantizzate: il
raggio r, la velocità v e l'energia Etot possono
assumere solo un insieme di valori ben definiti.
La tavola periodica degli elementi
•
•
•
Nel modello di Bohr ogni atomo è
contraddistinto dal numero atomico Z (numero
degli elettroni dell'atomo neutro);
classificando gli atomi per Z crescente e
ordinandoli secondo le loro proprietà chimiche,
si ritrova il sistema periodico di Mendeleev di
metà Ottocento;
questo significa che le proprietà chimiche di un
atomo dipendono dal numero di elettroni che
occupano l'orbita più esterna (gruppo della
tavola periodica).
La tavola periodica degli elementi