Lezione 5
Thomson
Rutherford
Esperimento
Modello
Particelle subatomiche
J.J. THOMPSON
e-
H+
• Nel 1897 identifica nei raggi catodici le particelle più
piccole che formano la materia: gli elettroni
• Gli elettroni hanno una massa di 9,1·10-28 grammi, pari a
circa 1/2000 dell’atomo più leggero, idrogeno H
• portano una carica di segno (– ) pari a 1,6·10-19 coulomb
• hanno sempre le stesse caratteristiche, qualunque sia il
materiale da cui provengono
MODELLO A “PUDDING”
Thomson nel 1906 presentò il modello
dell’atomo come
• un insieme di particelle con carica
positiva, massicce e voluminose, tra le
quali si muovevano
• gli elettroni, con massa molto inferiore e
con carica negativa ma uguale a quella
delle particelle positive per cui
• l’atomo elettricamente neutro è formato da
parti positive e negative in numero uguale
Ernest RUTHERFORD
• Nel 1899 inizia a studiare la natura delle
radiazione α e β emesse da elementi
radioattivi
• Particelle β sono gli elettroni - e- • Particelle α sono nuclei di elio con due
cariche positive - He++ -
+
β
e
α
+
Esperimento di Rutherford
ipotesi
• se esistono atomi che “si
spezzano” spontaneamente,
come dimostrato dagli
esperimenti dei Curie e di
Becquerel sulla radioattività
(Nobel 1903)
• è possibile “rompere”
artificialmente l’atomo in
laboratorio
• e dall’analisi dei “pezzi”
ricavarne la struttura
Progetto di esperimento
• una foglia d’oro è
costituita da pochi strati di
atomi voluminosi e
massicci (modello di
Thomson)
• una sorgente radioattiva di
particelle α -come il
polonio- funge da
“mitragliatrice”
• si studiano i “frammenti”
degli atomi di oro colpiti e
spezzati
Esperimento di Rutherford
procedimento
materiale
• polonio che emette
particelle α
• foglia d’oro
• contattore Geiger
montato su meccanismo
che ruota attorno alla
lamina
Esperimento di Rutherford
conclusioni
• quasi tutta la massa dell’atomo occupa una
ridottissima porzione del suo volume totale, al
centro nucleo
• esso è costituito da particelle positive-protonie probabilmente da altre neutre .
• Il nucleo è, perciò, elettricamente positivo
• gli elettroni, dotati di carica elettrica
negativa, ruotano su orbite a grande distanza
dal nucleo, come pianeti attorno al sole
• quando protoni ed elettroni sono nello stesso
numero, l’atomo è elettricamente neutro
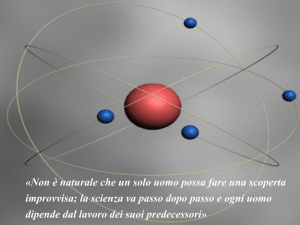
modello atomico di Rutherford
(1911)
- nel nucleo è concentrata tutta la
carica positiva dell’atomo e la
gran parte della massa di esso
• raggio dell’atomo 10-8 cm
• raggio del nucleo 10-12 cm
- la carica del nucleo corrisponde
al numero dei protoni che
contiene e viene chiamata
NUMERO ATOMICO
il nucleo è 10.000 volte
più piccolo dell’intero
atomo di cui fa parte
10-12
= 10-4
10-8
gli elettroni vengono trattenuti
dal nucleo mediante
forze di natura elettrostatica
(coulombiane)
particelle subatomiche
NOME
protone
dove si
trova
nucleo
+
carica
massa
quantità
(coulomb)
(grammi
unità chimica)
+
1,910-19
neutrone
-
spazio
esterno al
nucleo
0
1,910-19
data
E.Rutherford
1911
1
1,6745 10-24 g
nucleo
elettrone
1,6723 10-24 g
scopritore
J. Chadwich
1932
1
9,109610-28 g
1/1836
J.J. Thomson
1897