scaricato da www.sunhope.it
LEZIONE 2
Configurazioni elettroniche e tavola
periodica
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
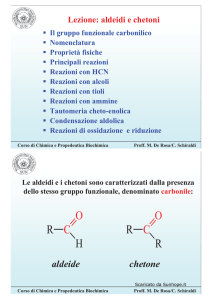
COSTRUZIONE DELLA
CONFIGURAZIONE ELETTRONICA
scaricato da www.sunhope.it
1. Principio di Aufbau: gli elettroni occupano gli orbitali in
ordine crescente di energia. /¶HQHUJLD dipende dai numeri
quantici n ed l.
2. Principio di esclusione di Pauli: in un atomo due elettroni
non possono essere descritti dalla stessa sequenza dei quattro
numero quantici (principale, secondario, magnetico, spin)
in un orbitale possono esserci al massimo 2 elettroni.
3. Regola di Hund: quando si hanno a disposizione più orbitali
degeneri (es. 2p), gli elettroni tendono a occuparli con spin
paralleli finché ci sono orbitali vuoti a disposizione.
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
Riempimento degli orbitali in ordine
crescente di energia
scaricato da www.sunhope.it
7s
6s
6p
6d
6f
5s
5p
5d
5f
4s
4p
4d
4f
3s
3p
3d
2s
2p
1s
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
scaricato da www.sunhope.it
n=4
Energia
n=3
3d
3p
3s
n =2
4f
4d
4p
4s
2p
2s
n =1
1s
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
Principio di esclusione di Pauli
scaricato da www.sunhope.it
In un orbitale ci sono al massimo 2 e
In uno stesso
orbitale,
caratterizzato da
una terna di
numeri quantici
(n, l, m) si
possono
avere
soltanto
due
elettroni che, in
tal caso, devono
avere
spin
opposti.
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
Distribuzione degli elettroni
scaricato da www.sunhope.it
Il numero di sottolivelli in ogni livello è uguale al numero
quantico principale n:
n=1 (1s)
n=2 (2s, 2p)
n=3 (3s, 3p, 3d)
n=4 (4s, 4p, 4d, 4f)
Il numero massimo di
elettroni in un sottolivello è:
s
2e
p 6e
d 10e
f 14e
Corso di Chimica e Propedeutica Biochimica
Il numero massimo di
elettroni in un livello è 2n2.
2e
n=1 (1s2)
n=2 (2s2, 2p6)
8e
2
6
10
n=3 (3s , 3p , 3d )
18e
2
6
10
14
n=4 (4s , 4p , 4d , 4f ) 32e
Proff. M. De Rosa / C. Schiraldi
Distribuzione degli elettroni
scaricato da www.sunhope.it
Livello
(n)
Sottolivelli
(s, p, d, f)
Numero di
elettroni nei
sottolivelli
Numero totale
di elettroni nel
livello (2n2)
1
1s
2
2
2
2s
2p
2
6
8
3
3s
3p
3d
4s
4p
4d
4f
2
6
10
2
6
10
14
4
Corso di Chimica e Propedeutica Biochimica
18
32
Proff. M. De Rosa / C. Schiraldi
scaricato da www.sunhope.it
Esempi
Scrivere la configurazione elettronica
GHOO¶RVVLJHQR2= 1s2 2s2 2p4
1s
2s
2p
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
Riempimento dei livelli n=1 e n=2
scaricato da www.sunhope.it
1s
2s
H 1s1
2px
2py
2pz
He 1s2
Li 1s2 2s1
Be 1s2 2s2
B 1s2 2s2 2p1
C 1s2 2s2 2p2
N 1s2 2s2 2p3
O 1s2 2s2 2p4
F 1s2 2s2 2p5
Ne 1s2 2s2 2p6
scaricato da www.sunhope.it
energia
Dopo il riempimento degli orbitali 3s 3p, il 19°
elettrone YDDGRFFXSDUHO¶RUELWDOHV. Completato
questo orbitale (con il Ca), il 21° elettrone si va a
porre in uno dei cinque orbitali 3d.
4s
3s
2s
1s
3d
3px 3py 3pz
2px 2py 2pz
scaricato da www.sunhope.it
TAVOLA PERIODICA
9 Tavola periodica
9 Metalli e non metalli
9 Reattività dei gruppi I, II, VI, VII
9 Cenni su III, IV, V gruppo
9 Gas nobili
9 Valenza
9 Affinità elettronica
9 Energia di ionizzazione
9 Elettronegatività
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
LA TAVOLA PERIODICA
scaricato da www.sunhope.it
Dmitri Mendeleev
(1834-1907)
Concepita dal chimico Mendeleev sulla base di
analogie e differenze di comportamento tra i
vari elementi
Riorganizzazione e razionalizzazione successiva
in termini di struttura elettronica dei vari
elementi
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
LA TAVOLA PERIODICA
scaricato da www.sunhope.it
Otto colonne = VIII gruppi
Sette righe = 7 periodi
I gruppi sono numerati da I a VIII da sinistra a destra e i periodi da 1 a
GDOO¶DOWRLQEDVVR
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
scaricato da www.sunhope.it
Gli elementi a sinistra sono detti del blocco s, quelli a destra sono detti del
blocco p e quelli al centro del blocco d (elementi di transizione).
Nel VI periodo, tra il lantanio e O¶DIQLR si trovano ulteriori 14 elementi detti
lantanidi. Nel VII periodo si ha un analogo gruppo di elementi aggiuntivi
detti attinidi. Lantanidi e attinidi costituiscono il gruppo f della tavola
periodica.
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
CLASSIFICAZIONE DEGLI ELEMENTI IN
METALLI, NON METALLI E SEMI-METALLI (METALLOIDI)
scaricato da www.sunhope.it
Una linea diagonale che taglia la tabella periodica, come descritto in
figura, consente di individuare gli elementi di tipo metallico e non
metallico
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
scaricato da www.sunhope.it
GLI ELEMENTI METALLICI
9 Solidi a temperatura ambiente (ad eccezione del
mercurio: Tf= ±39°C)
9 Alta conducibilità elettrica
9 Ottimi conduttori del calore
9 Alto potere riflettente e lucentezza metallica
9 Duttili e malleabili
9 Se riscaldati o esposti a radiazioni elevate si rileva
effetto fotoelettrico ed effetto termoionico
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
scaricato da www.sunhope.it
GLI ELEMENTI NON METALLICI
9 Possono essere gas, liquidi o solidi a temperatura
ambiente
9 Cattivi conduttori di calore
9 Isolanti
9 Non riflettono la luce e non hanno aspetto
metallico
9 Allo stato solido sono in genere fragili
9 Non mostrano effetto fotoelettrico o termoionico
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
ELEMENTI RAPPRESENTATIVI DI
METALLI, NON METALLI E SEMI-METALLI (METALLOIDI)
scaricato da www.sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
35235,(7$¶'(,0(7$//,$/&$/,1,
(I GRUPPO)
scaricato da www.sunhope.it
3
Li
Hanno tutti carattere metallico
Formano cationi di carica +1
Reagiscono con H2, O2 (formando ossidi basici di formula M2O
6,939
che con acqua danno idrossidi che si comportano come basi forti),
alogeni e H2O (la rex con acqua è violenta, la reattività aumenta
Na
22,990
lungo il gruppo)
19
K Essendo molto reattivi non si trovano in natura come metalli liberi ma
39,102
soprattutto sottoforma di sali
11
37
Rb
85,47
55
2 Li + H2
2 LiH
2 Na + Cl2
2 NaCl
2 Li(s) + ½O2(g) o Li2O(s)
Cs
132,91
Li2O(s) + H2O(l) o LiOH(s) o 2 Li+ + 2 OH-
2 Na + 2 H2O
2 NaOH + H2
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
35235,(7$¶'(,0(7$//,
ALCALINO-TERROSI (II GRUPPO)
scaricato da www.sunhope.it
Hanno tutti carattere metallico, sono più duri rispetto ai metalli
alcalini fondono a temperature più alte e sono meno reattivi
Formano cationi di carica +2 (il Be, con Eion più alta, forma anche
4
Be
9,0122
12
Mg
24,312
20
Ca
40,08
legami covalenti)
Reagiscono con H2, O2 (formando ossidi basici di formula MO),
alogeni e H2O (la rex con acqua è meno violenta di quella dei metalli
alcalini)
In natura si trovano soprattutto sottoforma di Sali e ossidi
Ca + H2
CaH2
Be + Cl2
BeCl2
38
Sr
87,62
56
Ba
Ca(s) + ½O2(g) o CaO(s)
CaO(s) + H2O(l) o CaOH2(s) o Ca2+ + 2 OH-
137,34
Mg + 2 H2O
Mg(OH)2 + H2
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
GRUPPI III-VI
scaricato da www.sunhope.it
III
VII
NON METALLI
METALLI
Gli elementi dei Gruppi dal III al VII hanno caratteristiche varie,
LQTXDQWRDOO¶LQWHUQRGHOORVWHVVRJUXSSRYLVRQRHOHPHQWLFRQ
carattere metallico e non metallico.
III GRUPPO
scaricato da www.sunhope.it
Tutti gli elementi hanno configurazione elettronica ns2 np1
Il boro è un non metallo
mentre Al, Ga, In e Tl sono tutti metalli.
5
B
10,811
13
Al
26,982
Indio (In) (in alto)
31
Ga
69,72
Alluminio (Al) (in basso)
49
In
114,82
81
Tl
204,37
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
Elementi del gruppo IV
scaricato da www.sunhope.it
Pb
Si
Sn
C
Tutti gli elementi hanno configurazione elettronica ns2 np2
carbonio (non metallo),
silicio e germanio (semi metalli)
stagno e piombo (metalli)
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
Gli elementi del V gruppo hanno configurazione
elettronica ns2 np3, quelli del VI ns2 np4
La situazione nei Gruppi V e VI è simile a quella del
Gruppo IV, ma aumenta la presenza di elementi non
metallici.
Così,
nel
Gruppo
V
si
passa
GDOO¶azoto
(un
gas,
e
principale
costituente
GHOO¶DWPRVIHUD e dal fosforo (non metalli) DOO¶DUVHQLFR e
DOO¶DQWLPRQLR (semimetalli) e al bismuto (metallo) Gli
elementi del V gruppo hanno configurazione elettronica
ns2 np3, quelli del VI ns2 np4
scaricato da www.sunhope.it
7
N
14,007
15
P
30,9738
33
As
74,922
51
Sb
121,75
83
Bi
208,980
azoto liquido (N2)
bismuto (Bi)
fosforo bianco (P4)
Corso di Chimica e Propedeutica Biochimica
arsenico (As) antimonio (Sb)
Proff. M. De Rosa / C. Schiraldi
35235,(7$¶'(*/,(/(0(17,
DEL VI GRUPPO
scaricato da www.sunhope.it
gas
O2 + 2H2
2H2O
S + H2
H2S
solidi
O, S e Se sono non metalli;
Te è un semimetallo
Po è un metallo
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
35235,(7$¶'(*/,(/(0(17,'(/9,,
GRUPPO: ALOGENI
scaricato da www.sunhope.it
9
F
18,998
17
Cl
35,453
35
Br
79,909
53
I
Gli alogeni sono tipici non metalli.
Hanno configurazione ns2 np5
A temperatura ambiente, Fluoro e Cloro sono
gassosi, il Bromo è liquido e lo Iodio è solido.
Tutti gli alogeni formano una molecola
biatomica: F2, Cl2, Br2 e I2.
126,904
cloro
bromo
Corso di Chimica e Propedeutica Biochimica
iodio
Proff. M. De Rosa / C. Schiraldi
scaricato da www.sunhope.it
5($77,9,7$¶'(*/,$/2*(1,
5HDJLVFRQRFRQO¶+2 per dare composti gassosi
solubili in acqua a carattere acido:
Cl2 + H2
F2 + H2
2 HCl
2HF
Reagiscono con i metalli dando alogenuri
I2 + 2 Na
2 NaI
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
35235,(7$¶'(*/,(/(0(17,'(/
VIII GRUPPO: GAS NOBILI
scaricato da www.sunhope.it
2
9 Hanno configurazione elettronica ns2 np6
9 Sono tutti gas a temperatura ambiente
He
4,0026
10
Ne
20,183
18
9 Sono dei tipici non metalli
Ar
39,948
36
9 Hanno struttura monoatomica
Kr
83,80
54
9 Sono fortemente inerti
Corso di Chimica e Propedeutica Biochimica
Xe
131,30
Proff. M. De Rosa / C. Schiraldi
scaricato da www.sunhope.it
/(35235,(7$¶3(5,2',&+(
ENERGIA DI PRIMA IONIZZAZIONE
RAGGIO ATOMICO
AFFINITÀ ELETTRONICA
ELETTRONEGATIVITÀ
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
scaricato da www.sunhope.it
ENERGIA DI IONIZZAZIONE
/¶HQHUJLDGLLRQL]]D]LRQH (EI) di un
HOHPHQWRqO¶HQHUJLDQHFHVVDULDSHU
allontanare un elettrone da un atomo
GHOO¶HOHPHQWRDOORVWDWRJDVVRVR
Atomo +
Energia di ionizzazione
ione + elettrone
Elemento
Idrogeno (H)
EI
2,18x10-18 J
Elio (He)
3,9x10-18 J
Sodio (Na)
0,8x10-18 J
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
scaricato da www.sunhope.it
ENERGIA DI IONIZZAZIONE
Gli elettroni di H e He appartengono entrambi al
primo livello energetico (n=1) e sono circa alla
stessa distanza dal nucleo. Tuttavia la carica
QXFOHDUHGHOO¶HOLRqPDJJLRUHGLFRQVHJXHQ]Dq
più grande la forza di attrazione tra nucleo ed
elettroni.
Elemento
EI
Idrogeno (H)
2,18x10-18 J
Elio (He)
3,9x10-18 J
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
Energia di ionizzazione
scaricato da www.sunhope.it
$OO¶LQWHUQRGLXQJUXSSRO¶HQHUJLDGLSULPDLRQL]]D]LRQHGHFUHVFH
DOO¶DXPHQWDUHGHOQXPHURDWRPLFR
$OO¶LQWHUQRGLXQSHULRGRO¶HQHUJLDGLLRQL]]D]LRQHDXPHQWDDOO¶DXPHQWDUHGHO
numero atomico.
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
RAGGIO ATOMICO
scaricato da www.sunhope.it
Diminuzione
del raggio
Aumento del numero quantico n
Aumento della carica nucleare
Aumento del raggio
scaricato da www.sunhope.it
$)),1,7$¶(/(77521,&$
(¶GHILQLWDaffinità elettronica la variazione di
energia che si misura quando un atomo libero
cattura un elettrone
Es.
Cl (g) + e-(g)
Cl-(g)
'E = -3,61 eV
6LGLFHFKHLOFORURKDXQ¶DIILQLWjHOHWWURQLFD(a)
di 3,61 eV.
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
$)),1,7$¶(/(77521,&$
scaricato da www.sunhope.it
/¶DIILQLWjHOHWWURQLFDDXPHQWDGDVLQLVWUDDGHVWUDOXQJRXQSHULRGR
HGLPLQXLVFHGDOO¶DOWRYHUVRLOEDVVRLQXQJUXSSR
/DSHULRGLFLWjFRQFXLYDULDO¶HQHUJLDGLDIILQLWjQRQqFRVuULJRURVD
FRPHTXHOODFRQFXLYDULDO¶HQHUJLDGLLRQL]]D]LRQH
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
scaricato da www.sunhope.it
(/(77521(*$7,9,7$¶
La capacità di un atomo in una molecola di
attrarre a sè gli elettroni di legame è chiamata
elettronegatività.
Tale capacità ha un andamento periodico:
aumenta procedendo lungo un periodo e
diminuisce scendendo lungo un gruppo
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
scaricato da www.sunhope.it
,YDORULGHOO¶HOHWWURQHJDWLYLWjGHJOLHOHPHQWL
elemento più
elettronegativo
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi