Indice
Alcoli e fenoli: gruppo funzionale
Alcoli: nomenclatura e classificazione
Fenoli: nomenclatura
Alcoli: principali reazioni
Fenoli
Eteri
Epossidi
Tioli
Tioeteri
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
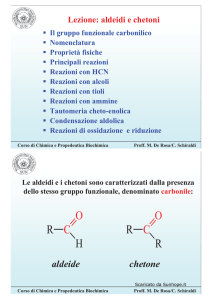
ALCOLI E FENOLI
Alcoli e fenoli sono composti con lo stesso
gruppo funzionale: ossidrile –OH.
C-OH
Il carbonio che lega la funzione ossidrilica
Può essere un gruppo alchilico (ibridazione sp3)
Può essere un gruppo alchenilico e alchinilico (ibridazione sp2 e sp)
Può essere un carbonio che fa parte di un anello aromatico
OH
ALCOL
FENOLO
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
Nomenclatura Alcoli
Il nome convenzionale di
alcoli si costruisce
aggiungendo la desinenza -olo
al nome dell’idrocarburo.
I nomi tradizionali
sono ancora in uso.
Regole di nomenclatura IUPAC per gli alcoli
con più gruppi ossidrilici
Due gruppi OH
Tre gruppi OH
DIOLI
TRIOLI
Composti contenenti gruppi ossidrilici su carboni
adiacenti possono essere chiamati
GLICOLI
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
CLASSIFICAZIONE DEGLI ALCOLI
Gli alcoli si suddividono in primari, secondari e terziari, a
seconda del numero di residui alchilici (uguali o diversi)
uniti al carbonio al quale è legato l’ossidrile.
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
NOMENCLATURA DEI FENOLI
I nomi dei diversi composti aromatici contenenti uno o
più gruppi ossidrilici derivano dal più semplice di essi
l’idrossibenzene, comunemente chiamato fenolo.
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
Gli alcoli sono composti polari
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
Proprietà fisiche degli alcoli
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
Principali reazioni degli alcoli
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
Gli alcoli sono acidi molto deboli.
I valori di Ka sono intorno a 1·10-16- 1·10-18
H
C H
H
O H
H
H
pKa 15.5
O
H
C H
H
O
H
H O
H
ALCOSSIDO
La costante acida varia in presenza di gruppi elettron-attrattori
e di gruppi elettron-repulsori
GRUPPI ELETTRON-ATTRATTORI
(ALOGENI, NO2)
GRUPPI ELETTRON-DONATORI
(GRUPPI ALCHILICI)
Corso di Chimica e Propedeutica Biochimica
AUMENTO DELL’ACIDITA’
DIMINUZIONE DELL’ACIDITA’
Scaricato da Sunhope.it
Proff. M. De Rosa / C. Schiraldi
Presenza di atomi elettron-attrattori
F
F
C
F
F
C H
H
O H
F
H
pKa 12.5
O
C
F
C H
H
O
H
H O
H
H
La presenza dei tre atomi di fluoro stabilizza l’anione
trifluoroetanoato.
Il trifluoroetanolo è un acido più forte dell’etanolo.
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
Acidità e ingombro sterico
C
Un acido è tanto più forte quanto più è stabilizzata
la sua base coniugata.
L’alcossido primario RCH2-O- è più stabilizzato dall’effetto di solvatazione rispetto
agli anioni secondari e terziari nei quali l’impedimento sterico dei gruppi alchilici
impedisce l’avvicinarsi dell’acqua.
Per questo motivo gli anioni degli alcol secondari e terziari sono più reattivi verso
H+ e quindi più basici. Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
Trattando gli alcoli con metalli alcalini si ottengono i
loro sali: ALCOSSIDI.
Ricordiamo ancora che:
BASICITA’ CRESCENTE
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
REAZIONI DI SOSTITUZIONE NUCLEOFILA (SN)
Reazione in cui un particolare atomo o gruppo presente nella
molecola (GRUPPO USCENTE) viene sostituito da un altro atomo
o gruppo (GRUPPO ENTRANTE)
Reazioni che permettono la sintesi di una larga varietà di molecole
organiche fra cui gli alcoli, le ammine, gli esteri, gli eteri etc.
Alcuni composti che sottostanno a questo tipo di reazioni:
Alcoli
ALIFATICI
Composti alogenati
AROMATICI
Esistono due tipi di meccanismi di sostituzione nucleofila
SOSTITUZIONE
DEL II ORDINE
(SN2)
Corso di Chimica e Propedeutica Biochimica
SOSTITUZIONE
DEL I ORDINE
(SN1)
Scaricato
da Sunhope.it
Proff. M. De Rosa / C. Schiraldi
Reazione di un alcol I° con un acido alogenidrico (HCl)
R
H C H
H C H
R
H C H
O
H
H
Cl-
O
O
H
H
H2O
Cl
R
H+
H
Cl
H C R
H
È UNA SN2
ClR
R
R
+
Cl
+
R
+
Cl
CON UN ALCOL TERZIARIO LA REAZIONE CON HCl DECORRE
SECONDO UN MECCANISMO SN1
R1
+
R3 R2
+
R1
R1
+
R3
R2
+
+
R3
R2
R1
R1
Cl-
Cl
R2 R3
R3
R2
Cl
L’alcole terziario viene protonato dall’acido
L’alcole terziario protonato perde una molecola di acqua
formando un carbocatione terziario
che può essere attaccato dallo ione cloruro da un lato o dall’altro rispetto al piano di
ibridazione
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
Quando una SN1e quando una SN2?
La SN1 è favorita da quei reagenti che portano alla
formazione di carbocationi più stabili (terziario, a volte
secondario) e dalla presenza di solventi molto polari
capaci di stabilizzare i carbocationi.
La SN2 è favorita da quei reagenti che portano alla
formazione di carbocationi meno stabili (primario) e
dalla presenza di solventi poco polari che non solvatano
efficientemente.
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
REAZIONI DI E-ELIMINAZIONE
Quando si fa reagire con una base forte un alogenuro alchilico
che abbia idrogeni in Esi ottiene una reazione di eliminazione
che porta alla formazione di un alchene
Si possono scrivere due equazioni generali per la reazione:
H in E
Atomo di idrogeno
legato al carbonio
adiacente a quello che
porta l’alogeno
OPPURE
Scaricato da Sunhope.it
O H
H C H
Cr2O7--
O
(H+)
Cr+++
H C H
C
H
H C H
H
H
etanolo
etanale
OSSIDAZIONE
Corso di Chimica e Propedeutica Biochimica
CH3
MnO4-
H C OH
CH3
2-propanolo
Proff. M. De Rosa / C. Schiraldi
(H+)
Mn++
H3C
C O
H3C
propanone
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
CH3COOH
CH3OH
H+
CH3COOCH3
H2O
FENOLI
9Anche i fenoli, come gli alcoli, formano legami a
idrogeno intermolecolari e, quindi, hanno punti di
ebollizione elevati.
9La formazione dei ponti idrogeno fra l’ossidrile e
l’acqua rende i fenoli moderatamente solubili,
nonostante la presenza dell’anello benzenico
altamente idrofobo.
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
ACIDITA’ DEL FENOLO
I fenoli sono acidi più forti
degli alcoli
O
Stabilizzazione per risonanza dello ione
fenossido rispetto allo ione alcossido
Strutture di
Kekulè
equivalenti
O
H
O H
pKa 10.0
H
H O
O
H
H
O
Queste 3 strutture limite
delocalizzano la carica negativa
sugli atomi di carbonio dell’anello
O
Corso di Chimica e Propedeutica Biochimica
2 CH3OH
2
2 Na
2 Na
O
Proff. M. De Rosa / C. Schiraldi
2 CH3O Na
2
H2
H2
O
O
H
Na
Sia gli alcoli che i fenoli reagiscono con i metalli
alcalini dando, rispettivamente, alcolati e fenati.
Sono reazioni redox
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
H
H
C
H
H
H
O
O
H
Na
H
C
H
O
H
O
H
Na
Gli alcoli non reagiscono con gli idrossidi dei metalli
alcalini (l’equilibrio è completamente spostato a sinistra),
mentre i fenoli si convertono quantitativamente in fenati
H
H
O
O
Na
O
O
H
Na
H
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
ETERI
Gruppo funzionale R-O-R
gruppo etereo
¾L’atomo di ossigeno è legato a due residui organici, con
carboni ibridati sp3 o sp2.
¾I residui possono essere alchilici, vinilici o arilici.
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
Nomenclatura degli ETERI
Secondo le regole IUPAC, gli eteri sono individuati con il
nome dell’idrocarburo a catena più lunga i cui idrogeni
sono sostituiti dal gruppo –O-R, detto gruppo
alcossido.
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
Gli eteri devono essere considerati basi di Lewis: in ambien
te acquoso acido sono facilmente protonati ed idrolizzati
RH
C
H
H+
RH
C
C H
H
R
C H
H
R
RH
C
H
H O
C H
H
R
protonazione
H O
O
RH
C
H
O
H2O
H
H
H
H O
C H
H
R
H+
RH
C
H
O
H
idrolisi
Scaricato da Sunhope.it
Gli eterocicli hanno nomi commerciali che
sono quelli che si usano comunemente
TIOLI
9I tioli sono composti organici solforati con formula R-S-H
9La nomenclatura IUPAC dei tioli è uguale a quella degli alcoli,
ma il suffisso è –tiolo.
9Sono comunemente denominati mercaptani
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
TIOLI
Proprietà chimico-fisiche
Il gruppo –SH è solo debolmente polare e, pertanto, i
legami a idrogeno sono molto più deboli di quelli presenti
negli alcoli.
I tioli hanno punti di ebollizione più bassi
rispetto ai corrispondenti alcoli.
Per esempio: l’etanolo bolle a 78,5 °C mentre l’etantiolo
bolle a 35°C.
Sono acidi più forti dei corrispondenti alcoli.
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
TIOLI
Reattività
I tioli sono facilmente ossidabili a disolfuri anche in
presenza di blandi ossidanti come I2, O2 e H2O2 :
CH3
SH
CH3
-2H
SH
+2H
CH3
Metilmercaptano
S
dimetilsolfuro
S
CH3
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
TIOLI
Reattività
Per azione di ossidanti energici come HNO3 in forte
eccesso, i tioli sono convertiti in acidi solfonici:
O
O
x o R S OH
R SH
TIOLO
O
Acido solfonico
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
TIOLI: REAZIONI
¾La presenza dello S invece che dell’O nel gruppo SH
conferisce ai mercaptani caratteristiche nucleofile più forti di
quelle dei corrispondenti alcoli.
¾I tioli si addizionano ad aldeidi e chetoni formando tioacetali
e tiochetali.
¾Con gli alogenuri alchilici, i mercaptani formano i tioeteri
H
R1
R S : ..
Tiolo
R2
H ..
o R S C R2
-
C
R3
R1
X
Alogenuro alchilico
-X
..
R3
TIOETERE
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
TIOETERI
I tioeteri vengono denominati come se fossero sali del
solfuro di diidrogeno.
C H 3S C H 3
CH3
dimetil solfuro
CH2
CH2
S
H
H3C C CH3
S
H
CH3
ciclopentil metil solfuro
1-propil 2-propil -solfuro
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
TIOETERI
Sono basi più forti degli eteri, per la maggiore
disponibilità dei doppietti elettronici non condivisi presenti
sull’atomo di zolfo, che è meno elettronegativo
dell’ossigeno.
Si addizionano a composti come il clorometano,
cloroetano etc., formando composti ionici detti sali di
solfonio
CH 3
ª
º
«
»
«
»
o «CH 3 S CH 3 » Cl CH 3 S CH 3 CH 3 : Cl
«
»
clorometano
Dimetiltioetere +
«
»
¬
¼
Cloruro di trimetilsolfonio
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa / C. Schiraldi
TIOETERI
In presenza di ossidanti sono convertiti dapprima in
solfossidi e, per trattamento più energico, in solfoni.
O
O
O
O
x
x o CH S CH
CH 3 S CH 3 o CH 3 S CH 3
3
3
O
DIMETILTIOETERE
DIMETILSOLFOSSIDO
Corso di Chimica e Propedeutica Biochimica
DIMETILSOLFONE
Proff. M. De Rosa / C. Schiraldi
Scaricato da Sunhope.it