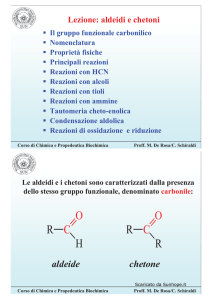
Cinetica Chimica
CH3Cl + NaOH
CH
C 3OH + NaCl
Le reazioni chimiche possono decorrere
con cinetica molto veloce (come le
reazioni di salificazione
s
di un acido con
una base)
baseee)) o lenta (come alcune reazioni
di sostituzione nucleofila).
HCl + NaOH
Corso di Chimica e Propedeutica Biochimica
NaCl + H2O
Proff. M. De Rosa/C. Schiraldi
Cinetica chimica
• La termodinamica consente di valutare se un
processo è spontaneo ma non fornisce
informazioni sulla velocità del processo di
trasformazione chimica
• La branca che si occupa di studiare la velocità
delle reazioni chimiche si chiama:
– CINETICA CHIMICA
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
Velocità di reazione
• Quali fattori la influenzano?
• Affinchè fra due molecole abbia luogo una reazione,
queste devono collidere e la probabilità che questa
collisione avvenga è direttamente proporzionale alla
concentrazione
• In effetti, se ad ogni collisione corrispondesse una
combinazione allora quasi tutte le reazioni sarebbero
estremamente veloci
• Solo una piccolissima frazione delle collisioni è efficace
• L’aumento della temperatura, influenzando l’energia
cinetica delle particelle, aumenta il numero di collisioni
efficaci
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
Velocità di reazione
• La velocità di un’automobile è data dallo spazio
percorso dalla stessa nell’unità di tempo
velocità della reazione
distanza percorsa
tempo necessario
• La velocità di una reazione chimica è definita
come la variazione della concentrazione di un
reagente (o prodotto) in un dato intervallo di
tempo
velocità di reazione
variazione della concentrazione
tempo necessario per la variazion e
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
Si definisce velocità della reazione
A+B
C+D
l'aumento della concentrazione dei prodotti o la
diminuzione della concentrazione dei reagenti
nell'unità di tempo
V=-
d [A]
dt
= -
d [B]
dt
Corso di Chimica e Propedeutica Biochimica
=
d [C]
[ ]
dt
=
d [D]
[ ]
dt
Proff. M. De Rosa/C. Schiraldi
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
D
A
+ B
C
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
A temperatura costante,
la velocità della reazione è
proporzionale alla
concentrazione
dei reagenti
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
D
A
B
C
Considerando che perché la reazione avvenga
occorre che A e B entrino in collisione,
risulta ovvio che quanto maggiori sono le
concentrazioni di A e di B tanto maggiore è la
probabilità che A e B collidano
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
L’ordine di una reazione viene determinato sperimentalmente:
una reazione viene definita di 1° ordine se la sua velocità risulta
sperimentalmente essere funzione lineare della concentrazione di un
solo reagente.
Per esempio, la seguente reazione:
2N2O5
2N2O4 + O2
è di 1° ordine perché sperimentalmente si
trova che :
V = k [N2O5]
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
L’ordine di una reazione viene determinato sperimentalmente:
una reazione viene definita di 2° ordine se la sua velocità risulta
sperimentalmente essere funzione lineare della concentrazione di un
solo reagente elevata al quadrato o al prodotto delle concentrazioni
di due reagenti.
Nel caso specifico:
la reazione è di secondo ordine se l’equazione cinetica
derivata sperimentalmente è:
V = k [A]2
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
Per esempio, la reazione seguente :
2
+ H2
2 C5H6
C10H10
è di 2° ordine perché sperimentalmente si trova che
V = k [C5H6]2
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
H2 + I2
2HI
V = k [H2] [I2]
La reazione è di 2° ordine perché la somma degli
esponenti che compaiono nell’equazione cinetica
è uguale a 2
Corso di Chimica e Propedeutica Biochimica
2NO + Cl2
Proff. M. De Rosa/C. Schiraldi
2NOCl
V = k [NO]2 · [Cl2]1
La reazione è di 3° ordine perché è uguale a 3 la
somma degli esponenti che compaiono nella
equazione cinetica
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
• Nelle espressioni descritte per le velocità
delle reazioni prese in considerazione si
moltiplicano le concentrazioni per il termine
k che rappresenta la costante cinetica della
reazione ed è funzione della temperatura
COSTANTE CINETICA
V = k [NO]2 · [Cl2]1
Corso di Chimica e Propedeutica Biochimica
k
Proff. M. De Rosa/C. Schiraldi
L’equazione di Arrhenius descrive la relazione fra
la costante di velocità di una reazione, l’energia di
attivazione della stessa reazione e la temperatura :
k=A· e
Ea
- RT
Equazione di Arrhenius espressa in ...
..
forma
logaritmica
T
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
ln k = ln A -
Ea
RT
ln k
Equazione di Arrh
Arrhenius
h
nella forma logaritmica
logarr
La pende
pendenza
n della
retta
ret
rett
tt è
- Ea/R
1/T
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
Aumentando la temperatura,
la costante di velocità della
reazione aumenta
esponenzialmente
k=A·
Ea
e RRT
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
Anche questo dato sperimentale è compatibile con
la teoria delle collisioni, essendo ovvio che la
frequenza con cui si verificano le collisioni aumenta
con l’energia cinetica media delle particelle, che è,
a sua volta, funzione della temperatura:
EM = 1/2 mv2 = 3/2 RT
T1
T2
T2 > T1
Corso di Chimica e Propedeutica Biochimica
Inoltre, innalzando la
temperatura aumenta anche
l'efficacia degli urti in quanto
l’energia scambiata
nelle collisioni è tanto maggiore
quanto maggiore
è l’energia cinetica delle
particelle
Proff. M. De Rosa/C. Schiraldi
B
A
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
NE=N · e-E/RT
T1
n°
E
T2
Se si considera che, aumentando
la temperatura, aumenta
esponenzialmente il numero di
particelle che hanno energia
cinetica uguale o superiore ad un
valore definito, ...
T3
T1 < T2 < T3
ENERGIA CINETICA
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
…è evidente perché la relazione che esiste
fra la costante di velocità di una reazione
e la temperatura è:
k=A·
Ea
e RRT
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
Che si intende in
cinetica chimica
con il termine
complesso attivato ?
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
Se la reazione A + B
C + D comporta la collisione
fra una molecola di A e una molecola di B, come fase
lenta del processo ...
C
Ea
A
D
B
A-B
risultano efficaci soltanto le collisioni nelle quali viene
scambiata un’energia uguale o superiore ad un valore
limite : l’energia di attivazione Ea della reazione.
Si chiama complesso attivato l’intermedio ad alta
energia indicato con A-B
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
È sufficiente che la collisione fra
A e B avvenga con energia
uguale o superiore a quella necessaria
perché si formi il
complesso attivato ?
La direzionalità
dell’urto è
fondamentale per
l’avvenire
della reazione
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
Catalizzatori
• Un catalizzatore è una sostanza che aumenta la
velocità di una reazione chimica senza essere
consumata nella reazione stessa
• Un catalizzatore non può influenzare la posizione
di equilibrio di una reazione ma aumenta la
velocità con la quale si raggiunge l’equilibrio.
• Il catalizzatore fornisce un cammino alternativo
che ha una energia di attivazione più bassa.
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
La funzione del catalizzatore è quella di modificare
l’energia di attivazione della reazione
E
N
E
R
G
I
A
A...B
Reazione non catalizzata
*
EA
Reazione catalizzata
EA
'E
A+B
C+D
coordinata di reazione
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
Catalisi omogenea:
• Se il catalizzatore e i reagenti sono nella stessa fase
(liquida, gassosa) la CATALISI SI DICE OMOGENEA.
• Esempio decomposizione dell’ozono catalizzata da
monossido di carbonio.
NO O3
o NO2 O2
NO2 O
o NO O2
la reazione globale è
O3 O
o 2O2
la velocità di questa reazione è aumentata da NO,
che viene consumato nel primo stadio e rigenerato nel secondo.
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
Catalisi eterogenea:
• Se il catalizzatore è in una fase diversa da quella
dei reagenti si parla di CATALISI
ETEROGENEA
• Spesso il catalizzatore è solido e i reagenti sono
gassosi e lo stadio che limita la velocità si svolge
sulla superficie del catalizzatore.
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
Esempi di catalisi eterogenea
• Le reazioni di idrogenazione di idrocarburi
alifatici ed aromatici sono spesso condotte
dall’utilizzo di catalizzatori al nichel e/o platino.
• Tali reazioni sono un esempio di catalisi
eterogenea , infatti i catalizzatori sono utilizzati
sotto forma di polveri con un alto rapporto
superficie/volume.
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
I catalizzatori biologici: gli enzimi
• Nelle cellule avvengono abitualmente reazioni chimiche
che “in vitro” richiederebbero l’utilizzo di condizioni
drastiche (T,p)
• Gli efficienti catalizzatori di tali reazioni sono molecole
proteiche chiamate enzimi
• Gli enzimi hanno un alto potere catalitico e sono specifici
• La catalisi enzimatica è omogenea perché substrato,
enzima e prodotti sono tutti in soluzione acquosa
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
• Consideriamo la reazione di idrolisi del saccarosio
(disaccaride)
glucosio+fruttosio
• Saccarosio + H2O
• Velocità = k [saccarosio][H2O]
• L’acqua è il solvente, non subisce variazioni nel
progredire della reazione e quindi si trova una
cinetica del primo ordine nel saccarosio:
• Velocità = k’ [saccarosio]
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
• Per basse concentrazioni di substrato la
velocità è direttamente proporzionale alla
concentrazione del saccarosio, mentre a più
alte concentrazioni non mostra tale
dipendenza e raggiunge un valore limite
(Vmax) indipendente dalla concentrazione
del substrato
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
Grafico tipico per una cinetica
enzimatica.
Vmax
[concentrazione di substrato]
•In presenza dell’enzima, i dati cinetici consentono
la costruzione di una curva
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C. Schiraldi
Scaricato da Sunhope.it