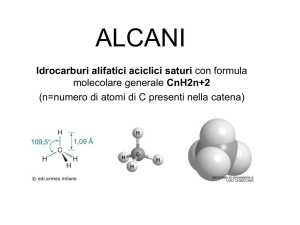
Idrocarburi Saturi
Reazioni
Fonti ed usi
• Gli alcani lineari, ramificati e ciclici si
ottengono principalmente dalla lavorazione
(frazionamento, cracking, etc.), del
petrolio.
Fonti ed usi
• Gli alcani, soprattutto i più leggeri, vengono
largamente impiegati come carburanti per via
dell'elevata entalpia di combustione per unità di
massa, della notevole inerzia chimica e
dell'abbondante, ma non illimitata, disponibilità
sulla Terra.
• Un esempio comune di miscela complessa di alcani
è la benzina,
benzina che è costituita da diversi alcani
contenenti generalmente 7-8-9 atomi di carbonio,
ottenuta soprattutto dalla distillazione frazionata
del petrolio, ma anche dal cracking catalitico.
Proprietà chimiche
• Gli alcani sono anche noti come paraffine (dal
latino parum affinis) a causa della loro scarsa
reattività in condizioni normali. La loro grande
stabilità è dovuta ai legami covalenti puri della
catena di carbonio, nei quali la coppia di elettroni
che costituisce il legame σ è rigidamente
localizzata e condivisa tra due atomi.
• I legami C—H sono solo leggermente polarizzati, in
quanto la differenza di elettronegatività tra C—H
è molto bassa; inoltre, la disposizione simmetrica
degli atomi di idrogeno intorno a ogni atomo di
carbonio, ne annulla gli effetti e la molecola
risulta essere stabile.
Proprietà chimiche
• In condizioni standard, gli alcani non danno alcuna
reazione né con gli acidi, né con le basi, né con gli
agenti ossidanti; reagiscono solo a temperatura
molto elevata o sotto l’azione di raggi ultravioletti
che forniscono energia sufficiente per rompere i
legami.
• Infatti, in particolari condizioni o in presenza di
catalizzatori, gli alcani possono dare tre tipi di
reazioni: la combustione, la sostituzione
radicalica e il cracking.
cracking
Combustione o ossidazione
• Gli alcani vengono utilizzati come combustibili e
questa è la loro applicazione più importante.
• Essi bruciano con un eccesso di ossigeno formando
anidride carbonica ed acqua.
• La reazione libera grandi quantità di calore, ma
deve essere innescata.
CH4 + 2 O2 → CO2 + 2 H2O + calore
C4H10 + 13/2 O2 → 4 CO2 + 5 H2O + calore
Combustione o ossidazione
• La reazione è una reazione di ossidazione in
quanto atomi di idrogeno vengono sostituiti con
atomi di ossigeno.
• L’atomo di carbonio passa da un numero di
ossidazione -3(CH3), -2(CH2), -1(CH), 0(C) al
numero di ossidazione +4(CO2).
• La combustione incompleta (difetto di ossigeno)
porta alla formazione di ossido di carbonio o di
prodotti parzialmente ossidati come aldeidi(+1),
chetoni(+2), acidi carbossilici(+3).
2 CH4 + 3 O2 →
2 CO + 4 H2O + calore
2 C2H6 + 3 O2 → 2 CH3COOH + 2 H2O + calore
Alogenazione degli alcani
• La reazione di alogenazione degli alcani è
una reazione che porta alla sostituzione di
un atomo di idrogeno dell’alcano con un
atomo di alogeno.
• Essa avviene solo in condizioni abbastanza
drastiche, in presenza di calore o di luce.
• Procede con un meccanismo radicalico in
quanto il legame che si deve rompere (C-H)
è poco polarizzato e quindi si rompe
preferenzialmente in maniera omolitica.
R-H + X2 → R-Cl + H-X
Alogenazione degli alcani
R-H + X2 → R-Cl + H-X
• Sostituzione radicalica a catena
• Iniziazione
• Propagazione
• Terminazione
Clorurazione del metano
CH4 + Cl2 → CH3Cl + HCl
Cl2
hν o Δ
Cl + H CH3
Cl
CH3 + Cl2
Cl +
2 Cl Cl
H + CH3
CH3 + CH3
propagazione
CH3 + Cl Cl CH3 + Cl iniziazione
Cl2
Cl
CH3
H3C CH3
terminazione
Iniziazione
• Per azione della luce (fotolisi)
fotolisi o del calore
(termolisi)
termolisi si ha la rottura omolitica del
legame contenuto nella molecola di cloro (o
di bromo) per formare due atomi di cloro
che sono due radicali.
hν o Δ
Cl
Cl
2 Cl
Propagazione
• L'atomo di cloro così formato, tende a
stabilizzarsi e strappa un atomo di idrogeno da una
molecola di alcano.
Cl• + H• •CH3
H • •Cl + CH3•
• Si forma così un nuovo radicale (metil radicale) che
può reagire nuovamente con una molecola non
radicalica per formare un nuovo radicale.
Propagazione
• Il metil radicale strappa un atomo di cloro
da un’altra molecola di cloro, formando il
prodotto di sostituzione (clorometano) e
rigenerando un atomo di cloro, che può
continuare la catena radicalica.
Cl . .Cl
+
. CH3
Cl . + Cl . . CH3
Stadio di propagazione
Cl
+ H CH3
. CH3
+ Cl
Cl
Cl
H +
. CH3
CH3 Cl + Cl
Lo stadio di propagazione consiste quindi in due
successive reazioni di estrazione radicalica che
propagano la catena.
Bastano poche reazioni di iniziazione per
trasformare tutto il reagente in prodotto
Propagazione
• Man mano che si consuma
il reagente, diventa più
probabile che l'atomo di
cloro incontri anche delle
molecole
di
prodotto
(clorometano).
• Si può avere quindi
l'estrazione di un atomo
di
idrogeno
da
una
molecola di prodotto per
formare
un
alcano
policlorurato.
Cl + H CH2Cl
CH2Cl + Cl2
Cl + H CHCl2
CHCl2 + Cl2
+ Cl2
CH2Cl + Cl Cl
H + CHCl2
Cl
Cl
Cl + H CCl3
CCl3
H + CH2Cl
Cl
CHCl2 + Cl Cl
Cl
H + CCl3
CCl3
+ Cl Terminazione
• La terminazione della reazione avviene
quando diminuisce la concentrazione del
substrato reattivo e aumenta la probabilità
che due radicali si incontrino per formare
un composto non radicalico.
Cl +
Cl CH3 + Cl CH3 + CH3
Cl2
Cl
CH3
H3C CH3
Cracking
• Il cracking è un processo attraverso il quale si
ottengono idrocarburi paraffinici leggeri per
rottura delle molecole di idrocarburi paraffinici
pesanti.
• È pertanto un processo adottato per la produzione
di idrocarburi leggeri, quali le benzine, a partire
dal petrolio greggio.
• La reazione di cracking si ottiene per via catalitica
o termica (steam cracking) e il risultato della
reazione dipende fortemente dalle condizioni in
cui la reazione avviene e dalla presenza o meno di
catalizzatori.
Cracking
• Il meccanismo si basa
su reazioni di scissione
omolitica a catena.
catena
• I radicali che si
formano subiscono
rapidi processi di
riarrangiamento,
trasposizione, scissione
in posizione β e
trasferimenti intra- e
inter-molecolari di
atomi di idrogeno.
Reazioni
R-R →
R• + H-CH2-CH2-R
R• + R•
→
R-H + •CH2-CH3-R
R-CH2-CH2• → R• + CH2=CH2
R
R
+
R
C
C
H H
R
R
C
C
H H
R