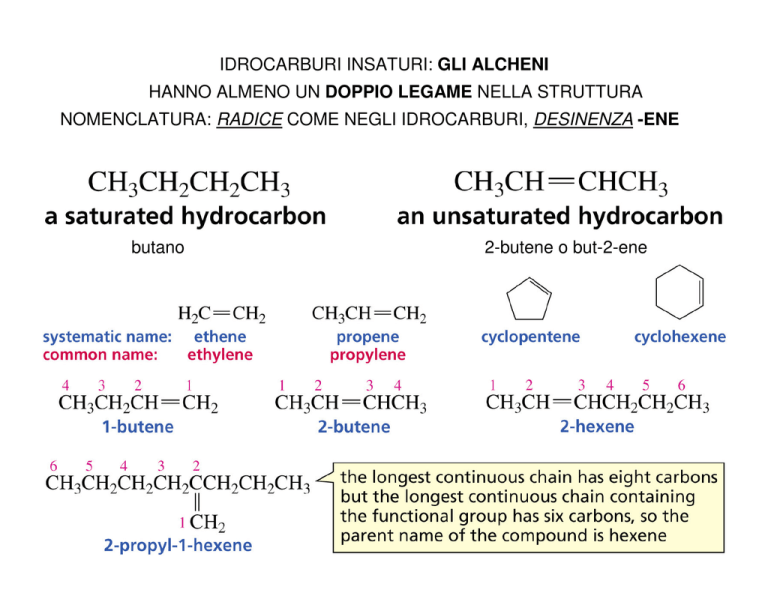
IDROCARBURI INSATURI: GLI ALCHENI
HANNO ALMENO UN DOPPIO LEGAME NELLA STRUTTURA
NOMENCLATURA: RADICE COME NEGLI IDROCARBURI, DESINENZA -ENE
butano
2-butene o but-2-ene
Esempi di nomenclatura degli alcheni
Esempi di nomenclatura degli alcheni
(2,5-dimetil-4-ottene)
Negli idrocarburi ciclici la numerazione degli atomi di C del doppio legame è
sempre prioritaria (NB: in seguito si dovrà considerare la priorità dei gruppi funzionali)
1
(3-etilciclopentene)
2
3
NB. Gli alogeni hanno priorità inferiore rispetto ai doppi legami
Gruppo vinilico
Gruppo allilico
Assegnare il nome a questi due alcheni
a) Individuare la catena + lunga di atomi di carbonio che contenga il doppio legame
b) Numerare gli atomi in modo che il doppio
legame o i sostituenti abbiano il valore più basso
2-cloro-3,4-dimetil-3-esene
1-bromo-4-metil-3-esene
sp2
Planarità degli alcheni
sp3
NB. Gli isomeri cis/trans sono molecole diverse tra loro. L’interconversione
può avvenire solo in seguito a rottura del legame π con il calore o radiazioni UV
Meccanismo della visione (pag 109 testo)
Isomeria cis / trans (Z / E) degli alcheni
Z = cis
E = trans
La regola di priorità degli atomi (o gruppi di atomi) segue l’ordine dei pesi
atomici, cioè ad un PA maggiore corrisponde una priorità alta
Isomeri cis / trans (Z / E) degli alcheni
Reazioni degli alcheni: addizione elettrofila al doppio legame
Gli alcheni hanno i due elettroni, che formano il legame π, sufficientemente reattivi per
reagire come “nucleofili” (Nu-) o base di Lewis (composti con almeno una coppia di
elettroni disponibile che può essere ceduta) con specie povere di elettroni (acidi di
Lewis) dette anche “elettrofili” (E+).
Addizione di acidi alogenidrici (HX): da alchene ad alogenuro alchilico
NB. Alla reattività di un gruppo funzionale corrisponde la preparazione di un altro
gruppo funzionale
MECCANISMO DELL’ADDIZIONE DI UN ACIDO ALOGENIDRICO
AL 2-BUTENE. (NB. l’isomeria E/Z non è indicata)
a) Formazione del legame C-H e
formazione dello ione bromuro
b) Il carbonio che ha perso gli elettroni
rimane carico positivamente: formazione
del carbocatione
c) Il carbocatione forma il legame con gli elettroni del bromo
Profilo energetico della reazione di addizione di HX ad un doppio legame
Entalpia di una
reazione
Intermedio
carbocationico
Entalpia di una reazione: Σ energia dei legami rotti – Σ energia dei legami formati
(spontanea)
(catalisi acida)
(spontanea)
(spontanea)
(addotto intermedio)
(catalisi metallica)
+ RCOOOH
Epossidazione
O
+ O3
O
+
O
Ozonolisi
Addizione di acqua ad un alchene catalizzata da acidi
CH 3 -CH
ALCHENE
ALCOL
+
H3O
+
CH 3 -CH-CH-CH 3
CH-CH 3 +
+
..
H 2O
H
+
OH 2
CH 3 -CH-CH-CH 3
H
H
H
O
+
CH 3 -CH-CH-CH 3
H
..
H 2O
OH
CH 3 -CH-CH-CH 3
H
Regola di Markovnikov: formazione del carbocatione più stabile, cioè
quello con il maggior numero di gruppi alchilici
+
H 3 O+
Regola di Markovnikov dei carbocationi
CH3
CH3
C
+
CH CH3
+ H2O
CH3
CH3
H
A
CH3
C
CH CH3
OH H
carbocatione terziario
favorito per l'effetto
induttivo stabilizzante
dei tre gruppi alchilici
2-metil-2-butanolo
+
C
CH CH3 + H
2
3
2-metil-2-butene
CH3
B
CH3
CH3
C
+ HO
2
CH CH3
+
H
carbocatione secondario
meno favorito (N.B.)
N.B. carbocatione III° > carbocatione II° > carbocatione I°
CH3
CH3
C
CH CH3
H
OH
3-metil-2-butanolo
prodotto minoritario
Geometria e Stabilizzazione dei Carbocationi
NB. Il carbocatione è un intermedio planare
Idroborazione ossidativa: da alchene ad alcol anti-Markovnikov
CH3
CH3 H
CH3-C
CH-CH3
+
BH3
CH3
C
C
H
BH2
CH3
CH3
CH3 H
CH3
2 CH3-C
C
C
H
BH2
CH3
CH3 H
CH-CH3
CH3
monoalchilborano
C
C
H
B C5H11
CH3
H2O2/OH
-
C5H11
trialchilborano
CH3 OH
3
CH3
C
H
CH
CH3
Si ottiene l’alcol secondario invece
dell’alcol terziario
Addizione di bromo (Br2) ad un doppio legame: da alchene a dibromo
alcano. NB. la stessa reazione avviene con Cl2
a)Formazione dello ione bromonio.
Il primo atomo di Bromo può
attaccare sopra o sotto il piano
dell’alchene
b) Attacco del Brsullo ione bromonio
dalla parte non ingombrata
Reazione di epossidazione: da alchene ad epossido
O
O
H3C
CH3
H
OH
O
+
H3C
H
cis-2-butene
Cl
H
H3C
H
peracido
(MCPBA)
H
+
O
O
H3C
H
trans-2-butene
H3C
H
CH3
+ MCPBA
H
CH3
H
+
H3C
H
H
O
CH3
CH3
CH3
H
IDROGENAZIONE CATALITICA: da alchene ad alcano
Catalizzatori: Pt, Pd, Rh generalmente finemente dispersi su carbone
Me
+
Es.
Me
1,2-dimetilciclopentene
H2
Pd / C
Me
H
H
Me
Me
+
1,2-dimetilciclopentano
H
H
Me
Ossidazione degli alcheni a dioli (rottura del solo legame π)
O
O
+
O
OH
O
OH
Os
Os
O
O
NaHSO3
O
O
Tetrossido di osmio
Osmiato ciclico
1,2-ciclopentandiolo
(Lo stesso prodotto può essere ottenuto con KMnO4 in condizioni blande (a freddo))
Demolizione ossidativa del doppio legame: formazione di aldeidi o
acidi carbossilici
CHO
O
O
a
CHO
O
+ Ozono (O3)
Zn / HCl
b
La rottura ossidativa di un doppio
legame può essere ottenuta anche
con ossidanti minerali forti (Es. KMnO4)
c
O
O
O
COOH
d
-
H2O2 / OH
COOH
Esempio di ozonolisi
H
O
+
red
H
O
propanale
+
O3
2-esanone
ox
4-metil-3-ottene
O
H
CH3-CH2-CH2-C
CH3-CH2-CH2-C
CH
O
O
HBr
Perossido/hv
O
H
H
+
acido
propionico
Bromurazione anti-Markovnokov
H
OH
CH
Br
H
hv
O
+ HBr
2
O O
O°
H
dibenzoilperossido
CH3-CH2-CH2-C
O
+ Br °
OH
H
CH
H
CH3-CH2-CH2-C
°
H
CH
Br









