La Chimica studia le trasformazioni della materia attraverso
lo studio delle reazioni chimiche.
Le reazioni più comuni, in generale, vengono suddivise in:
– reazioni di sintesi – reazioni che portano alla formazione di un
nuovo prodotto
– reazioni di precipitazione – reazioni in cui si ha un cambiamento
di fase attraverso la formazione di un solido insolubile
– reazioni acido base – reazioni che prevedono il passaggio di
protoni da un donatore ad un accettore
– reazioni di ossidazione – reazione di una sostanza direttamente
con l’ossigeno
– reazioni di ossido-riduzione – reazioni in cui si attua un
trasferimento di elettroni da un reagente all’altro
17/01/2014
1
Tutte queste reazioni che possono avvenire in tempi
estremamente diversi, che vanno dai pochi secondi (o
frazioni di secondo) a milioni di anni come nel caso di
alcune trasformazioni nucleari.
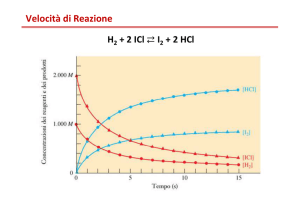
La velocità con cui si realizza una reazione rappresenta la
quantità di sostanza, normalmente espressa come
grammomolecole o come concentrazione molare, che si
trasforma nell’unità di tempo.
In genere una reazione avviene in più stadi, ognuno
dei quali prende nome di atto elementare, la sequenza
degli atti elementari che caratterizza una certa
reazione prende nome di percorso di reazione
17/01/2014
2
17/01/2014
Il più lento degli atti elementari condiziona la velocità di tutto
il processo. Se noi consideriamo una generica reazione:
A prodotti di reazione
La velocità di reazione potrebbe essere espressa come
variazione della concentrazione della sostanza A
nell’intervallo di tempo considerato:
V = c2 – c1 = c
t2 – t1
t
espressione in cui :
– c2 = concentrazione di A al tempo t2
– c1 = concentrazione di A al tempo t1
– t2 = fine del periodo di osservazione
– t1 = inizio del periodo di osservazione
– V rappresenta la velocità media nel periodo di osservazione
3
Se invece consideriamo un intervallo t molto piccolo,
tendente a zero, potremo dire che il valore di v calcolato in
queste condizioni rappresenterà la velocità istantanea della
reazione stessa ad un certo tempo t.
Considerando la estrema variabilità che si osserva nello
studio della cinetica delle reazioni, dobbiamo dire che
l’intervallo di tempo t molto piccolo può assumere valore
diverso nelle diverse reazioni, proprio in funzione dei
differenti comportamenti
In alcuni casi potrà essere il secondo, in altri casi dovrà
essere l’ora, in altri casi ancora il giorno o l’anno
La velocità di una reazione chimica è influenzata da diversi
fattori, quali la concentrazione e la natura dei reagenti e dei
prodotti, il solvente, la temperatura, la presenza di
catalizzatori, la luce o altre radiazioni, ecc.
17/01/2014
4
EFFETTI DELLA NATURA DEI REAGENTI
In condizioni sperimentali equivalenti, la velocità di
reazione è largamente influenzata dal tipo di contatto
che si realizza tra i reagenti.
In linea generale possiamo dire che una reazione in
fase omogenea (es. due liquidi) è più rapida di una
reazione in fase eterogenea (es. un liquido ed un solido)
In questo caso la velocità è direttamente influenzata
dalla superficie di contatto, vale a dire che un solido
finemente suddiviso reagisce molto più rapidamente
della stessa sostanza in un blocco unico.
17/01/2014
5
EFFETTI DELLA CONCENTRAZIONE DEI
REAGENTI
17/01/2014
Se consideriamo una generica reazione in fase
omogenea:
A + B prodotti
è sperimentalmente dimostrabile, che la velocità aumenta
all’aumento della concentrazione dei reagenti.
Questo fenomeno non sorprende poiché è ovvio che per
far avvenire la reazione, le molecole di A e di B dovranno
scontrarsi e la probabilità che questi urti avvengano è
statisticamente proporzionale al numero di molecole in un
certo spazio, ossia alla concentrazione dei reagenti.
6
L’equazione che descrive la velocità in funzione della
concentrazione dei reagenti è:
V = k [ A ] a [ B ]b
nella quale:
k = costante di velocità (o velocità specifica di reazione)
[ A ] = concentrazione molare del reagente A
[ B ] = concentrazione molare del reagente B
a e b = sono dei coefficienti sperimentali che rappresentano
l’ordine della reazione
17/01/2014
7
REAZIONI DI PRIMO ORDINE
Se consideriamo una reazione del tipo:
A B + C
la stechiometria della reazione ci dice che per la
formazione di una molecola di B o di C, si consuma
una molecola di A.
La velocità della reazione, quindi, può essere definita
dalla velocità di scomparsa di A o dalla velocità di
formazione di B o di C, per cui potremo avere:
V = - d[ A ] = d[ B ] = d[ C ]
dt
dt
dt
17/01/2014
8
il segno meno precede la concentrazione di A, poiché
questa diminuisce nel tempo.
Questo tipo di reazione, viene indicata come reazione
di primo ordine poiché la velocità è proporzionale alla
concentrazione di un solo reagente, elevato alla prima
potenza.
L’equazione che descrive la velocità in funzione della
concentrazione diviene:
V = ― d[ A ] = k1 [ A ]
dt
17/01/2014
9
REAZIONI DI SECONDO ORDINE
Se consideriamo invece una reazione del tipo:
A + B C
oppure del tipo
2A C
l’ equazione di velocità diviene:
nel primo caso:
nel secondo caso: V = k2 [ A ]2
in ambedue i casi si tratta di equazioni di velocità di reazioni
di secondo ordine, in quanto la velocità è proporzionale al
prodotto della concentrazione di due reagenti ognuno
elevato alla prima potenza (primo caso) o al quadrato della
concentrazione di un reagente (secondo caso).
17/01/2014
V = k2 [ A ] [ B ]
10
REAZIONI DI ORDINE ZERO
Questo tipo è rappresentato dalle reazioni che hanno
velocità costante al variare della concentrazione dei
reagenti, la equazione di velocità diviene:
V = k3 [ A ]0 [ B ]0
cinetica di questo tipo è possibile nel caso di una
reazione che avvenga alla superficie di un solido, oppure
nel caso di una reazione catalizzata o di una reazione
enzimatica che sia giunta alla velocità di saturazione.
17/01/2014
da cui
V = k
11
Si parla, in questo caso di reazioni di ordine zero, ossia
di reazioni che non dipendono dalla concentrazione del
reagente ma da un fattore esterno alla reazione stessa
(superficie di contatto, catalizzatore, enzima, ….) perché
come appare dalla equazione prima riportata, il valore
[ A ]0 [ B ] 0
si comporta come una costante, da cui anche la velocità
rimane costante, ma risente solo di fattori esterni
17/01/2014
12
a) V= K
Vo
b) V= K [A] [B]
b) V= K [A]
Vo
Vo
[A]
[A]
[A]
Andamento della velocità di reazione nei tre casi descritti:
A = reazioni di ordine zero
B = reazioni di primo ordine
C = reazioni di secondo ordine
17/01/2014
13
REAZIONI DI PSEUDO-PRIMO ORDINE
In alcuni casi si parla di reazioni di pseudo-primo ordine,
ossia di reazioni di secondo ordine ma che,
apparentemente, si comportano come le reazioni di primo
ordine
Se prendiamo in considerazione una reazione del tipo:
A + B C
è chiaro che ci dovremmo aspettare un comportamento
come quello descritto nelle pagine precedenti
17/01/2014
14
17/01/2014
Se ammettiamo che uno dei due reagenti (es. A) abbia
una concentrazione molto maggiore di B, (intendendo 100,
500, 1000 volte maggiore) la velocità di una reazione di
questo tipo sarà condizionata dalla presenza e dalla
concentrazione di B, comportandosi A come una costante.
In altre parole, se ammettiamo di avere 1000 molecole di
A e una sola di B, la reazione potrà proseguire e formare
C solo fino a che B è presente.
Nel momento in cui si ha esaurimento di B la reazione
cessa.
Esempio classico di questo tipo sono le reazioni di idrolisi
che avvengono in vivo, ossia quelle reazioni in cui uno dei
reagenti è l’acqua, che ha sempre concentrazioni molto
maggiori di qualsiasi altro substrato.
15
EFFETTO DELLA TEMPERATURA
L’aumento di temperatura determina sempre un aumento della
velocità di reazione, salvo rare eccezioni.
In media un aumento di 10 gradi di temperatura determina il
raddoppio della velocità di reazione.
Questo effetto viene spiegato dalla teoria delle collisioni,
secondo la quale per far avvenire una reazione è necessario
che le particelle dei reagenti (atomi, molecole, ioni) si urtino tra
di loro.
La probabilità che una molecola di A urti una molecola di B
dipende sia dal numero delle particelle presenti nell’ambiente
di reazione, sia dalla velocità media con cui si muovono,
velocità media che a sua volta dipende dalla temperatura.
17/01/2014
16
17/01/2014
E’ altresì vero che non tutti gli urti che si realizzano tra le
molecole dei reagenti sono efficaci, solamente una
frazione di quelli che si realizzano possono provocare la
rottura e/o la formazione di legami
Questo significa che le particelle dei reagenti (siano atomi,
molecole o altro) devono possedere una energia che sia
pari o superiore ad un valore soglia che rappresenta la
energia di attivazione Ea, che :
– dipende dal tipo di reazione considerata
– è una caratteristica della reazione stessa
– può assumere valori estremamente diversi a seconda
della trasformazione.
17
Somministrando calore
– aumenta la temperatura del sistema di reazione
– aumenta la energia cinetica media delle singole particelle
– aumenta il numero di particelle che possiedono una energia
uguale o superiore alla energia di attivazione, così che
proporzionalmente aumenta il numero di urti efficaci
Questo è facilmente dimostrabile, infatti se si riportano su
grafico:
in ascissa la energia cinetica media delle molecole
in ordinata la frazione delle molecole che possiede Ec Ea
a due temperature diverse, T e T+10, avremo:
17/01/2014
18
La regione tratteggiata ci indica che per un aumento della T di
10°C, il numero di molecole che superano il valore soglia di Ea è
circa raddoppiato e questo spiega la constatazione empirica che
per un generico aumento di 10°C di Temperatura, la velocità
raddoppia
17/01/2014
19
Arrhenius nel 1889 dette una spiegazione razionale di questo
fenomeno tramite l’equazione:
k = A e -Ea/RT
in cui
17/01/2014
K - rappresenta la costante di velocità di una reazione,
A - è un fattore sperimentale, detto fattore di frequenza, proporzionale
al numero degli urti e costante per un certo processo
e - è la base dei logaritmi naturali
R - è la costante universale dei gas
T - è la temperatura assoluta
Ea - è la energia di attivazione
In questa espressione aumentando il valore di T, diminuisce
il valore dell’esponente negativo della potenza e, di
conseguenza, aumenta il valore di k
20
Ma K appare nelle equazioni di velocità
V = k1 [ A ]
reazione di primo ordine
V = k2 [ A ] [ B ]
reazioni di secondo ordine
V = k 2 [ A ]2
V = k
reazione di ordine zero
per cui aumentando il valore di K aumenta il valore di v
17/01/2014
21
L’equazione di Arrhenius:
k = A e -Ea/RT
viene usualmente modificata tenendo conto che nelle
reazioni entra in gioco anche un fattore riguardante la
geometria molecolare
Infatti non tutte le molecole che possiedono energia
cinetica superiore alla energia di attivazione,
urtandosi, sono in grado di reagire, poiché per reagire
devono incontrarsi secondo orientamenti favorevoli
alla reazione stessa
17/01/2014
22
L’equazione di Arrhenius, pertanto, viene così
modificata:
k = P Z e -Ea/RT
Z - rappresenta il numero di urti che avvengono
nell’unità di tempo e dipende dalla radice quadrata
della temperatura
P - è un coefficiente probabilistico che può assumere
valori anche molto piccoli, fino a 10-8 per reazioni che
coinvolgono molecole molto complesse
17/01/2014
23
L’equazione di Arrhenius permette anche di calcolare
il valore di Ea per una certa reazione, infatti
k = A e -Ea/RT
Può essere scritta in forma logartimica:
Ea
lnk = lnA –
RT
che rappresenta l’equazione di una retta, per cui
mettendo in grafico
– i valori di lnK (ordinate)
– in funzione di 1/T
si ottiene una retta con pendenza pari a -Ea/R e con
intercetta sull’asse delle ordinate pari a lnA
17/01/2014
24
lnA
17/01/2014
Da cui è facile risalire al valore di Ea
25
Teoria del complesso attivato
17/01/2014
La teoria delle collisioni, in realtà è parte di un quadro
di principio più vasto che va sotto il nome di Teoria del
Complesso Attivato
Questa teoria prevede che nel momento in cui due
molecole si incontrano e interagiscono, avvenga tutta
una serie di modificazioni, in particolare si modificano
le lunghezze dei legami fino ad arrivare ad una
configurazione che non è più quella dei reagenti, ma
che rappresenta uno stato intermedio tra reagenti e
prodotti, il Complesso Attivato o Stato di Transizione
26
L’andamento di questo fenomeno è rappresentato
dall’andamento dell’energia potenziale che passa dallo stato di
- E1 (reagenti) a
- E3 (stato attivato
che corrisponde
alla Energia di
attivazione Ea)
- E2 (prodotti di
reazione)
E’ ovvio che se non si forma il complesso attivato la reazione
non può procedere
17/01/2014
27
Il complesso attivato si trova ad un livello energetico
più elevato dei reagenti e dei prodotti e rappresenta
una struttura altamente instabile, a causa della
particolare distribuzione e geometria dei legami
Questo fa sì che il complesso attivato esista per tempi
estremamente brevi (in qualche caso si parla di
nanosecondi)
Questa esistenza così breve è la causa della
impossibilità sperimentale di isolarlo e studiarlo
17/01/2014
28
Meccanismi di reazione
17/01/2014
Abbiamo già detto che ogni reazione è caratterizzata da
una serie di “atti elementari” che caratterizzano il percorso
di reazione
Uno dei parametri che condizionano il percorso di reazione
è la molecolarità della reazione stessa, ossia il numero
delle specie chimiche che intervengono nella formazione
del complesso attivato
In qualche caso la molecolarità corrisponde alla
sommatoria dei coefficienti di reazione (ordine di reazione)
ed allora si parla di reazione elementare
29
Questo significa che la reazione avviene attraverso la
formazione di un unico complesso attivato
Negli altri casi è possibile avere reazioni bimolecolari e
trimolecolari, mentre una molecolarità superiore,
teoricamente possibile, è altamente improbabile
Questo perché le reazioni che coinvolgono più specie
chimiche avvengono in più stadi, ognuno dei quali da
origine ad uno specifico intermedio di reazione, con una
sua specifica Ea ed una specifica Kc
D’altro canto se per far avvenire una reazione è necessario
l’urto di 2 specie chimiche, la probabilità di incontro sarà
molto maggiore rispetto a quando entrano in gioco 3 specie
chimiche e, ancora di più, nell’ ipotesi che siano 4 le specie
necessarie.
17/01/2014
30
Reazioni a catena radicaliche
17/01/2014
In molte reazioni a catena, l’intermedio che si forma è
un radicale, ossia una specie chimica transitoria nella
quale si è determinata una carenza o un eccesso di
elettroni, perturbando in questo modo il naturale
assetto degli orbitali molecolari
Questi disordini elettronici spingono naturalmente tali
composti a reagire con altre molecole, sottraendo o
cedendo elettroni che creano altri radicali che a loro
volta propagano la reazione stessa
31
Un esempio di queste reazioni è quello che porta alla
formazione dell’ HBr a partire dai suoi componenti
molecolari.
In realtà la reazione procede secondo questo schema:
– Br2 2Br●
– Br● + H2 HBr + H●
– H● + Br2 HBr + Br●
E così via, teoricamente all’infinito, in realtà dato l’elevato
numero di radicali in gioco si realizzano anche le reazioni:
2Br● Br2
2H● H2
17/01/2014
Reazioni di arresto che formano
specie non radicaliche
32
CATALISI
I catalizzatori sono sostanze che aumentano la velocità di
una reazione chimica senza venire a loro volta modificati per
cui si ritrovano inalterati al termine della reazione stessa.
Molti dubbi esistono ancora sul meccanismo con cui
agiscono.
Ma una delle teorie più accreditate propone che il
catalizzatore si leghi in maniera labile ad uno o a tutti i
reagenti, formando dei complessi estremamente instabili, ma
che avrebbero il pregio di facilitare l’orientamento delle
molecole, la loro disposizione e, di conseguenza, il
realizzarsi di urti efficaci.
17/01/2014
33
In questo modo la reazione avverrebbe attraverso una serie
di atti elementari diversi da quelli che si realizzano nella
reazione non catalizzata,
ossia la trasformazione chimica si realizzerebbe con un
percorso di reazione diverso ma che ha una energia di
attivazione minore, più facilmente raggiunta e superata dai
reagenti.
Percorso di una
ipotetica reazione
in assenza ed in
presenza di un
catalizzatore
17/01/2014
34
L’esempio classico è quello della reazione di scissione
dell’acqua ossigenata
H2O2 H2O + O
questa reazione avviene spontaneamente ma può essere
catalizzata.
La energia di attivazione risulta essere:
– reazione non catalizzata: Ea = 18 Kcal/mole
– reazione in presenza di platino colloidale: Ea = 12 Kcal/mole
– reazione in presenza di catalasi: Ea = 2 Kcal/mole
17/01/2014
35
Esistono anche i cosiddetti catalizzatori negativi o veleni
che anziché velocizzare una reazione ne diminuiscono la
velocità
L‘ attività di un catalizzatore (o attività catalitica)
corrisponde alla velocità con cui la reazione chimica
raggiunge l'equilibrio in presenza del catalizzatore stesso
Viene espressa nel Sistema Internazionale in katal
1 katal rappresenta la quantità di catalizzatore che
trasforma 1 mole di reagenti in 1 secondo
17/01/2014
L'attività catalitica può anche essere espressa in "unità"
(in inglese "units", simbolo U), ed è calcolata in
micromoli trasformate al minuto
36
Esistono diverse modalità di catalisi, per cui si parla di:
CATALISI OMOGENEA quando i reagenti si trovano
nella stessa fase del catalizzatore.
il catalizzatore è disciolto nell‘ ambiente di reazione,
per cui la separazione del catalizzatore dai prodotti è
più difficoltosa, e costosa, rispetto al caso della catalisi
eterogenea
Inoltre nel caso della catalisi omogenea il sito
catalitico è completamente esposto all'azione dei
reagenti, per cui si ha un‘ attività catalitica maggiore
ma una minore selettività
17/01/2014
37
CATALISI ETEROGENEA quando il catalizzatore e il
reagente esistono in due fasi differenti.
Questo processo avviene in prossimità dell' interfase
reagente-catalizzatore, che può essere di vari tipi, ad es.
fluido-solido o liquido-liquido (es. 2 liquidi immiscibili)
I sistemi catalitici eterogenei possono essere costituiti
anche da un catalizzatore (propriamente detto) fissato ad un
supporto solido.
Il supporto ha la funzione di mantenere allo stato solido il
catalizzatore che altrimenti si disperderebbe nel fluido,
nel qual caso sarebbe necessario un processo più
complesso per il recupero del catalizzatore stesso.
17/01/2014
38
FOTOCATALISI si realizza tramite un catalizzatore che
esplica la sua azione quando irradiato con luce di
opportuna lunghezza d'onda
I fotocatalizzatori classici sono rappresentati da composti
metallici quali TiO2,il più attivo e più utilizzato, ZnO, CeO2,
ZrO2, SnO2, CdS, ZnS ecc.
Il fotocatalizzatore è un semiconduttore che assorbe un
fotone di energia superiore al gap tra banda di valenza e
banda di conduzione, modifica la struttura dei suoi orbitali
molecolari medianti i cosiddetti fotoelettroni, che passano
della banda di valenza a quella di conduzione
Questi trasportatori di carica hanno vita breve, ritornano
alla configurazione originaria o generano un flusso di
corrente superficiale
17/01/2014
39
AUTOCATALISI è il processo catalitico in cui il
catalizzatore è costituito da uno degli stessi prodotti o
intermedi di reazione in grado di agire sullo stadio
lento della reazione chimica.
Comuni esempi di autocatalisi sono rappresentati da:
– la peste dello stagno (una modificazione allotropica),
– la deplezione dello strato di ozono,
– il legame con l‘ ossigeno da parte dell'emoglobina
– la reazione tra permanganato e acido ossalico (Mn2+ è
l'autocatalizzatore).
17/01/2014
40
CATALISI ROTAZIONALE è il meccanismo catalitico
usato nella sintesi di ATP ad opera della ATP sintasi,
come proposto da Boyer nel 1993.
Futai nel 1999 dimostrò sperimentalmente che la
proteina compie una rotazione del cilindro mediante
scatti di 120°.
L'energia liberata dal rientro dei protoni causa la
rotazione delle subunità dell'ATP sintasi.
Tale ipotesi segue l'ipotesi chemiosmotica che
Peter D. Mitchell propose nel 1961 secondo la quale
era proprio l'energia liberata dal rientro degli ioni H+
nel mitocondrio che determina la sintesi di ATP e
utilizza l'ipotesi dell'accoppiamento conformazionale.
17/01/2014
41
Il fenomeno della catalisi è ampiamente utilizzato in vivo,
praticamente tutte le reazioni che avvengono nel nostro
organismo sono reazioni catalizzate da particolari tipi di
molecole, gli enzimi, che costituiscono dei catalizzatori
biologici specifici, di natura proteica, prodotti dalle stesse
cellule che li utilizzano.
Gli enzimi ed il loro meccanismo di azione saranno
trattati successivamente.
17/01/2014
42