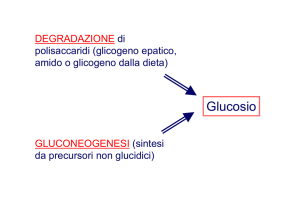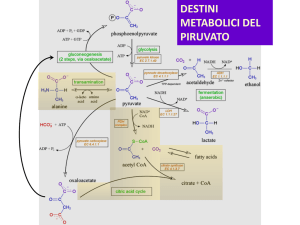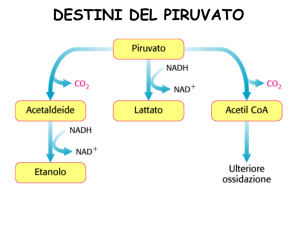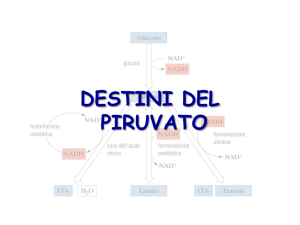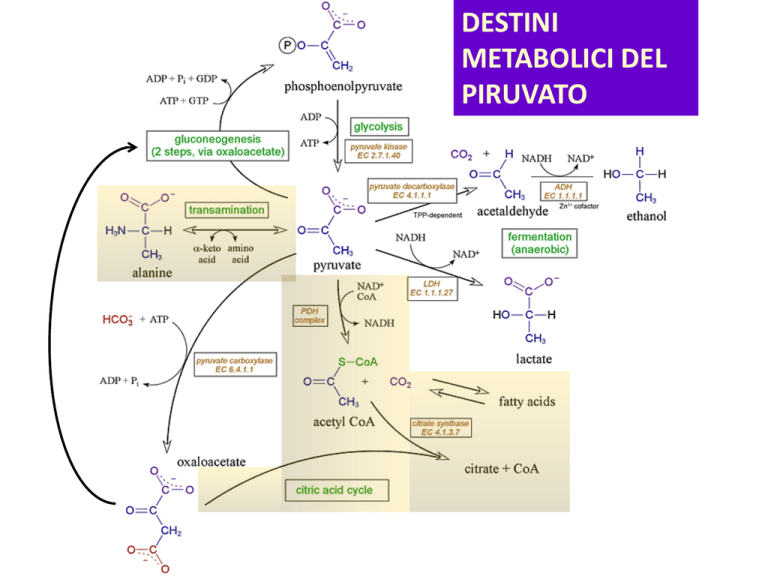
DESTINI
METABOLICI DEL
PIRUVATO
Metabolismo aerobico: il piruvato entra nel mitocondrio
Glicolisi
Piruvato
Acetil-CoA
Ciclo di Krebs
Catena di trasporto degli
elettroni
Complesso della Piruvato
deidrogenasi (PDH)
Piruvato
Acetil-CoA
La reazione produce oltre all’acetil-CoA anche un equivalente riducente di NADH
che può essere indirizzato alla catena di trasporto di e - mitocondriale.
Partendo da 1 molecola di glucosio si ottengono 2 Acetil-CoA e 2 NADH
Complesso della Piruvato
deidrogenasi (PDH)
Complesso multienzimatico contenente
copie multiple di 3 distinte attività
enzimatiche (E1 - E2 - E3)
E1 = piruvato deidrogenasi (in E. coli 24 subunità)
E2 = diidrolipoammide acetiltransferasi (24 subunità)
E3 = diidrolipoammide deidrogenasi (12 subunità)
Decarbossilazione
ossidativa del
piruvato.
È un processo
irreversibile.
In E. coli: le 24 subunità E2 costituiscono il cuore del complesso
Mike Williamson, COME FUNZIONANO LE PROTEINE, Zanichelli editore S.p.A. Copyright © 2013
10 | 4
Subunità E1 Contiene come cofattore la TPP. Catalizza la decarbossilazione del
piruvato e la formazione dell’intermedio idrossietil-TPP
E1
Piruvato
Idrossietil-
_
La forma carbanionica
dell’Idrossietil-TPP è quella
più reattiva ed entra in
gioco nella reazione
successiva
Subunità E2 Contiene come cofattore la Lipoammide. La subunità E1 trasferisce il
gruppo idrossietilico dalla TPP sulla lipoammide della subunità E2: nel trasferimento
l’idrossietile è OSSIDATO a gruppo Acetilico e il ponte disolfuro della lipoammide
viene ridotto. Si forma un legame tioestere ad alta energia.
La subunità E2 catalizza poi la transacetilazione del
gruppo acetilico dalla Lipoammide al Coenzima A
con conseguente formazione di Acetil-CoA. La
lipoammide rimane nella forma ridotta.
_
H+
H+
O =C-CH3
HS S
HS S
ACETIL DIIDROLIPOAMIDE
Mike Williamson, COME FUNZIONANO LE PROTEINE, Zanichelli editore S.p.A. Copyright © 2013
10 | 7
Ciascuno porta un braccio di lipoammide
che può caricare un gruppo acetilico
Dominio della
subunità
periferica
Il movimento del braccio mobile della
lipoammide garantisce una
canalizzazione dei prodotti da una
reazione all’altra, il processo è più
efficiente e non si verifica perdita di
intermedi metabolici.
Mike Williamson, COME FUNZIONANO LE PROTEINE, Zanichelli editore S.p.A. Copyright © 2013
10 | 8
Subunità E3
Contiene come cofattore il FAD.
Catalizza l’ossidazione della lipoillisina (si riforma il ponte disolfuro) con riduzione del FAD a
FADH2 il quale trasferirà poi 2 e- sul NAD+ con conseguente produzione finale di NADH.
D. Voet – C. W. Pratt – J. G. Voet, FONDAMENTI DI BIOCHIMICA, Zanichelli editore S.p.A. Copyright © 2013
17 | 9
FAD
LIPOAMMIDE
RIDOTTA
HS SH
Cys
S
Cys
S
OSSIDORIDUZIONI NELLA SUBUNITA’ E3
NAD+
FAD
FADH2
SH
S
SH
S
FAD
S
+ NADH + H+
S
LIPOAMMIDE
OSSIDATA
Il NADH è un trasportatore mobile di e-, nella
forma ridotta lascia il complesso della piruvato
deidrogenasi per dirigersi alla catena
respiratoria mitocondriale
REGOLAZIONE DEL COMPLESSO DELLA PIRUVATO
DEIDROGENASI
DISPONIBILITA’ DEL SUBSTRATO
MODULAZIONE ALLOSTERICA
MODIFICAZIONI COVALENTI
(fosforilazione/defosforilazione)
I prodotti della reazione funzionano da
modulatori allosterici negativi:
Acetil-CoA (sulla transacetilasi, E2)
NADH (sulla diidrolipoil deidrogenasi, E3)
reazione
irreversibile
alte concentrazioni di Acetil-CoA e NADH informano
l’enzima che non è più necessario metabolizzare il
piruvato (le esigenze cellulari sono soddisfatte)
L’attività della PDH è connessa anche al metabolismo
dei lipidi: una elevata degradazione dei lipidi che
incrementa il livello di Acetil-CoA e NADH rallenta la
PDH e porta al risparmio di glucosio.
NADH e Acetil-CoA quando presenti ad alte
concentrazioni nel mitocondrio attivano la
piruvato deidrogenasi chinasi che
fosforilando il complesso lo rende inattivo
In condizioni di elevato apporto glucidico, sotto stimolo
dell’Insulina, è attivata una fosfatasi specifica che
defosforila il complesso rendendolo attivo e permettendo
quindi l’ingresso di piruvato nel ciclo di Krebs
D. Voet – C. W. Pratt – J. G. Voet, FONDAMENTI DI BIOCHIMICA, Zanichelli editore S.p.A. Copyright © 2013
17 | 12