Allegato 1/BIENNIO TECNOLOGICO
COMPETENZE DI BASE DELL’ASSE SCIENTIFICO TECNOLOGICO
Disciplina: SCIENZE INTEGRATE (CHIMICA)
1) Stabilire le grandezze fisiche caratteristiche di una misura, progettare semplici investigazioni, nel pieno rispetto della sicurezza personale ed ambientale
2) Spiegare le evidenze macroscopiche delle trasformazioni fisiche e chimiche mediante il modello cinetico-molecolare della materia e usare la mole come unità di
misura della quantità di sostanza e come ponte fra i sistemi macroscopici (solidi, liquidi, gas) e i sistemi microscopici (atomi, molecole, ioni)
3) Denominare i sistemi chimici secondo la nomenclatura IUPAC, preparare soluzioni di data concentrazione, spiegare l’evoluzione dei sistemi chimici verso
l’equilibrio e descrivere i fattori che influenzano la velocità di una reazione.
4) Spiegare le proprietà di acidi e basi, di ossidanti e riducenti, delle reazioni di ossido-riduzione, delle pile, delle celle elettrolitiche
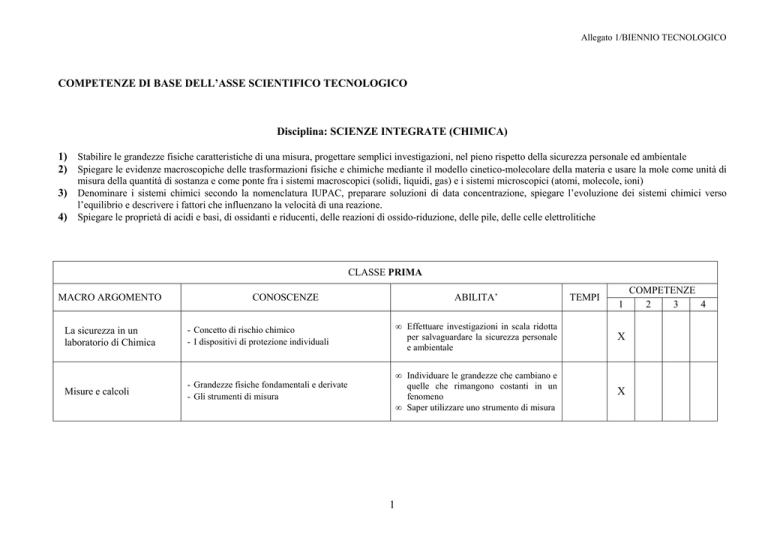
CLASSE PRIMA
MACRO ARGOMENTO
CONOSCENZE
ABILITA’
TEMPI
COMPETENZE
1
2
3
4
La sicurezza in un
laboratorio di Chimica
- Concetto di rischio chimico
- I dispositivi di protezione individuali
• Effettuare investigazioni in scala ridotta
per salvaguardare la sicurezza personale
e ambientale
X
Misure e calcoli
- Grandezze fisiche fondamentali e derivate
- Gli strumenti di misura
• Individuare le grandezze che cambiano e
quelle che rimangono costanti in un
fenomeno
• Saper utilizzare uno strumento di misura
X
1
Allegato 1/BIENNIO TECNOLOGICO
- Miscugli omogenei ed eterogenei
- Tecniche di separazione dei sistemi omogenei ed
eterogenei
- Le sostanze
- Le evidenze sperimentali di una sostanza pura:
elementi, composti, atomi, molecole e ioni
• Saper effettuare la separazione dei
componenti un
miscuglio tramite
filtrazione, centrifugazione, distillazione,
cristallizzazione.
• Saper effettuare una separazione di un
miscuglio omogeneo (inchiostro e/o
estratto di clorofilla) attraverso una
cromatografia su carta.
• Saper effettuare un’estrazione con
solventi
• Saper effettuare la classificazione di una
sostanza pura utilizzando anche metodi
sperimentali
X
Gli stati della materia
- Le evidenze e le spiegazioni dei passaggi di stato
- L’organizzazione microscopica del gas ideale:
pressione, le leggi di Boyle, Gay-Lussac, Charles,
Dalton, l’equazione di stato del gas ideale, principio
di Avogadro
• Saper utilizzare il modello cineticomolecolare per spiegare le evidenze
delle trasformazioni fisiche e chimiche
• Saper descrivere a livello microscopico
lo stato liquido, solido
• Correlare la densità dei gas alla massa
molare e al volume molare
X
Le leggi fondamentali
- Legge di Lavoisier
- Legge di Proust
- Legge di Dalton
• Saper applicare le leggi ai calcoli
afferenti alle reazioni chimiche
La mole
- La mole: massa atomica, massa molecolare,
costante di Avogadro, volume molare
• Determinare la quantità chimica in un
campione di una sostanza ed usare la
costante di Avogadro
Le reazioni chimiche
- Nomenclatura dei composti semplici;
- Reazioni di sintesi, di decomposizione, di scambio,
doppio scambio
- Equazioni di reazione, bilanciamento
- Calcoli stechiometrici
• Saper denominare semplici composti
• Saper riconoscere, scrivere e realizzare
sperimentalmente una reazione chimica
• Saper bilanciare stechiometricamente
una reazione chimica
• Saper ricavare dallo stesso sistema di
reazione le quantità chimiche di reagenti
e prodotti
Miscugli e sostanze
2
X
X
X
Allegato 1/BIENNIO TECNOLOGICO
CLASSE SECONDA
MACRO ARGOMENTO
CONOSCENZE
ABILITA’
TEMPI
1
COMPETENZE
2
3
4
La struttura dell’atomo
- Il modello atomico ad orbitali
- L’ordine di riempimento degli orbitali
- Forma e funzione del sistema periodico: proprietà
periodiche, energia di ionizzazione e affinità
elettronica, metalli, non metalli, semimetalli
• Saper spiegare la forma a livelli di
energia dell’atomo sulla base delle
evidenze sperimentali
• Saper spiegare il saggio alla fiamma nel
riconoscimento di un elemento chimico
X
Le forze che legano gli atomi
-
• Spiegare la forma delle molecole e le
proprietà delle sostanze
X
Reazioni chimiche ed energia
- Reazioni esotermiche ed endotermiche
- La combustione
- L’entalpia, l’entropia, l’energia libera
• Prevedere la evoluzione spontanea di
una trasformazione, conoscendo le
variazioni di entalpia, di entropia, di
energia libera
X
Le proprietà delle soluzioni
- Percento in peso, molarità, molalità, proprietà
colligative
• Provare la solubilità di una sostanza in
acqua e in altri solventi
• Preparare soluzioni (sistema) di data
concentrazione (percento in peso,
molarità, molalità)
X
Velocità di reazione
- I catalizzatori e i fattori che influenzano la velocità di
reazione
• Spiegare l’azione di temperatura,
concentrazione, pressione, superficie di
contatto, presenza di catalizzatore sulla
velocità di reazione
X
Regola dell’ottetto
Principali legami chimici
Il numero di ossidazione
La scala dell’elettronegatività
La forma delle molecole
3
Allegato 1/BIENNIO TECNOLOGICO
Equilibrio chimico
- L’equilibrio dinamico, la costante di equilibrio,
principio di Le Chatelier
Acidi e basi
-
Chimica ed elettricità
Laboratorio
• Calcolare la costante di equilibrio
Le teorie acido-base
Il pH e gli indicatori
Le reazioni acido-base
Gli acidi e basi forti e deboli
L’ idrolisi
• Riconoscere sostanze acide e basiche
tramite indicatori e misure di pH
• Saper determinare il pH di una
soluzione di acido forte e base forte.
X
- Reazioni di ossido-riduzione e loro bilanciamento
- Potenziali normali, energia libera e spontaneità delle
reazioni
- Le pile
- La corrosione
- Elettrolisi
• Bilanciare le reazioni di ossido
riduzione col metodo ionico elettronico
• Utilizzare i potenziali normali di
riduzione per stabilire la spontaneità del
processo mediante le variazioni di
energia
X
− Tutte le Unità Didattiche prevedono attività
laboratoriale e/o sperimentale specifica
• Saper effettuare attività sperimentali
applicando
le
normative
sulla
protezione ambientale e sulla sicurezza
• Saper interpretare dati e risultati
sperimentali in relazione ai modelli
teorici di riferimento.
LIVELLI MINIMI
Alla fine della classe prima l'alunno deve:
X
Conoscenza dei simboli chimici dei principali elementi
Nomenclatura di semplici composti chimici (Nomenclatura IUPAC fino agli acidi ternari no sali ternari)
Reazioni di formazione dei principali composti chimici
Bilanciamento di una reazione chimica
Conoscenza della mole come unità di misura e suo utilizzo per semplici calcoli stechiometrici
Distinzione tra miscuglio e composto ed elemento
Distinzione tra trasformazioni chimiche e fisiche
Gli stati di aggregazione della materia
4
X
X
X
X
Allegato 1/BIENNIO TECNOLOGICO
Alla fine della classe seconda l’alunno deve
Nomenclatura di composti chimici TRADIZIONALE ( sali ternari compresi)
Modelli atomici
Configurazione elettronica
Simbologia di Lewis
Modalità di espressione della concentrazione delle soluzioni e relativi calcoli
Tipologia delle reazioni chimiche
Conoscenza dei fattori che influenzano la velocità di reazione
Descrizione di un equilibrio chimico
Conoscenza dei fattori che influenzano l’equilibrio
Differenziazione di soluzioni acide e basiche in base al pH
Calcolo del pH di una base o di un acido forte
Origine e differenziazione dei vari tipi di legame chimico
OBIETTIVI TRASVERSALI
Alla fine del biennio l'allievo relativamente al metodo di lavoro dovrà:
−
−
−
−
−
saper prendere appunti;
conoscere i contenuti “minimi” disciplinari;
avere acquisito una maggior chiarezza nella espressione scritta e orale;
sviluppare le capacità di analisi e di sintesi
conoscere ed usare un lessico differenziato per comunicare nei diversi linguaggi.
Per quanto riguarda la partecipazione all'attività scolastica dovrà:
−
−
−
−
−
−
essere attento alle spiegazioni;
essere impegnato nel lavoro in classe;
rispettare le scadenze degli impegni scolastici;
aver acquisito un metodo personale di studio e di lavoro;
aver sviluppato autocontrollo e senso di responsabilità;
aver acquisito consapevolezza dei propri limiti e delle proprie potenzialità.
5
Allegato 1/BIENNIO TECNOLOGICO
Dal punto di vista comportamentale dovrà:
−
−
essere corretto e rispettoso verso i compagni, gli insegnanti ed il personale scolastico;
rispettare le attrezzature ed il materiale scolastico.
METODOLOGIA
−
−
−
−
Metodo induttivo e deduttivo
Attività individuali e di gruppo
Problem solving
Lezione frontale
VERIFICA E VALUTAZIONE
Per la valutazione si terrà conto di:
−
−
−
−
−
−
−
situazione di partenza;
progressi compiuti nel tempo;
ritmo di apprendimento;
impegno ed interesse dimostrato anche durante le attività di laboratorio;
comportamento;
rispetto delle elementari norme di sicurezza;
risultati ottenuti rispetto agli obiettivi prefissati.
Si effettuerà la verifica attraverso:
−
−
−
−
interrogazioni che risulteranno utili soprattutto per valutare le capacità di ragionamento, i progressi raggiunti nella proprietà di espressione e nell’uso di un linguaggio tecnico
specifico per la disciplina;
discussioni;
prove scritte (Test, relazioni,….): potranno essere articolate sia sotto forma di problemi ed esercizi di tipo tradizionale sia sotto forma di quesiti e prove strutturate e semi
strutturate. Durante le verifiche scritte è ammesso l’uso di manuali e calcolatori tascabili.
prove di laboratorio.
6