LICEO SCIENTIFICO STATALE “GIORDANO BRUNO” VENEZIA – MESTRE
Anno scolastico 2010 – 2011
CLASSE: III sez. B Sperim. Parziale Scienze naturali
INSEGNANTE: MEDICI Mara
DISCIPLINA: CHIMICA
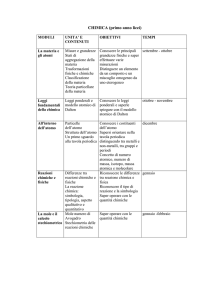
Programma effettivamente svolto e relative Competenze
Le proprietà e le trasformazioni della materia.
Spiegare le differenze tra una trasformazione fisica e una trasformazione chimica.
Classificare i materiali in base al loro stato fisico: riconoscere i sistemi omogenei ed eterogenei; le
sostanze pure ed i miscugli. Descrivere i passaggi di stato delle sostanze pure. Saper utilizzare le principali
tecniche di separazione dei materiali (filtrazione, cromatografia ecc.).
Le trasformazioni chimiche della materia.
Distinguere un elemento da un composto.
Distinguere tra soluto e solvente; conoscere il concetto di solubilità e di soluzioni sature
La teoria atomica.
Saper descrivere i diversi modelli atomici
Struttura di un atomo e delle sue particelle.
Descrivere la struttura di un atomo e delle sue particelle; definire numero atomico e numero di massa,
isotopi e ioni; calcolare la carica di uno ione a partire dal suo simbolo o il numero di neutroni di un elemento
noti il numero atomico e di massa.
Livelli energetici e numeri quantici.
Definire i livelli energetici. Elencare i numeri quantici e specificare cosa rappresentano.
Gli orbitali atomici.
Elencare l’ordine di riempimento degli orbitali; descrivere la configurazione elettronica di un elemento a
partire dal suo numero atomico.
Tavola periodica degli elementi .
Ricavare informazioni sugli elementi consultando la tavola periodica.
Gruppi e periodi della tavola periodica; proprietà chimiche.
Individuazione dei gruppi e dei periodi, delle principali proprietà dei metalli degli alogeni e dei gas nobili;
relazione tra proprietà chimiche e struttura elettronica.
Valenza degli elementi e numero di ossidazione. Elettronegatività.
Descrivere cosa sono gli elettroni di valenza e gli orbitali omonimi, definire elettronegatività e numero di
ossidazione, saper rappresentare gli elettroni di valenza con le formule di Lewis.
I legami chimici: covalente, ionico, dativo, a idrogeno.
Definire i vari tipi di legami e le loro caratteristiche.
Saper rappresentare il legame chimico tra gli atomi.
Riconoscere tra le molecole inorganiche il tipo di legame che intercorre tra gli atomi.
Stabilire la polarità dei legami covalenti e delle molecole sulla base delle differenze di elettronegatività degli
elementi.
Le forze intermolecolari e gli stati condensati della materia.
Spiegare le proprietà fisiche dei materiali sulla base delle interazioni microscopiche fra atomi, ioni e
molecole e della loro struttura cristallina.
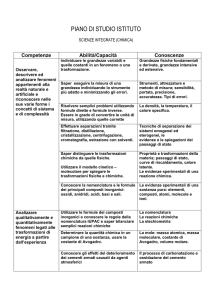
Classificazione e nomenclatura dei composti: ossidi, idrossidi, acidi , sali, perossidi.
Classificare i composti secondo la natura ionica, molecolare, binaria, ternaria. Assegnare il numero di
ossidazione. Usare le regole della nomenclatura IUPAC o tradizionale per scrivere le formule.
Definire per ogni categoria di composto inorganico il tipo di reazione chimica mediante il quale possono
essere ottenuti.
Caratteristiche dei soluti e dei solventi. Le proprietà delle soluzioni.
Preparare soluzioni a concentrazione nota (percentuale in peso e in volume, ppm…)
Spiegare la solubilità nei solventi col modello cinetico-molecolare e le proprietà colligative delle soluzioni.
Reazioni ed equazioni chimiche.
Bilanciare una reazione chimica. Effettuare calcoli stechiometrici.
Leggere un’equazione chimica bilanciata sia sotto l’aspetto macroscopico che sotto l’aspetto microscopico.
Le varie forme di energia.
Saper distinguere tra le varie forme di energia. Saper individuare le reazioni in cui si verifica un
trasferimento di energia. Saper esprimere i valori di energia con le corrette unità di misura.
Velocità delle reazioni chimiche ed equilibrio chimico.
Spiegare l’azione dei diversi parametri che influenzano la velocità di reazione (temperatura, concentrazione,
pressione, superficie di contatto, presenza dei catalizzatori).
Definire l’energia di attivazione ed i catalizzatori; definire le reazioni e la costante di equilibrio.
Saper calcolare la costante di equilibrio, note le concentrazioni dei reagenti e dei prodotti.
Valutare il grado di completezza di una reazione per mezzo della costante di equilibrio.
Acidità e basicità delle sostanze; il pH.
Spiegare le proprietà di acidi e basi, mediante le teorie di Arrhenius, Brønsted-Lowry, di Lewis.
Riconoscere le sostanze acide e basiche tramite gli indicatori.
Misurare il pH di una soluzione con l’indicatore universale.
Distinguere gli acidi e le basi forti dagli acidi e basi deboli.
Conoscere il pH dei principali composti biologici.
Le reazioni di ossido-riduzione.
Determinare il numero di ossidazione degli elementi liberi e nei composti.
Individuare e bilanciare le reazioni di ossido-riduzione.
Mestre, 4 giugno 2011
l'insegnante (prof Medici Mara)
gli alunni