PIANO DI STUDIO ISTITUTO
SCIENZE INTEGRATE (CHIMICA)
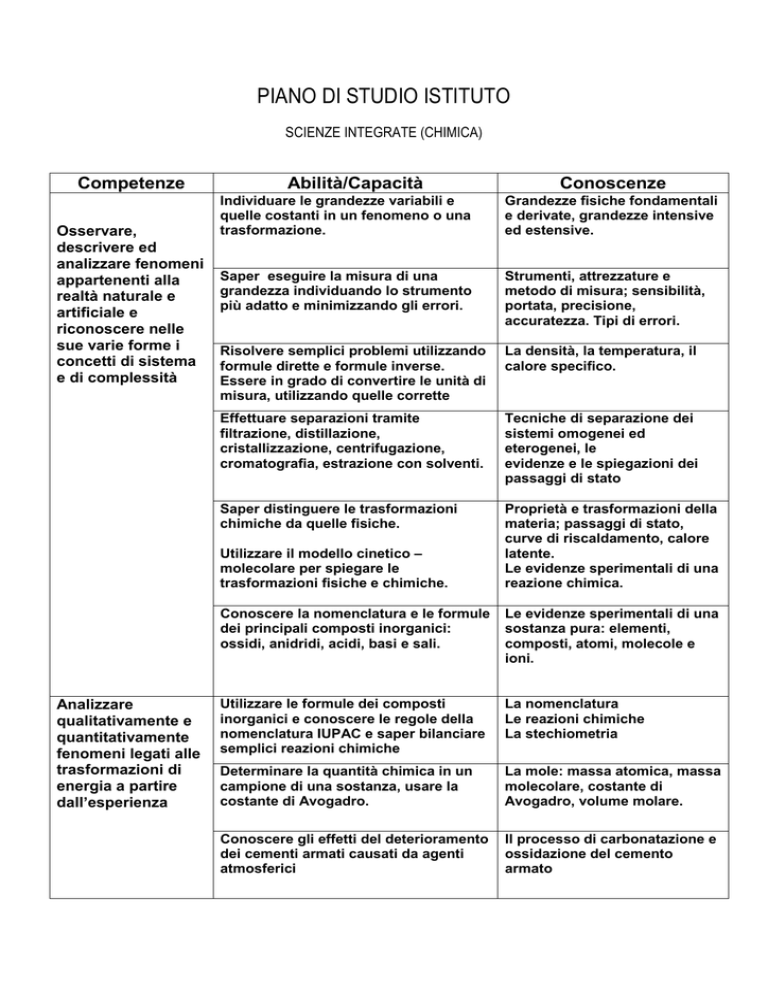
Competenze
Osservare,
descrivere ed
analizzare fenomeni
appartenenti alla
realtà naturale e
artificiale e
riconoscere nelle
sue varie forme i
concetti di sistema
e di complessità
Abilità/Capacità
Grandezze fisiche fondamentali
e derivate, grandezze intensive
ed estensive.
Saper eseguire la misura di una
grandezza individuando lo strumento
più adatto e minimizzando gli errori.
Strumenti, attrezzature e
metodo di misura; sensibilità,
portata, precisione,
accuratezza. Tipi di errori.
Risolvere semplici problemi utilizzando
formule dirette e formule inverse.
Essere in grado di convertire le unità di
misura, utilizzando quelle corrette
La densità, la temperatura, il
calore specifico.
Effettuare separazioni tramite
filtrazione, distillazione,
cristallizzazione, centrifugazione,
cromatografia, estrazione con solventi.
Tecniche di separazione dei
sistemi omogenei ed
eterogenei, le
evidenze e le spiegazioni dei
passaggi di stato
Saper distinguere le trasformazioni
chimiche da quelle fisiche.
Proprietà e trasformazioni della
materia; passaggi di stato,
curve di riscaldamento, calore
latente.
Le evidenze sperimentali di una
reazione chimica.
Utilizzare il modello cinetico –
molecolare per spiegare le
trasformazioni fisiche e chimiche.
Analizzare
qualitativamente e
quantitativamente
fenomeni legati alle
trasformazioni di
energia a partire
dall’esperienza
Conoscenze
Individuare le grandezze variabili e
quelle costanti in un fenomeno o una
trasformazione.
Conoscere la nomenclatura e le formule
dei principali composti inorganici:
ossidi, anidridi, acidi, basi e sali.
Le evidenze sperimentali di una
sostanza pura: elementi,
composti, atomi, molecole e
ioni.
Utilizzare le formule dei composti
inorganici e conoscere le regole della
nomenclatura IUPAC e saper bilanciare
semplici reazioni chimiche
La nomenclatura
Le reazioni chimiche
La stechiometria
Determinare la quantità chimica in un
campione di una sostanza, usare la
costante di Avogadro.
La mole: massa atomica, massa
molecolare, costante di
Avogadro, volume molare.
Conoscere gli effetti del deterioramento
dei cementi armati causati da agenti
atmosferici
Il processo di carbonatazione e
ossidazione del cemento
armato
Osservare, descrivere
ed analizzare
fenomeni
appartenenti alla
realtà naturale e
artificiale e
riconoscere nelle sue
varie forme i concetti
di sistema e di
complessità
Preparare soluzioni di data
concentrazione (percento in peso,
percento in volume molarità,)
Riconoscere sostanze acide e basiche
tramite indicatori e misure di pH
Saper eseguire una titolazione
Le soluzioni
Acidi e basi
pH
Reazioni di neutralizzazione
Titolazioni
Saper descrivere la natura della luce e
delle particelle elementari che
compongono l’atomo
La natura della luce
Le particelle fondamentali
dell’atomo: numero atomico,
numero di massa, isotopi
Le evidenze sperimentali del
modello atomico a strati e ad
orbitali e l’organizzazione
elettronica degli elementi
Il sistema periodico degli
elementi
Forma e funzione del sistema
periodico: proprietà periodiche,
energia di ionizzazione e
affinità elettronica, metalli, non
metalli,
semi-metalli
Il legame chimico: regola
dell’ottetto, principali legami
chimici, valenza, numero
ossidazione, scala
elettronegatività.
Forma delle
molecole
Forze intermolecolari, momento
di dipolo
Formule di struttura
Spiegare la forma a livelli di energia
dell’atomo sulla base delle evidenze
sperimentali, come il saggio alla
fiamma
Distinguere i tipi di legami chimici
Spiegare la forma e la polarità delle
molecole.
Identificare le reazioni di ossido
riduzione.
Bilanciare le reazioni di ossido
riduzione col metodo ionico elettronico.
Costruire una pila chimica.
Riconoscere i processi di elettrolisi e di
corrosione
Numero di ossidazione
Reazioni di ossidoriduzione e
loro bilanciamento: potenziali
normali, pile, corrosione.
Elettrochimica












