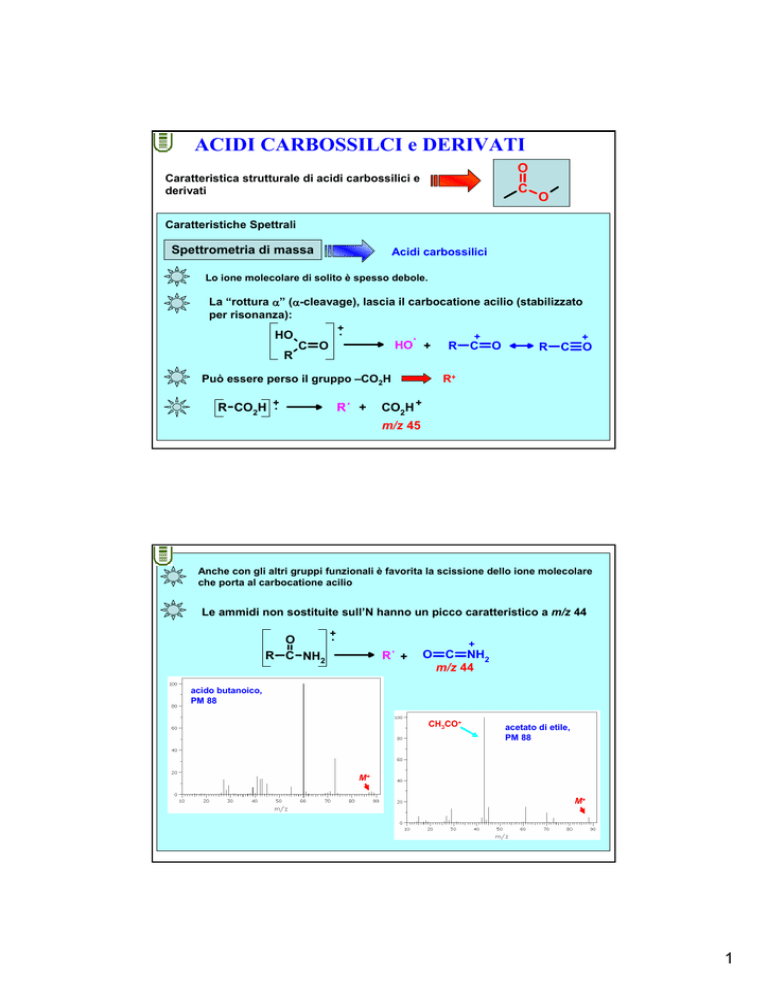
ACIDI CARBOSSILCI e DERIVATI
O
Caratteristica strutturale di acidi carbossilici e
derivati
C
O
Caratteristiche Spettrali
Spettrometria di massa
Acidi carbossilici
Lo ione molecolare di solito è spesso debole.
La “rottura α” (α-cleavage), lascia il carbocatione acilio (stabilizzato
per risonanza):
+.
HO
R
.
HO +
C O
R
.
+
+
C
O
R
C
+
O
R+
Può essere perso il gruppo –CO2H
R CO2H +.
R
CO2H +
m/z 45
Anche con gli altri gruppi funzionali è favorita la scissione dello ione molecolare
che porta al carbocatione acilio
Le ammidi non sostituite sull’N hanno un picco caratteristico a m/z 44
+.
O
R C NH2
.
R +
+
O
C NH2
m/z 44
acido butanoico,
PM 88
CH3CO+
acetato di etile,
PM 88
M+
M+
1
+
propanammide,
PM 73
O
cloruro di butanoile,
PM 106
C NH2
m/z 44
M+ - Cl
M+
+
C
O
Analogo a quello di aldeidi e chetoni
UV-visibile
IR
stretching O-H
anidride
benzencarbossilica,
PM 226
ACIDI CARBOSSILICI
banda molto larga a 2400 cm-1, spesso sovrapposta
alle bande CH
O
HO
R C
C R
OH
O
stretching C=O a circa 1730-1700 cm-1, spostato verso valori più
bassi dalla coniugazione
stretching C-O
tra 1320 e 1210 cm-1
acido butanoico
2
IR
ESTERI
stretching C=O
a circa 1735 cm-1, spostato verso valori più bassi
dalla coniugazione con R. La coniugazione con OR’
sposta l’assorbimento verso valori più alti.
stretching C-O
due o più bande tra 1300 e 1000 cm-1
acetato di etile
IR
AMMIDI
stretching C=O
a circa 1670-1640 cm-1.
stretching N-H
3500-3100 cm-1 (CONH2 hanno due bande)
propanammide
O
H C
N CH3
H3C
3
IR
CLORURI ACILICI
stretching C=O
a circa 1800 cm-1, spostato verso valori più bassi dalla
coniugazione.
cloruro di butanoile
cloruro di benzoile
IR
stretching C=O
stretching C-O
ANIDRIDI
sempre due bande tra 1830 a 1800 cm-1 e tra 1775 e 1740,
spostato verso valori più bassi dalla coniugazione con R.
tra 1300 e 900 cm-1
anidride propanoica
4
IR
stretching
NITRILI
C N a circa 2250 cm-1, spostato verso valori più bassi dalla
coniugazione con R.
propanonitrile
benzenecarbonitrile
13C
NMR
L’effetto -I dell’O ed il campo magnetico generato
dagli elettroni π diminuiscono la densità elettronica
attorno al nucleo del 13C: molto deschermato
δCOX 180-160 ppm
CO
acetato di etile
acido butanoico
CO
COCO
anidride propanoica
CO
propanammide
5
1H
NMR
L’effetto -I dell’O diminuisce la densità elettronica attorno al nucleo del 1H
sul C adiacente: deschermato da 2,0-2,5 (CH3) fino a 3 (CH2, CH) δ
OH (negli acidi arbossilici) fortemente deschermato: 10-15 δ;
protone mobile, scambia con D2O
NH (nelli ammidi) deschermato e molto allargato: 6-7 δ; protone
mobile, scambia con D2O
acido butanoico
acido
benzencarbossilico
OH
OH
acetato di etile
propanammide
NH
N-metiletanammide
anidride benzoica
NH
6
ACIDI CARBOSSILCI e DERIVATI
H acido
H
O+ C O
δ
sp2
H
δ
H+
C
Nu:
H acido
Caratteristiche:
Acidità del legame O-H
Il C del carbossile subisce attacco da parte dei nucleofili
I protoni in α al carbossile sono relativamente acidi e
possono essere sostituiti
gruppo uscente
Y
C O
H
H acido
♦ sull'O del carbonile (o sull'N del
nitrile) si ha protonazione
δ-
δ+
sp2
Caratteristiche:
H+
C
♦ I protoni in α al carbonile sono
relativamente acidi e possono
essere strappati con basi forti
♦ Qualche reazione caratteristica
delle ammidi avviene sull'N
Nu:
Reazione caratteristica
δ+
sp
C N
H
SOSTITUZIONE NUCLEOFILA
δ-
(la sostituzione nucleofila può avvenire con
meccanismo base- o acido-catalizzato)
H acido
H+
C
Nu:
7
Meccanismo:
+
H Nu:
lento
R
C
Nu H
R
O
C
O
Nu
-
sp2
(trigonale planare)
C
O
R
Y
Y
sp2
(trigonale planare)
sp3
(tetraedrico)
SOSTITUZIONE NUCLEOFILA AL CARBONIO ACILICO
Principali nucleofili:
:NuH = H2O, ROH, NH3, RNH2, R2NH, RSH, RCO2H
Nu:- = RCO2-, R-, H-
O
<
C
R
O
R
NH2
<
C
OR'
O
O
C
C
R
O
O
<
<
C
R
R
O
C
R
SR'
Cl
reattività crescente
Questo ordine di reattività è il risultto di più fattori
meno basico: miglior gruppo uscente
Basicità del gruppo uscente
Basicità:
-NH2 < -OR < -O-C(O)R < Cl-
capacità come gruppo uscente
Risonanza
O-
O
C
R
R
C
Cl
R
Cl+
O
O-
R C
C
C +
R
SR'
R C
SR'
R C
O
C
OR'
R
O+
O+
R C
C
R
O-
O-
O
+
OR'
C
O
O-
C
O
R
R C
O
O
R
O-
O
C
NH2
R
+
NH2
8
il contributo della struttura di risonanza a separazione di carica diminuisce
la bontà del gruppo uscente ed è tanto maggiore quanto migliore è la
sovrapposizione degli orbitali (cioè con gli elementi della stessa riga).
Effetto induttivo
Maggiore è l’effetto ad attrazione elettronica, più positivo è il C carbonilico
più facile è l’attacco del nucleofilo
O
R C
Cl
REATTIVITA‘
CRESCENTE
O
R C
O
R C
H2O
O
O
O
R C
OH
H+
oppure
OH-
R C
OR'
O
R C
NH2
R C
N
O
R C
REATTIVITA‘
CRESCENTE
Cl
O
R C
O
R"OH
O
R C
OR"
R C
O
O
R C
OR'
O
R C
REATTIVITA‘
CRESCENTE
Cl
O
R C
O
R C
O
NH3
O
R C
NH2
O
R C
OR'
9
1.
Nu = H2O
REAZIONE CON H2O
a) Alogenuri acilici
lento
O
R C
+ :OH2
Cl
O-
O
+
R C OH2
R C
OH
HCl
Cl
Sostituenti ad attrazione elettronica su R FACILITANO l'attacco del nucleofilo
b) Esteri
Gli esteri sono meno reattivi degli alogenuri acilici: l’acqua da sola non reagisce)
-OH,
Nu = -OH
In ambiente basico
-:OH
+
OR'
R C
O
lento
O
H2O oppure H2O, H+
R
O
O
+ -OR'
R C
C OH
R C
OH
reazione acido-base
OR'
O
- + R'OH
L'ultimo passaggio rende IRREVERSIBILE l'intero processo
Sostituenti ad attrazione elettronica su R FACILITANO l'attacco del nucleofilo
In ambiente acido
O
Nu = H2O
H+
+O H
R C
R C
OR' H O
2
OH
OH
R C
OR'
+ OH
2
R C
OH
O H
R C
+
OR'
OH
lento
R C
OR'
:OH2
OR'
+OH2
+
H
OR'
+
R C +
OH
Processo REVERSIBILE
O
OH
OH
R C
+ R'OH
R C
OH
H+
OH
Questo significa che in ambiente acido si può
idrolizzare un estere ad acido carbossilico
L'idrolisi acida degli esteri è praticamente insensibile agli effetti elettronici
dei sostituenti; è invece sensibile agli effetti sterici
ATTENZIONE
Questa insensibilità agli effetti elettronici (induttivo
e coniugativo) dei sostituenti è una caratteristica
SOLO dell’IDROLISI ACIDA degli ESTERI
è il risultato di effetti opposti, praticamente uguali
10
Lo stadio lento è l’attacco del nucleofilo sull’estere protonato:
dipende quindi dalla sua concentrazione, che, a sua volta, dipende
dalla basicità dell’estere
K=
[RC(O)OHR'+]
[RCO2R'][H+]
[RC(O)OHR'+] = K [RCO2R'][H+]
v = k[RC(O)OHR'+] = kK [RCO2R'][H+]
La reattività dipende dalla costante di velocità dello stadio lento (k) E
dalla costante di equilibrio acido-base preliminare (K)
k
l'attacco del nucleofilo è favorito dai sostituenti ad attrazione elettronica
K
la protonazione di una base è sfavorita dai sostituenti ad attrazione elettronica
Solo nel caso dell'idrolisi acida degli esteri gli effetti hanno valori molto simili,
cioè la sensibilità della protonazione e dell'attacco nucleofilo all'effetto dei
sostituenti è praticamente la stessa.
Essendo di segno opposto, gli effetti si annullano.
c) Ammidi
Le ammidi sono ancora meno reattive: l’acqua da sola non reagisce)
-OH,
Nu = -OH
In ambiente basico
O
R C
+ -:OH
O-
lento
R
C OH
NH2
Ci sono solo CATTIVI gruppi uscenti, -OH e
-NH2, ma -OH è più ACIDO di –NH2
C OH
R
NH2
O-
H2O oppure H2O, H+
NH2
O-
-:OH
R
C O
NH2
-
O
R C
-
+ -NH2
H2O
O
R C
O
reazione acido-base
O-
+ NH3
L'ultimo passaggio rende IRREVERSIBILE l'intero processo
Sostituenti ad attrazione elettronica su R FACILITANO l'attacco del nucleofilo
11
In ambiente acido
H+
O
Nu = H2O
+O H
R C
R C
NH2 H O
2
OH
OH
R C NH2
+ OH
R C
O H
NH2
R C
+
O
R C
OH
:OH2
R C NH2
+ OH
2
+ OH
R C +
OH
OH
2
NH2
OH
H
NH2
+
OH
lento
+ NH3
R C
OH
+ NH4+
L'ultimo passaggio rende IRREVERSIBILE l'intero processo
Sostituenti ad attrazione elettronica su R FACILITANO l'attacco del nucleofilo
d) Anidridi
Nu = H2O
Le anidridi sono più reattive di esteri ed ammidi: basta l’acqua da sola
O-
O
C
R
O
R
R
+ :OH2
C
-
O
+
OH2
R
C
O
R
C
C
R
C
O
O
O
O-
O
+
R
OH
O H
+
C OH2 + R
OH
2
C
O
R
C
O
L'ultimo passaggio rende IRREVERSIBILE l'intero processo
Sostituenti ad attrazione elettronica su R FACILITANO l'attacco del nucleofilo
e) Nitrili
I nitrili sono poco reattivi (meno delle ammidi): l’acqua da sola non reagisce)
-OH,
H2O oppure H2O, H+
12
In ambiente acido
Nu = H2O
+
R C N: + H
OH
tautomeria
H+ + R C N H
H+
O
:OH2
+
OH2
lento
+
R C N H
R C N H
+
R C N H
R C
NH2 H O
2
OH
+O H
R C
OH
R C NH2
+ OH
R C
O
R C
OH
PROSEGUE con l'idrolisi
acida delle ammidi
OH
O H
NH2
R C
+
R C NH2
+ OH
NH2
:OH2
+ OH
OH
H
NH2
+
R C +
OH
OH
2
H+
O
R C NH2
2
+ NH3
R C
OH
+ NH4+
L'ultimo passaggio rende IRREVERSIBILE l'intero processo
Sostituenti ad attrazione elettronica su R FACILITANO l'attacco del nucleofilo
2.
REAZIONE CON ALCOOLI
a) Acidi carbossilici
Nu = R’OH
In ambiente acido
+O H
O
+ H+
R C
OH
OH
OH
R C
+ OH
O H
R C+
OH
R C
OR'
H2O +
OH
R C OR'
+
lento
+
: O R'
H
OH
R C
OH
H
O
R C OR'
H
OR'
+
+
H+ + R C
O
OR'
2
La reazione intramolecolare è facile, se si formano anelli stabili (5 e 6 termini)
R
HO:
O
R CH CH2 CH2 C
γ
OH
Δ
H+
CH
H2O + CH2 O
CH2 C
γ-lattone
O
13
HO:
O
R CH CH2 CH2 CH2 C
δ
OH
Δ
R
CH2 CH
H2O + CH2
O
CH2 C
δ-lattone
O
H+
se l'OH è più vicino al carbossile, ci sono altri percorsi di reazione, più facili della
chiusura di un anello teso
R
Δ
HO
O
R CH CH2 C
+
OH H
β
CH O
CH2 C
O
O
R CH CH C
OH β-eliminazione
α
OH
R CH C
O
OH
OH
HO
C CH R
O
R
+
Δ H
O
CH C
O
CH
R
O
lattide
O
C
+ 2 H2O
se l'OH è più lontano dal carbossile, il prodotto dipende dalle condizioni di reazione
in soluzione molto diluita:
OH
OH
CH2CH2 CH2 CH2 CH2 CH2 C
O
Δ
O
O
H+
in soluzione concentrata:
OH
OH
n CH2 CH2 CH2 CH2 CH2 CH2 C
O
Δ
H+
O
(
O CH2 CH2 CH2 CH2 CH2 CH2 C
)
n
+ n H2O
b) Alogenuri acilici
-
O
R C
Cl
..
+ HOR'
lento
O +
R C OR'
Cl
H
O
R C
HCl
OH
E’ opportuno effettuare la reazione in presenza di una base (per HCl)
14
es.:
O
O
C
C
N
Cl + CH3CH2CH2OH
OCH2CH2CH3 +
N + ClH
c) Anidridi
-
O
R
C
R
C
O
..
O + HOR'
C
R
O
R
R
C
O H
+
O
O
O
C
R
+
OR'
O
R
+
+
O
C
R
OR'
Nu = -OR’’
+ -:OR"
R
H+
OR' R"OH
O
C OR"
+ -OR'
R C
OR"
OR'
In ambiente acido
R C
O-
lento
OR'
H
R C OR'
+
OR"
C
TRANSESTERIFICAZIONE
In ambiente basico
R C
O
OH
R
O
d) Esteri
O
-
C
H
OH
-
C OR'
R
C
O
O
O
H
OR'
+
Nu = R’’OH
+O H
R C
OR'
OH
R C +
OR"
O H
R C
+
OH
lento
OR'
: O R"
H
R C OR'
+ OR"
+ OH
+ R'OH
R C
OR"
H
O
R C
OR"
H+
15
e) Ammidi
3.
Essendo meno reattive, richiedono condizioni di reazione
troppo energiche per essere utili
REAZIONE CON AMMONIACA ED AMMINE
a) Acidi carbossilici
con
con NH
NH33
O
O
R C
R C
+ :NH3
OH
O-
NH4+
reazione acido-base
Scaldando il carbossilato di ammonio solido:
O
R C
Δ
NH4+ (solido)
O-
NH2
Meccanismo:
R C
O-
O
O
O- NH4
R C
+
O
R C
OH
+ :NH3
R
+ H 2O
O-
+
C NH3
C NH2
R
OH
O
R C
NH2
OH2
+
+ H2O
con
con ammine
ammine primarie
primarie
O
OH
O
R C
O-
O
+ RNH2
R C
RNH3+
R C
Δ
(solido)
O-
RNH3+
O
+ H2 O
R C
NH R
Meccanismo:
-
O
R C
RNH3+
O-
-
O
O
R C
OH
+ RNH2
C NH R
OH
+ 2
+
NH2 R
OH
O
R
R C
O
R C
NH R
+ H2O
16
con
con ammine
ammine secondarie
secondarie
O
R C
OH
O
R C
O-
O
+ :NHR2
R C
Δ
R2NH2+ (solido)
R2NH2+
O-
O
R C
NR2
+ H2 O
Meccanismo:
O
R C
O-
O
R
O-
O
R2NH2+
R C
+ :NHR2
OH
R
+
C NHR2
OH
O
C NR2
R C
+ H2 O
NR2
OH2
+
Se si ha un amminoacido con il gruppo amminico in γ o δ al carbossile, la
reazione è intramolecolare (si formano anelli a 5 o a 6 termini)
R
NH2
R
Δ
OH
CH CH2 CH2 C
γ
CH
CH2
H+
O
+ H2O
NH
γ-lattame
CH2 C
O
NH2
R CH CH2 CH2 CH2 C
δ
OH
Δ
O
H+
R
CH2 CH
CH2
NH
+ H2O
CH2 C
δ-lattame
O
se l‘NH2 è più vicino al carbossile, ci sono altri percorsi di reazione, più facili della
chiusura di un anello teso
R
CH NH
β
OH
H+
O
Δ
R CH CH2 C
NH2
CH2 C
O
OH
+ NH3
R CH CH C
β-eliminazione
O
17
b) Alogenuri acilici
Meccanismo:
R C
O
-
+
R C NH3
+ :NH3
Cl
R C
O
lento
O
O
+ 2 :NH3
O
R C
NH2
O
+ 2 R'NH2
O
+ NH4+Cl+ R'NH3+Cl-
R C
NH R'
Cl
R C
NH2
HCl
Cl
Cl
R C
O
R C
O
+ 2 R'R"NH
+ R'R"NH2+Cl-
R C
N R'
R"
Cl
c) Anidridi
O-
O
C
R
R
R
+ :NH
3
O
O
+
NH3
C
R
O
R
C
R
C
R
C
-
+
NH3 + R
C
NH2
O H
+
O
O
O
O
C
-
O
O
R
C
C
OH
NH2 + R
O
O
R
O
O
R
R
O
+ NH3
NH2
O
C
R
OH
+
O
O +NH
4
NH3 R
O
18
R
R
O
O
O
R
+ R'R"NH
O
R"
N R' R
+
R
O
-+
NH3 R
NH R' R OH
+ O
O
R
R
+ R'NH2
O
O
O
O +NH
4
R
OH NH3
O
NH4
O
O
Le anidridi cicliche danno immidi
O
O
O
..
O + 2 NH3
NH
.. 2
+ NH
3
OH
NH2
O+
NH4
O
anidride ftalica
O
O
O
Δ
NH
H2O
ftalimmide
O
O
:B-
O
NH
base debole, H acido
N
BH
O
-
O
d) Esteri
lento
O
R C
OR'
+ :NH3
-
O-
+
R C NH3
O
R
C
O
NH2
R C
+ R'OH
NH2
+ OR'
H
OR'
Gli esteri sono meno reattivi di alogenuri acilici e anidridi e perciòbisogna scaldare
O
+ H2N R"
R C
Δ
O
R C
NH R"
OR'
O
R C
+
OR'
HN R"
R'''
+ R'OH
Δ
O
+ R'OH
R C
N R"
R'''
19
4.
REAZIONE CON ACIDI CARBOSSILICI E CARBOSSILATI
Con questi nucleofili possono reagire solo I derivati acilici più reattivi
-
a) Alogenuri acilici
O
O
R C
R
O
+ R C
O-
Cl
R
O
C Cl
R C
O
C
R C
O
Cl-
O
O
OO
O
Cl
+O H
C
R
O
+ R C
R C
OH
O
R
R C
C Cl
O
R C
O
HCl
neutralizzato con una base
man mano che si forma
O
es:
O
CH3 CH2 CH2 C
Cl
O
+ CH CH CH C
3
2
2
O
C
N
CH3 CH2 CH2
OH
N
H
C
O
CH2 CH2 CH3
+ Cl-
b) Acidi carbossilici
(SOLO con acidi bicarbossilici in grado di formare
O
anelli stabili) O
C
C
Δ
CH2
OH
CH2
O
OH
CH2
CH2
C
C
H2O
O
O
2.
REAZIONE CON TIOLI
a) Alogenuri acilici
O-
O
R C Cl
R' +SH
+ R C
R' SH
Cl
O
R C
HCl
SR'
es:
O
O
CH3 CH2 C
+ CH3 CH2 SH
N
CH3 CH2 C
Cl
N+
H
S CH2 CH3
Cl-
20
6. REAZIONE CON COMPOSTI ORGANOMETALLICI
con
con reattivi
reattivi di
di Grignard
Grignard ee litioorganici
litioorganici
a) Esteri
O
δ - δ+
R' C OR" + R MgX
O- +MgX
O
R' C
R' C OR"
R
+
R"OMgX
R
da qui prosegue la reazione dei chetoni
O
R' C
δ- δ+
R + R MgX
O +MgX H O, H+
2
R' C R
OH
R' C R
R
R
i chetoni sono più reattivi degli esteri e perciò si arriva all'alcool terziario
es.:
MgBr
O
CH3 CH2 O C CH3 +
2
CH3 C
O- +Li
O
δ- δ +
+
R
Li
R' C OR"
OMgBr
R' C OR"
H2O, H+
CH3 C
OH
O
R' C
R + R"OLi
R
da qui prosegue la reazione dei chetoni
O
R' C
δ- δ+
R + R Li
O +Li
R' C R
H2O, H+
OH
R' C R
R
b) Cloruri acilici
O
R' C Cl
δ- δ+
+ R MgX
R
O- +MgX
R' C Cl
O
R' C
R + MgXCl
R
con accorgimenti sperimentali, è possibile fermare la reazione alla
formazione del chetone, altrimenti, si arriva ad alcool terziario
O
R' C
δ- δ +
R + R MgX
O +MgX H O, H+
2
R' C R
R
OH
R' C R
R
21
O
O
δ - δ+
+ R Li
R' C Cl
+Li
O
R' C Cl
R' C
+ LiCl
R
R
O
O +Li
δ- δ+
R + R Li
R' C
H2O, H+
R' C R
OH
R' C R
R
R
con
con cadmioorganici
cadmioorganici ee cuprati
cuprati organici
organici
Per fermare la reazione a chetone si devono usare:
composti organometallici meno reattivi
solo con i cloruri acilici
2 RMgX + CdCl2
R2Cd + MgCl2 + MgX2
(R = CH3, alchile primario, fenile)
esempio:
MgBr CdCl
2
Cd
-
O
O
+ CH3 CH2 C
Cd
O
CH3 CH2 C
Cl
Cl
δ- δ+
+ R CuLi
2
R' C Cl
O
CH3 CH2 C
O-
O
R' C
R' C Cl
R
R
es.:
O
O
C
C
Cl
CH3
+ (CH3)2CuLi
O
O
C
H
C C
CH3 CH
Cl
(CH3CH2)2CuLi
CH3
-78°C
H
C
C
CH3 CH
CH2
CH2
CH3
CH3
CH2 CH3
C
CH3
(feromone delle formiche)
92%
22
RIDUZIONI
a) Con idruro
LiAlH4
O
R C
R CH2 OH
OH
R C
O LiAlH4
Cl
R CH2 OH
LiAlH4
O
R CH2 OH
R C
OR'
LiAlH4
O
R CH2 NH2
R C
NH2
R C
LiAlH4
N
R CH2 NH2
Meccanismo:
+
AlH3 (Li )
+ H
H
O
O
-
O
R C
H2
+ R C
(Li+)
-
AlH3
O
-
Y = Cl, OR', OAlH3
O
O
R C
-:H
+
O
R C H
R C H
Y
+ Y-
Y
O
R C H
-
+
O-
-:H
R C H
H2 O
H
Y = NH2
O
R C
+
Y
-:H
OR C H
NH2
OH
R C H
H
OH
R C H
- NH
R C H + OH
NH
23
H
-:H
R C H +
R C H
H
N
+
H
R C H
- NH
NH
R C
H2 O
-:H
R C
-
N
NH2
H
-:H
+
R C
N
H
2 - 2 H2 O
R C
NH2
H
H
Diminuendo la reattività dell'idruro è possibile fermare ad aldeide la riduzione
dei CLORURI ACILICI
-
O
+ [(CH3)3CO]3AlH
R C
O
Li+
R
Cl
es.:
-
O
CH3 CH2 CH2 C
+ [(CH3)3CO]3AlH
C
H
O
Li+
CH3 CH2 CH2 C H
Cl
b) Con idrogeno e catalizzatore
H2, Pt
N
R C
R CH2 NH2
Con catalizzatore disattivato è possibile fermare ad aldeide la riduzione
degli ALOGENURI ACILICI
Pd, BaSO4
Pd, chinolina
N
O
R C
Cl
es.:
O
+ H2
R
C
H
O
O
C
Pd
C
Cl
H
+ H2
N
24
REAZIONI SPECIFICHE DELLE SINGOLE CLASSI DI GRUPPI FUNZIONALI
1.
Acidi carbossilici
(a) trasformazione del gruppo OH in buon gruppo uscente
OH
cattivo gruppo uscente
O
Per trasformarlo in buon gruppo uscente si possono utilizzare i
reagenti che trasformano -OH in -Cl
R C
Con agenti alogenanti
OH
R C
O
+ HCl + SO2
R C
O
Cl
OH
+ PCl5
R C
Cl
+ SOCl2
+ HCl + POCl3
R C
O
O
Cl
OH
+ PCl3
3R C
O
O
O
O
C
OH
+
CH3
Cl S Cl
esempi:
O
C
O
CH3 C Cl + HCl + SO2
O
C
OH + PCl
5
+ P(OH)3
3 R C
Cl + HCl + POCl
3
O
CH3 CH2 CH3 C Cl
O
CH3 CH2 CH3 C OH + PCl3
+ P(OH)3
Meccanismo con SOCl2:
O
O
CH3 C O S Cl
O
O
CH3 C OH + Cl S Cl
O
O
S Cl
C
O
CH3
+
CH3 C O
+
CH3 C O
+ HCl
-
+
O
O S Cl
O
CH3 C Cl + O S O
Con diazometano: CH2N2
O
R C
+
OH
-:
CH2
+
N
+
CH2 N
.. N:
-:
O
N
reazione acido-base
R C
Nu
O
+
CH3
sp3
+
N
+
CH2 N
N
N
ottimo gruppo uscente
25
O
N2
Con diazometano si formano esteri metilici
+ R C
O CH3
Con dicicloesilcarbodiimmide, DCC
O
+
R C
O H
N
O
C
C
R
C N
..
H2N R'
H
N
O
N
N
H
-
O
R
C
C
N
O
C
R' NH2
+
N
N
Nu
Addizione nucleofila
buon gruppo uscente
H
H
O
R
+
NH2 R' + O
C
O
N
C
R
N
C NH R' + HO
C
N
N
reazione acido-base
H
N
La DCC permette di ottenere ammidi dagli
acidi carbossilici in condizioni molto blande
O C
NH
dicicloesilurea
b) reazione in posizione α
OH
PBr3, Br2
R CH2 C
oppure
P + Br2
O
OH
Reazione HVZ
(Hell-Volhard-Zelinski)
R CH C
Br
O
α-alogenazione
Meccanismo:
..
OH
O
Br
Br
PBr3
R CH2 C
R CH C
R CH2 C
O
OH
gli alogenuri acilici enolizzano più facilmente degli acidi carbossilici
Il C=C addiziona Br2
26
OH
R CH C
Br
+
OH
R CH C +
Br
Br-
Br
Br
OH
H+
R CH C
O
R CH C
Br
Br
Br
Br
Br
Quando si lavora la reazione (aggiunta di acqua), il bromuro acilico è più reattivo di
quello alchilico. Oppure si possono aggiungere nucleofili
O
NH3
O
R CH C
H+
Br
R CH C
NH2
Br
O
O
ROH, H+
R CH C
2.
Br
Br
OH
H2O
R CH C
Br
OR
Esteri
Con alcossido (condensazione di Claisen)
CH3CH2O-Na+
O
2 CH3 C
OCH2 CH3
O
O
CH3 C CH2 C O CH2 CH3 + CH3CH2OH
L’alcossido DEVE essere identico al gruppo -OR dell’estere
Meccanismo:
(Na+)
O
CH3 C
E
O
-
+ CH3CH2O-Na+
O CH2 CH3
CH2 C
+ CH3CH2OH
O CH2 CH3
reazione acido-base
(equilibrio spostato a sinistra)
Nu
OO
C
-
+CH: 2
C
OC
O
C
C
C
O C
C
(equilibrio spostato a sinistra)
C O C C
O
C C
H2
O C
C
27
O
O
CH3
O
C
O CH2 CH3
CH2
+ CH3CH2O-
C
CH3
C
O
CH
-
C
O CH2 CH3
+ CH3CH2OH
(equilibrio spostato a destra)
H più acidi di quelli dell’estere di partenza
CH3
O
O
C
C
CH
(Na+)
O
O CH2 CH3
H2O
OH-
CH3
C
O
C
CH2 O CH2 CH3
E' possibile la condensazione incrociata, quando un solo estere ha H in α:
O
O
O
O CH CH
C
2
3
O
1. CH CH O-Na
C
3 2
CH2C O CH2CH3
+ CH3 C O CH2CH3 2. H+
qualsiasi carbanione è in grado di dare condensazione
O
NaNH2
H3C C C(CH3)3
O
(Na+) H2C C C(CH3)3
NH3
O
O
O
O
CH3 C CH
C(CH3)3
C
CH
+
CH
CH
CH
C
O
CH
C
2C
3
2
2
3
3
CH3
CH3
CH3CH2O-
3.
Ammidi
Con anidride fosforica, P2O5
O
R
C
R C N + H2O
NH2
Con con Br2 + NaOH (Trasposizione di Hofmann)
O
R C NH2 + Br2 + 4 NaOH
R-NH2 + 2 NaBr + Na2CO3 + 2 H2O
(oppure NaOBr, OH-)
meccanismo
O
R C NH2 +
O
R C
NH
-OH
O
-
R C NH + H2O
O
+ Br Br
R C NH Br +
N-bromoammide
Br-
28
O
+
R C NH Br
O
-OH
O
O
..
R C N
..
nitrene
..
N
..
C
H2O
+
Br-
R N C O
isocianato
OH H O
2
R N C O
R N C O + -OH
OH
- OH
R NH C O
OH
OH
R NH C O +
+
O
..R C N
.. Br
R
-
R C N Br
-OH
R NH C O
OH
R NH C O + H2O
O
O
+
R NH2 C O
O
OH
R NH C O
O
OH
O C O
O
R NH2 +
DECARBOSSILAZIONE
a) da carbossilati di metalli pesanti (reazione di Hunsdiecker)
O
O
R
C
+ Ag2O
C
OH
R
- +
O Ag
O
O
C
R
+ HgO
R
-)
O 2
Hg2+
O
O
C
C
R
OH
+ Pb(OCOCH3)4
R
OH
R
O
C
C
O )
Pb4+
4
Δ
+ Br2
O Ag+
(o I2)
R Br + CO2
I)
(R
29
meccanismo:
O
R C O
R
inizio
O
R C O Br
acil ipobromito
Br Br
:O:
O .. ..
C O
.. :
... Br
.. .
.. .
+ : Br
R C O
..
..
radicale carbossilato
:O:
.. .
R C O
..
propagazione
.
R
O
+
O
Br O C
R Br + R
R
b) da β-chetoacidi
R
R
C
Δ
O
O
O
.
R + O C O
O
R
OH
O
C
CH2
Δ
R
O
R
C
O
O
O
C
CH2
C
H
R
O
O
R
C
H
O
+
CH2
C
O
O
R
CH2
in ambiente basico:
+ CO2
CH3
#
H
H
..
.
O
..
C
O
C
C
CH3
O
O
CH2
C
O-
R
O
R
-
C
C
CH2
+ CO2
CH2
30
b) da acidi β-dicarbossilici
O
HO
H
Δ
O
C
C
O
CH2
HO
O
HO
C
C
#
O
O
O
C
CH2
+ CO2
CH3
HO
OH
H
O
HO
O
O
O
H
HO
H
O
C
+
C
CH2
O
O
HO
CH2
C
CH3
la decarbossilazione è favorita da sostituenti ad attrazione elettronica
SINTESI "ACETOACETICA"
OCH2CH3
C
CH2
+ CH2CH2OC
Na+
O
R"
O
Sfrutta l'acidità degli H in mezzo a due CO e la facile
decarbossilazione dei β-chetoacidi
O
C
OCH2CH3
-:CH
C
O
R X
R"
(Na+)
-O
C
OCH2CH3
sostituzione nucleofila
al C saturo
OCH2CH3
H2O, OHC
CH R
idrolisi
C
basica
O
R"
O
c'è ancora un H acido
(meno di prima )
(CH3)3C O - K+
O
C
-:C
OCH2CH3
R
R"
OCH2CH3
1. H+
C
O R1 OH2O, OH2. Δ
R1 C R
R" C C C
R"
idrolisi
C
O
R
CO2
basica
O
R"
O
H+
O
OH
R" C CH C
O
R
(K+)
R1 X
R"
O
OC CH C
O
R
neutralizzazione
(acido-base)
C
O
sostituzione
nucleofila
al C saturo
ecc.
CH
C
O
R"
Δ
decarbossilazione
O
C CH R
R1
O
R" C CH2 R
31
Scegliendo opportunamente il reagente R-X, si possono ottenere chetoni
con un altro gruppo funzionale
R-X = α-alogenoesteri
OCH2CH3
C
:CH
+
C
H3C
O
O
C
O
CH CH C O CH2 CH3
R CH C O CH2 CH3
Br
C
H3C
OH
Cβ β
O
O
α CH CH C OH
α
γ
2. H3O+
C R
H3C
O
1. NaOH, H2O
OCH2CH3
O
O
R
O
O
CH2 CH C OH
R
C
H
C
CO2
3
O
Δ
CH3 C CH2
O
O
CH C OH
R
γ-chetoacido
R-X = α-alogenochetoni
OCH2CH3
C
:CH
C
O
H3C
OCH2CH3
O
1. NaOH, H2O
CH CH2 C R
2. H3O+
C
H3C
O
O
O
O
C
O
Br CH2 C R
OH
C
O
α CH CH2 C R
βC
H3C
O
Δ
CO2
O
CH3 C CH2 CH2 C R
O
γ-dichetone
R-X = alogenuri acilici
Non si può usare come base CH3CH2ONa in CH3CH2OH, perché l'alogenuro acilico
è molto reattivo (e reagisce con l’etossido ed anche con l'etanolo)
32
OCH2CH3
OCH2CH3
O
C
C
NaH
CH2
:CH
+
C
C
H
O
H3C
2 H3C
O
O
Δ
1. NaOH, H2O
CH3 C CH2
2. H3O+
CO2
OCH2CH3
O
O
C
O
CH C R
R C
Cl
C
H3C
O
C R
O
O
β-dichetone
Con una base molto forte (ammide di sodio o di potassio) si possono
strappare due protoni.
Il dianione può essere fatto reagire con un equivalente di alogenuro alchilico
OCH2CH3
C
KNH2
CH2
C
NH3
O
CH3
O
OCH2CH3
C
- : CH
2 K+
C R
O
CH
.. 2
O
X
OCH2CH3
O
OCH2CH3
O
C
C
NH4+Cl
- : CH
CH2
C
C
O
O
CH2 R
CH2 R
per la neutralizzazione conviene usare l'acido coniugato del solvente
il β-chetoestere con catena allungata può essere utilizzato in tutte le reazioni viste in precedenza
SINTESI "MALONICA"
Sfrutta l'acidità del metilene tra due funzioni esteree e la facile decarbossilazione
degli acidi β-dicarbossilici
-O
O
OCH2CH3
C
CH2
+ CH2CH2OC
O
OCH2CH3
OCH2CH3
C
:CH
C
O
OCH2CH3
O
OCH2CH3
C
CH
-O C
OCH2CH3
O
"estere malonico"
OCH2CH3
C
R X
:CH
C
O
X
OCH2CH3
OCH2CH3
C
CH R
C
O
OCH2CH3
O
1. H2O, -OH
2. H O+
3
OCH2CH3
CH
C
O
OCH2CH3
propandioato dietilico
(malonato dietilico)
O
C
OH
C
CH R
C
O
OH
O
R
Δ
CO2
CH2
C
OH
O
acido acetico
α-sostituito
33
OCH2CH3
OCH2CH3
O
C
(CH3)3CO-K+
C
CH R
R C:
R' X
C
C
O
O
OCH2CH3
OCH2CH3
O
OCH2CH3
C
1. H2O, -OH
R C R'
2. H3O+
C
O
OCH2CH3 3. Δ , - CO
O
2
R'
O
C
R CH
OH
acido acetico α,α-disostituito
La reazione si può effettuare con tutti gli alogeno derivati utilizzati con il 3ossobutanoato di etile (estere acetoacetico)
alogenuri alchilici, alogenuri acilici,
α-alogenochetoni, α-alogenoesteri
altri esempi (che si possono usare anche nella sintesi acetoacetica:
R-X = α,ω-dialogenoalcani
O
O
OCH2CH3
C
CH2 + CH CH O- Na+
2 2
C
OCH2CH3
OCH2CH3
OCH2CH3
O
C
(CH3)3CO-K+
C
CH R
R C:
R' X
C
C
O
O
OCH2CH3
OCH2CH3
O
OCH2CH3
C
Na+ :CH
C
O
OCH2CH3
O
OCH2CH3
C
1. H2O, -OH
R C R'
2. H3O+
C
O
OCH2CH3 3. Δ , - CO
O
2
R'
O
R CH C
OH
acido acetico α,α-disostituito
La reazione si può effettuare con tutti gli alogeno derivati utilizzati con il 3ossobutanoato di etile (estere acetoacetico)
alogenuri alchilici, alogenuri acilici,
α-alogenochetoni, α-alogenoesteri
altri esempi (che si possono usare anche nella sintesi acetoacetica:
R-X = α,ω-dialogenoalcani
O
O
OCH2CH3
C
CH2 + CH CH O- Na+
2 2
C
OCH2CH3
OCH2CH3
C
Na+ :CH
C
O
OCH2CH3
O
34
a) in eccesso di estere
OCH2CH3
OCH2CH3
O
C C
:CH
:CH
Br ( CH2)n Br
C
C
O
O
OCH2CH3
OCH2CH3
O
1) H2O, OH2) H+
OH
O
OH
C
C
CH ( CH2 )n CH
C
C
O
O
OH
OH
O
Δ
OCH2CH3
O
OCH2CH3
C
C
CH ( CH2 )n CH
C
C
O
O
OCH2CH3
OCH2CH3
O
O
HO
CH2 ( CH2)n CH2 C
C
OH
O
2 CO2
acido bicarbossilico
b) in quantità equimolari
O
OCH2CH3
C
:CH Br ( CH ) Br
2n
C
O
O
O
OCH2CH3
C
C
C
OCH2CH3
OCH2CH3
O
C
CH2CH2OC
CH ( CH2 )n Br
:C ( CH2)n Br
C
C
O
O
OCH2CH3
OCH2CH3
O
OCH2CH3
(CH2)n
1) H2O, OH-
O
2) H+
OCH2CH3
O
C
C
C
OH
(CH2)n
Δ
OH
(CH2)n C
CO2
OH
C
n = 2,3,4,5
O
acidi cicloalcancarbossilici
35