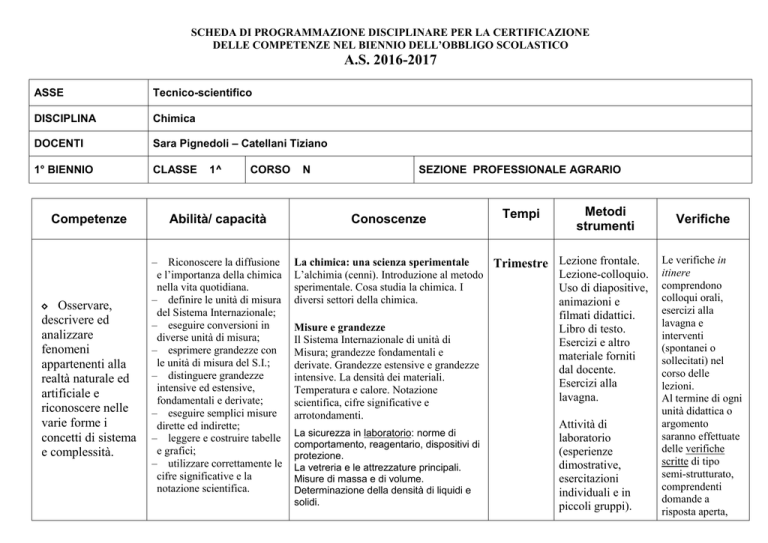
SCHEDA DI PROGRAMMAZIONE DISCIPLINARE PER LA CERTIFICAZIONE
DELLE COMPETENZE NEL BIENNIO DELL’OBBLIGO SCOLASTICO
A.S. 2016-2017
ASSE
Tecnico-scientifico
DISCIPLINA
Chimica
DOCENTI
Sara Pignedoli – Catellani Tiziano
1° BIENNIO
CLASSE
1^
CORSO
Competenze
Abilità/ capacità
Osservare,
descrivere ed
analizzare
fenomeni
appartenenti alla
realtà naturale ed
artificiale e
riconoscere nelle
varie forme i
concetti di sistema
e complessità.
– Riconoscere la diffusione
e l’importanza della chimica
nella vita quotidiana.
– definire le unità di misura
del Sistema Internazionale;
– eseguire conversioni in
diverse unità di misura;
– esprimere grandezze con
le unità di misura del S.I.;
– distinguere grandezze
intensive ed estensive,
fondamentali e derivate;
– eseguire semplici misure
dirette ed indirette;
– leggere e costruire tabelle
e grafici;
– utilizzare correttamente le
cifre significative e la
notazione scientifica.
◊
N
SEZIONE PROFESSIONALE AGRARIO
Conoscenze
Tempi
Metodi
strumenti
La chimica: una scienza sperimentale
Trimestre Lezione frontale.
Lezione-colloquio.
L’alchimia (cenni). Introduzione al metodo
sperimentale. Cosa studia la chimica. I
Uso di diapositive,
diversi settori della chimica.
animazioni e
Misure e grandezze
Il Sistema Internazionale di unità di
Misura; grandezze fondamentali e
derivate. Grandezze estensive e grandezze
intensive. La densità dei materiali.
Temperatura e calore. Notazione
scientifica, cifre significative e
arrotondamenti.
La sicurezza in laboratorio: norme di
comportamento, reagentario, dispositivi di
protezione.
La vetreria e le attrezzature principali.
Misure di massa e di volume.
Determinazione della densità di liquidi e
solidi.
filmati didattici.
Libro di testo.
Esercizi e altro
materiale forniti
dal docente.
Esercizi alla
lavagna.
Attività di
laboratorio
(esperienze
dimostrative,
esercitazioni
individuali e in
piccoli gruppi).
Verifiche
Le verifiche in
itinere
comprendono
colloqui orali,
esercizi alla
lavagna e
interventi
(spontanei o
sollecitati) nel
corso delle
lezioni.
Al termine di ogni
unità didattica o
argomento
saranno effettuate
delle verifiche
scritte di tipo
semi-strutturato,
comprendenti
domande a
risposta aperta,
– Classificare le sostanze in
base al loro stato fisico;
– descrivere i passaggi di
stato delle sostanza pure e
disegnare le curve di
riscaldamento e
raffreddamento;
– utilizzare le principali
tecniche di separazione dei
materiali.
Analizzare
qualitativamente e
quantitativamente
fenomeni legati
alle trasformazioni
di energia a partire
dall’esperienza.
◊
– Spiegare le differenze tra
una trasformazione chimica
e una trasformazione fisica;
– distinguere un elemento
da un composto;
– descrivere le proprietà di
metalli e non metalli.
Classificazione della materia
Materia e sostanze. I sistemi omogenei e i
sistemi eterogenei. Le sostanze pure e i
miscugli. Le soluzioni (cenni). I principali
metodi di separazione dei miscugli.
Gli stati di aggregazione della materia. I
passaggi di stato.
Laboratorio
Tecniche di separazione dei miscugli
(filtrazione, centrifugazione, estrazione
con solventi, cromatografia e distillazione).
Curve di riscaldamento di sostanze pure.
Le trasformazioni fisiche e chimiche
della materia
Fenomeni fisici e fenomeni chimici. Le
reazioni chimiche: concetti di reagente e
prodotto. Elementi e composti. Il
linguaggio della chimica: simboli e
formule. La tavola periodica degli
elementi
Laboratorio
Fenomeni che si osservano nelle reazioni
chimiche.
– Definire le tre leggi
ponderali della chimica;
– descrivere il modello
atomico di Dalton;
– Comprendere l’aspetto
quantitativo legato a una
reazione in accordo con la
legge della conservazione
della massa.
Le leggi ponderali che governano la
chimica
La conservazione della massa (la legge di
Lavoisier). La composizione dei composti
(la legge di Proust). La legge delle
proporzioni multiple di Dalton. La teoria
atomica di Dalton e le proprietà della
materia. La teoria cinetico-molecolare
della materia.
Laboratorio
Verifica della legge di Lavoisier.
Verifica della legge di Proust.
test a scelta
multipla,
risoluzione di
esercizi e
problemi.
Si valuterà,
inoltre, l’attività di
laboratorio
attraverso
l’elaborazione di
schede tecniche,
relazioni e grafici
e l’osservazione
dell’atteggiamento
e delle abilità
operative
raggiunte.
Si terrà conto,
infine, dell’uso e
cura del quaderno.
– Spiegare le proprietà delle
tre particelle che
compongono l’atomo;
– confrontare i modelli
atomici;
– identificare gli elementi
della tavola periodica
mediante il numero atomico.
–
La struttura dell’atomo
La natura elettrica della materia. Le
particelle fondamentali dell’atomo. I
modelli atomici di Thomson e Rutherford.
Numero atomico, numero di massa e
isotopi. La doppia natura della luce
(cenni). L’atomo di Bohr.
Rappresentare la
Distribuzione energetica degli elettroni
Essere
configurazione elettronica di
Il modello atomico a orbitali. Livelli e
consapevole delle
un elemento;
sottolivelli. La configurazione elettronica
potenzialità e dei
– spiegare la struttura
completa ed esterna degli elementi.
elettronica a livelli di
limiti delle
Laboratorio
energia dell’atomo;
tecnologie nel
Analisi chimica qualitativa: il saggio alla
contesto culturale e – definire i concetti di
fiamma e il saggio delle perle al borace.
“orbita” e “orbitale”.
sociale in cui
vengono applicate.
◊
– Spiegare la relazione tra
struttura
elettronica
e
posizione degli elementi
sulla tavola periodica;
– scrivere le strutture di
Lewis degli elementi;
– descrivere le principali
proprietà periodiche;
– descrivere le principali
proprietà
di
metalli,
semimetalli e non metalli.
Il sistema periodico
La moderna tavola periodica; periodi,
gruppi e principali famiglie di elementi
chimici. I simboli di Lewis. Le proprietà
periodiche degli elementi. Metalli, non
metalli e semimetalli.
– Effettuare calcoli con
l’uso della mole
– Acquisire il significato di
mole tramite esperienze di
laboratorio.
Il mondo micro e macroscopico
Massa atomica e massa molecolare, il
numero di Avogadro, unità di massa
atomica.Significato di mole.
Laboratorio
Uso di tavole periodiche interattive.
Variazione del raggio atomico per la
famiglia degli alogeni.
Laboratorio
Preparazione di soluzioni a concentrazione
Pentamestre
nota.
-
-
-
Solubilità e miscibilità delle
sostanze.
Introduzione all’equilibrio
chimico e alle teorie su acidi e
basi.
L’equilibrio dinamico,
la costante di
equilibrio.
Le teorie su acidi e basi,
ionizzazione dell’acqua.
Concetto di pH. Forza degli
acidi e delle basi. Calcolo di pH
di acidi e basi forti e deboli. La
tecnica della titolazione.