SCHEDA DI PROGRAMMAZIONE DISCIPLINARE PER LA CERTIFICAZIONE
DELLE COMPETENZE NEL BIENNIO DELL’OBBLIGO SCOLASTICO
A.S. 2016-2017
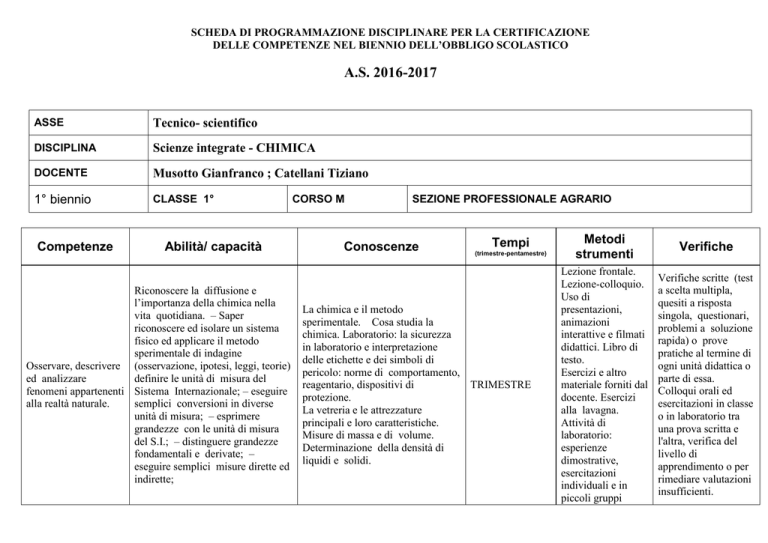
ASSE
Tecnico- scientifico
DISCIPLINA
Scienze integrate - CHIMICA
DOCENTE
Musotto Gianfranco ; Catellani Tiziano
1° biennio
CLASSE 1°
Competenze
Abilità/ capacità
Riconoscere la diffusione e
l’importanza della chimica nella
vita quotidiana. – Saper
riconoscere ed isolare un sistema
fisico ed applicare il metodo
sperimentale di indagine
Osservare, descrivere (osservazione, ipotesi, leggi, teorie)
ed analizzare
definire le unità di misura del
fenomeni appartenenti Sistema Internazionale; – eseguire
alla realtà naturale.
semplici conversioni in diverse
unità di misura; – esprimere
grandezze con le unità di misura
del S.I.; – distinguere grandezze
fondamentali e derivate; –
eseguire semplici misure dirette ed
indirette;
CORSO M
SEZIONE PROFESSIONALE AGRARIO
Conoscenze
Tempi
(trimestre-pentamestre)
La chimica e il metodo
sperimentale. Cosa studia la
chimica. Laboratorio: la sicurezza
in laboratorio e interpretazione
delle etichette e dei simboli di
pericolo: norme di comportamento,
reagentario, dispositivi di
TRIMESTRE
protezione.
La vetreria e le attrezzature
principali e loro caratteristiche.
Misure di massa e di volume.
Determinazione della densità di
liquidi e solidi.
Metodi
strumenti
Verifiche
Lezione frontale.
Lezione-colloquio.
Uso di
presentazioni,
animazioni
interattive e filmati
didattici. Libro di
testo.
Esercizi e altro
materiale forniti dal
docente. Esercizi
alla lavagna.
Attività di
laboratorio:
esperienze
dimostrative,
esercitazioni
individuali e in
piccoli gruppi
Verifiche scritte (test
a scelta multipla,
quesiti a risposta
singola, questionari,
problemi a soluzione
rapida) o prove
pratiche al termine di
ogni unità didattica o
parte di essa.
Colloqui orali ed
esercitazioni in classe
o in laboratorio tra
una prova scritta e
l'altra, verifica del
livello di
apprendimento o per
rimediare valutazioni
insufficienti.
classificare le sostanze in base allo
stato fisico; Descrivere i passaggi
di stato delle sostanza pure
utilizzare le principali tecniche di
separazione dei materiali.
Analizzare
qualitativamente e
quantitativamente
fenomeni legati alle
trasformazioni
Il Sistema Internazionale delle
unità di Misura. Temperatura e
calore. Le trasformazioni fisiche
della materia. Materia e sostanze.
I sistemi omogenei e i sistemi
Spiegare le differenze tra una
eterogenei. Le sostanze pure e i
trasformazione chimica e una
trasformazione fisica;
miscugli. Le soluzioni (cenni). Gli
distinguere un elemento da un
stati di aggregazione della materia.
composto; definire le leggi
I passaggi di stato. Laboratorio Le
ponderali della chimica;
principali tecniche di separazione
dei miscugli (filtrazione,
Spiegare le proprietà delle tre
centrifugazione, distillazione). Le
particelle che compongono l’atomo trasformazioni chimiche della
- confrontare i modelli atomici; materia Fenomeni fisici e
identificare gli elementi della
fenomeni chimici. Le reazioni
tavola periodica mediante il
chimiche: concetti di reagente e
prodotto. Elementi e composti.
numero atomico; disegnare le
strutture elettroniche dei principali
elementi;
Spiegare la relazione tra struttura
elettronica e posizione degli
elementi sulla tavola periodica.
Essere consapevole
delle potenzialità e
dei limiti delle
tecnologie nel
contesto culturale e
sociale in cui
vengono applicate
Descrivere le principali proprietà
periodiche.
Descrivere e comparare i diversi
legami chimici;
Stabilire la polarità dei legami
covalenti sulla base
dell’elettronegatività degli
elementi;
descrivere l’equilibrio chimico e
conoscere il concetto di costante di
equilibrio
Il linguaggio della chimica:
Simboli e formule. La tavola
periodica degli elementi.
Laboratorio: Fenomeni che si
osservano nelle reazioni chimiche.
Cenni sulle leggi della materia: La
conservazione della massa (la
legge di Lavoisier). La
composizione dei composti (la
legge di Proust). La teoria atomica
di Dalton e le proprietà della
materia. Laboratorio Verifica della
legge di Lavoisier. Le particelle
dell’atomo La natura elettrica della
materia. Le particelle fondamentali
dell’atomo. Cenni sui modelli
atomici di Thomson e Rutherford.
La valutazione terrà
conto degli obiettivi
specifici raggiunti,
della proprietà di
linguaggio tecnico,
delle capacità di
analisi e sintesi e non
potrà prescindere,
inoltre, dalle
peculiarità di ogni
singolo allievo e dalla
situazione di partenza
PENTAMESTRE
Riconoscere le sostanze acide e
basiche tramite l’uso di indicatori.
Misurare il pH di una soluzione
attraverso il pHmetro.
Saper distinguere gli acidi e basi
forti da quelli deboli: misurare la
concentrazione di acidi o basi
attraverso la tecnica della
titolazione.
Numero atomico, numero di massa
e isotopi.
La configurazione elettronica degli
elementi.
Laboratorio Analisi chimica
qualitativa: il saggio alla fiamma.
Il sistema periodico: la moderna
tavola periodica.
I simboli di Lewis. Le proprietà
periodiche degli elementi: metalli,
non metalli e semimetalli. I legami
chimici.
L’energia di legame. I gas nobili e
la regola dell’ottetto.
La scala dell’elettronegatività.
Il legame ionico. Il legame
covalente. Il legame metallico. Le
forze intermolecolari.
Molecole polari e non polari.
Cenni sulle forze intermolecolari
(forze di van der Waals e legame
idrogeno).
Laboratorio: solubilità e miscibilità
delle sostanze.
Introduzione all’equilibrio chimico
e alle teorie su acidi e basi.
L’equilibrio dinamico, la costante
di equilibrio. Le teorie su acidi e
basi, ionizzazione dell’acqua.
Concetto di pH.
Forza degli acidi e delle basi.
Calcolo di pH di acidi e basi forti e
deboli.
La tecnica della titolazione.
Laboratorio: Riconoscimento di
acidi e basi tramite indicatori
commerciali e indicatori naturali
preparati in laboratorio. Uso del
pHmetro e tecniche di taratura con
tamponi. Titolazioni acido base,
titolazioni di soluzioni a
concentrazioni incognite.
(*) le competenze elencate sono da intendersi valide per tutto il primo biennio.
(**) metodi e strumenti sono da intendersi validi per l’itero programma.
(***) le modalità e lo svolgimento delle verifiche sono gli stessi per l’intero programma.