Enzimi Prof Spina Riabilitativa Enzimi
Prof Spina Riabilitativa
2015 /2016
/
scaricato da www.sunhope.it
scaricato da www.sunhope.it
Gli enzimi
i i sono catalizzatori
t li
t i biologici
bi l i i molto
lt efficienti:
ffi i ti
caratterizzati da potere catalitico e specificità,
specificità
possegono una porzione dedicata: il sito attivo,
attivo
tutti gli enzimi sono proteine,
proteine con l’eccezione di
molecole di RNA cataliticamente attive,
legano con specificità diversa molte molecole di
cui promuovono la catalisi fornendo loro il giusto
orientamento e stabilizzando lo stato di transizione.
scaricato da www.sunhope.it
Gli enzimi sono
catalizzatori molto
efficaci.
Possono accellerare una reazione di migliaia
g
di
volte:
p p
porta la
L’anidrasi carbonica ad esempio
velocità di reazione da 1,3 x10-1 sec a 1 x 106
sec, con un potenziamento di 7,7 x106. Ogni
molecola
l
l di E può
ò id
idratare
t
105 CO2 all secondo
d
scaricato da www.sunhope.it
L specificità
La
ifi ità di un E è dovuta
d
t alla
ll
interazione con il substrato; ciò è reso
possibile grazie all’intricata struttura
tridimensionale della p. enzimatica, che
garantisce la corretta funzione dell’E.
Si consideri
id i che
h la
l DNA polimerasi
li
iI
introduce un nucleotide sbagliato
g
nella
catena meno di 1 volta su 1.000.000
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
Molti E hanno bisogno di
cofattori p
per svolgere
g
la loro
attività.
Apoenzima + Cofattore = Oloenzima
scaricato da www.sunhope.it
Cofattore
Enzima
Tiamina pirofosfato (B1)………………………………..................... Piruvato Deidrogenasi
Flavin adenin dinucleotide (B2)…………………………………….. Monoamina Ossidasi
Ni ti
Nicotinamide
id adenin
d i dinucleotide
di
l tid (niacina
( i i NAD).......................
NAD)
L tti Deidrogenasi
Lattico
D id
i
Piridossal Fosfato (B6)……………………………………………….. Transaminasi
Coenzima A (Ac. Pantotenico)………………………………………. Acetil CoA Carbossilasi
Biotina…………………………………………………………………… Piruvato Carbossilasi
Zn2+……………………………………………………………………… Anidrasi Carbonica
Mg2+……………………………………………………………………... Esochinasi
Mg2+……………………………………………………………………... Ureasi
scaricato da www.sunhope.it
Gli Enzimi convertono l’energia da
una forma all’altra
L’energia contenuta nei reagenti viene riconvertita con
elevata efficienza; ad es.
- Nella
N ll fotosintesi
f t i t i l’energia
l’
i radiante
di t della
d ll luce
l
è convertita
tit
in energia di un legame attraverso un gradiente ionico;
- nei mitocondri ll’energia
energia libera contenuta nelle molecole
dei nutrienti è convertita prima nell’energia libera di un
gradiente ionico poi in energia libera del legame del Pi
nell’ATP.
ll’ATP
- L’energia dell’ATP può essere usata in molti modi:in lavoro
meccanico (contrazione della miosina)
miosina), movimento
(trasporto di ioni o piccole molecole da un comparto
all’altro -pompe-ioniche)
scaricato da www.sunhope.it
Gli E vengono classificati in base al
tipo di reazione che catalizzano
•
•
•
•
•
Ossidoreduttasi – Ossidoriduzione es. LDH.
g pp es. NMPchinasi.
Transferasi – transf.di 1gruppo
Idrolasi – Reaz. di idrolisi es. Carbossilasi.
Liasi – Agg.
Agg o Rim.
Rim di un gruppo es.
es Fumarasi.
Fumarasi
Isomerasi – Trasferimento intramolecolare es.
Ti
Trioso
PI.
PI
• Ligasi – Unione di 2 substrati a spese di ATP
es.Aminoacil- transferasi.
scaricato da www.sunhope.it
L specificità
La
ifi ità di un E è dovuta
d
t
all’interazione con il substrato; ciò
è reso possibile dall’intricata
struttura tridimensionale della
proteina enzimatica, ciò
garantisce il corretto
funzionamento dell’E, si consideri
che
h la
l DNA polimerasi
li
i I introduce
i t d
un nucleotide sbagliato
g
nella
catena meno di 1 volta su
1
1.000.000
000 000
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
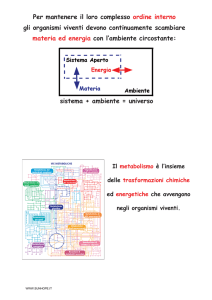
L’energia libera è la funzione
termodinamica + utile per capire gli E.
• Ri
Ricordiamo
di
b
brevemente
t che
h l’l’energia
i d
dell’universo
ll’ i
è
costante, (sistema + ambiente= K).
• L
L’entropia
entropia è il grado di ordine
ordine, entropia ordine; la
variazione di entropia dell’ ambiente sarà collegato
alla quantità di calore trasferita dal sistema.
• L’entalpia è il calore contenuto in un sistema.
• L’energia libera di Gibbs è in relazione alla differenza
di entalpia e di entropia del sistema tenendo conto
della T.:
• ∆G = ∆Hsist
i t - T ∆ssist
i tIn
I altre
lt parole
l una reazione
i
può
ò
avvenire spontaneamente solo se la variazione di energia
libera è negativa
scaricato da www.sunhope.it
Due proprietà termodinamiche di una reazione sono utili per
comprendere il funzionamento degli E.
• La differenza di energia libera ∆G tra i
prodotti P e i reagenti
p
g
Se
• L’energia richiesta per la conversione dei
reagenti nei corrispondenti stati di
transizione.
La prima determina se una reazione può
avvenire spontaneamente, la seconda
la velocità con cui avviene.
scaricato da www.sunhope.it
E+S
E S
ES
EP
E
E+P
P
Equilibrio Chimico e Velocità della
Reazione
scaricato da www.sunhope.it
∆G++: energia di attivazione
non
‘°
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
Quanto prodotto per unità di tempo è la velocità della reazione
scaricato da www.sunhope.it
LE MIGLIAIA DI REAZIONI CHE AVVENGONO
NEGLI ORGANISMI VIVENTI SI VERIFICANO
IN CONDIZIONI ESTREMAMENTE BLANDE E
AD UNA VELOCITÁ UTILE ALL'ECONOMIA
CELLULARE GRAZIE ALL'ATTIVITÁ
CATALITICA DI PROTEINE SPECIFICHE:
GLI ENZIMI
scaricato da www.sunhope.it
UNA REAZIONE CHIMICA AVVIENE PERCHÈ
È UNA
CERTA FRAZIONE DI MOLECOLE DI REAGENTE(I)
POSSIEDE, IN UN DATO ISTANTE, ABBASTANZA
ENERGIA PER RAGGIUNGERE UNA CONDIZIONE
ATTIVATA, A PIÚ ALTO CONTENUTO ENERGETICO,
DETTA
STATO D
DI TRANSIZIONE
N
NE
scaricato da www.sunhope.it
scaricato da www.sunhope.it
IL CATALIZZATORE SI LEGA
TRANSITORIAMENTE AL REAGENTE
FORMANDO UN COMPLESSO IL CUI STATO
DI TRANSIZIONE HA MINOR ENERGIA DI
QUELLO DELLA REAZIONE NON
CATALIZZATA.
scaricato da www.sunhope.it
•IN ANALOGIA CON GLI ALTRI
CATALIZZATORI, GLI ENZIMI:
1. ACCELERANO LE REAZIONI
2 ABBASSANO L'ENERGIA DI ATTIVAZIONE
2.
3 NON ALTERANO L'EQUILIBRIO
3.
L EQUILIBRIO DELLE
REAZIONI
scaricato da www.sunhope.it
A DIFFERENZA DEGLI ALTRI CATALIZZATORI
CATALIZZATORI, GLI
ENZIMI PRESENTANO:
1. UN ENORME POTERE CATALITICO
2 UN
2.
UN'ELEVATA
ELEVATA SPECIFICITÁ
3. LA POSSIBILITÁ DI ESSERE REGOLATI
scaricato da www.sunhope.it
LA VELOCITÁ
L
EL
DELLE REAZIONI
E
CATALIZZATE DAGLI ENZIMI È DA 103 A
1016 VOLTE MAGGIORE DI QUELLA DELLE
STESSE REAZIONI IN ASSENZA DI
ENZIMA.
scaricato da www.sunhope.it
H2O + CO2 <-----> HCO3- + H+
VELOCITÁ = 1
H2O + CO2 <
<----->
> HCO3- + H+
ANIDRASI CARBONICA
VELOCITÁ = 107
scaricato da www.sunhope.it
L'ANIDRASI CARBONICA È UNO DEGLI ENZIMI A
PIÙ ELEVATO NUMERO DI TURNOVER : OGNI
MOLECOLA PUÒ IDRATARE 6x105 MOLECOLE DI CO2
PER SECONDO
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
MODELLO
CHIAVE-SERRATURA
IL SITO ATTIVO DELL'ENZIMA HA UNA FORMA
COMPLEMENTARE A Q
QUELLA DEL SUBSTRATO
scaricato da www.sunhope.it
scaricato da www.sunhope.it
MODELLO DI
ADATTAMENTO INDOTTO
IL SITO ATTIVO ASSUME UNA FORMA
COMPLEMENTARE A QUELLA DEL SUBSTRATO
SOLO DOPO CHE QUESTO SI È LEGATO
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
CINETICA ENZIMATICA
STUDIA LA VELOCITÁ
DELLE REAZIONI
ENZIMATICHE.
ENZIMATICHE
scaricato da www.sunhope.it
VELOCITÁ
E' DEFINITA DAL NUMERO DI
MOLI DI PRODOTTO
P
CHE
E SI
FORMANO IN UN SECONDO.
SECONDO
scaricato da www.sunhope.it
VELOCITÁ INIZIALE (V0)
LA VELOCITÁ DEVE ESSERE
MISURATA A TEMPI BREVI,
QUANDO CIOÈ
È SI È CONSUMATA
SOLO UNA PICCOLA PARTE DEL
SUBSTRATO.
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
L' equazione di Michaelis-Menten può però essere manipolata
per ottenere l'l equazione di una retta in cui Vmax e Km siano
delle intercette e non più degli asintoti.
Uno dei metodi più usati e quello di Lineweaver-Burk che usa
la forma reciproca dell' equazione di Michaelis
Michaelis-Menten:
Menten:
ove le variabili sono 1/v e 1/[S]. 1/Vmax è l' intercetta sull' asse y e -1/Km
è l'l intercetta sull'
sull asse x.
x
scaricato da www.sunhope.it
1/Vmax è l' intercetta sull' asse y e -1/Km è l' intercetta sull' asse x.
scaricato da www.sunhope.it
Sia la trasformazione di Lineweaver-Burk
Lineweaver Burk che quella di
Eadie-Hofstee rendono più semplice e più accurata la
determinazione di Vmax e Km e permettono di scoprire
se l' enzima stia lavorando secondo una cinetica classica
(stato stazionario ed equilibrio rapido). L'uso di
trasformazioni lineari dell' equazione di Michaelis
MichaelisMenten sono inoltre particolarmente utili nello studio
degli inibitori reversibili
E + S ES
E+P
EE
scaricato da www.sunhope.it
E+S
ES
E +P
E+S
ES
E+P
scaricato da www.sunhope.it
Significato pratico della Km.
Il valore della Km è importante per varie ragioni:
La Km rappresenta approssimativamente il valore della
concentrazione intracellulare del substrato.
• Infatti p
per [[Sintracell] << Km,, l' enzima sarebbe
estremamente sensibile a variazioni della
concentrazione del substrato, ma gran parte del suo
potenziale
i l catalitico
li i sarebbe
bb iinutilizzato
ili
iin quanto iin
queste condizioni v<<Vmax.
a) Non avrebbe senso dal punto di vista fisiologico neppure
che [Sintracell] fosse >> Km, in quanto l' enzima pur
lavorando con una velocità vicino alla Vmax,, perderebbe
p
la possibilità di essere regolato da variazioni della
concentrazione del substrato.
scaricato da www.sunhope.it
Quindi
LA Km PUO’ ESSERE DEFINITA
COME
E QUEL
E VALORE
E DI
CONCENTRAZIONE DEL
SUBSTRATO A CUI:
LA REAZIONE PROCEDE AD UNA
VELOCITÁ
E
PARI A METÁ
E
DELLA
DE
Vmax
scaricato da www.sunhope.it
L'INIBIZIONE ENZIMATICA È
CLASSIFICATA IN DUE TIPI:
- IRREVERSIBILE
- REVERSIBILE
scaricato da www.sunhope.it
ESEMPIO TIPICO DI INIBITORE
IRREVERSIBILE È IL
DIISOPROPILFLUOROFOSFATO CHE SI
LEGA COVALENTEMENTE CON UN
RE D
RESIDUO
DI
D Ser DELLE PROTEASI
PR E
SERINICHE
scaricato da www.sunhope.it
scaricato da www.sunhope.it
INIBIZIONE REVERSIBILE
VIENE FONDAMENTALMENTE
DISTINTA IN DUE TIPI:
- COMPETITIVA
- NON COMPETITIVA
scaricato da www.sunhope.it
scaricato da www.sunhope.it
INIBIZIONE COMPETITIVA
L'INIBITORE PRESENTA ANALOGIA
STRUTTURALE CON IL SUBSTRATO
E QUINDI COMPETE CON QUESTO
PER IL SITO ATTIVO
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
INIBIZIONE NON COMPETITIVA
L'INIBITORE ED IL SUBSTRATO SI
POSSONO LEGARE
SIMULTANEAMENTE ALL'ENZIMA.
CIÒ SIGNIFICA CHE I SITI DI
LEGAME SONO DISTINTI.
scaricato da www.sunhope.it
scaricato da www.sunhope.it
INIBIZIONE SUICIDA
UN ENZIMA CONVERTE UN
SUBSTRATO IN UN INIBITORE
REATTIVO CHE IMMEDIATAMENTE
BLOCCA LA SUA ATTIVITÁ
CATALITICA.
scaricato da www.sunhope.it
POICHE'
E LA VELOCITÁ
E
Á DELLE
E E
REAZIONI CELLULARI DIPENDE
DAGLI ENZIMI, IL CONTROLLO
DELLA LORO ATTIVITÁ
RAPPRESENTA IL PIU’ IMPORTANTE
FATTORE DI REGOLAZIONE DEL
METABOLISMO.
scaricato da www.sunhope.it
scaricato da www.sunhope.it
LA VARIAZIONE DELLA
CONCENTRAZIONE DELL
DELL'ENZIMA
ENZIMA
O DELLE
SUE PROPRIETÁ CINETICHE
RAPPRESENTA IL MEZZO PIÙ EFFICACE
DI REGOLAZIONE.
REGOLAZIONE
scaricato da www.sunhope.it
scaricato da www.sunhope.it
E’ CHIAMATA TAPPA LIMITANTE
LA REAZIONE PIÙ LENTA CHE
CONDIZIONA LA VELOCITÁ
COMPLESSIVA DI UNA VIA
METABOLICA.
scaricato da www.sunhope.it
ALTRI IMPORTANTI FATTORI DI
REGOLAZIONE POSSONO ESSERE:
- ORGANIZZAZIONE DI SISTEMI
MULTIENZIMATICI
- COMPARTIMENTALIZZAZIONE
- TRASPORTO SELETTIVO DI
METABOLITI ATTRAVERSO LE
MEMBRANE
scaricato da www.sunhope.it
scaricato da www.sunhope.it
QUATTRO SONO I MECCANISMI
E
DI REGOLAZIONE DELL'ATTIVITÁ
ENZIMATICA:
-
ATTIVAZIONE DI ZIMOGENI
INTERCONVERSIONE
ALLOSTERISMO
REGOL Z ONE D
REGOLAZIONE
DA PARTE
P RTE DI
D
PROTEINE DI CONTROLLO
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
MODIFICHE POST-SINTETICHE
PIU’ FREQUENTI DELLE PROTEINE
- FOSFORILAZIONE
- ACETILAZIONE
- IDROSSILAZIONE
- METILAZIONE
- ADP-RIBOSILAZIONE
- UBIQUITINAZIONE
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
Teoria Chiave-Serratura
scaricato da www.sunhope.it
scaricato da www.sunhope.it
Gli isoenzimi forniscono un mezzo
di regolazione specifico di stadi di
sviluppo e tessuti distinti
• Diff
Differiscono
i
nella
ll sequenza di aa., ma
catalizzano la stessa reazione.
• Presentano di solito differenti parametri
p g
cinetici: Km e Vmax,, o differenti tipologie
di regolazione.
• Sono codificati da diversi loci genici: per
duplicazione e divergenza.
• Possono essere distinti per la di
diversa
ersa
mobilità elettroforetica.
scaricato da www.sunhope.it
GLI ENZIMI CHE CONSENTONO LA
DIGESTIONE
Indispensabile
p
p
per
l’utilizzazione delle p
proteine,
sono peptidasi o proteasi dette:
• endopeptidasi
d
tid i (quando
(
d
id li
idrolizzano
i legami
l
i
peptidici all’interno della molecola, generando
spezzoni polipetidici)
• esopeptidasi (quando attaccano il legame
peptidico
p
p
terminale della catena p
polipeptidica).
p p
I frammenti polipeptidici possono essere
ulteriormente
lt i
t demoliti
d
liti rimuovendo
i
d l’aminoacido
l’ i
id con
l’aminogruppo libero (aminopeptidasi) o quello con il
gruppo carbossilico libero (carbossipeptidasi).
(carbossipeptidasi)
Una dipeptidasi libera gli aminoacidi dai dipeptidi
scaricato da www.sunhope.it
LA DIGESTIONE PROTEICA AVVIENE IN TRE
FASI:
gastrica,, p
g
pancreatica,, intestinale.
Nel duodeno termina l’azione della pepsina
gastrica ed inizia quella degli enzimi del succo
pancreatico
ti
(t i i
(tripsina,
chimotripsina,
hi t i i
elastasi,
l t i
carbossipeptidasi).
Un sistema di enzimi secreti dall
dall’intestino
intestino
(duodeno e digiuno) è l’erepsina.
ASSORBIMENTO aminoacidi:
intestino>colon>stomaco
vena porta
t fegato
f
t
scaricato da www.sunhope.it