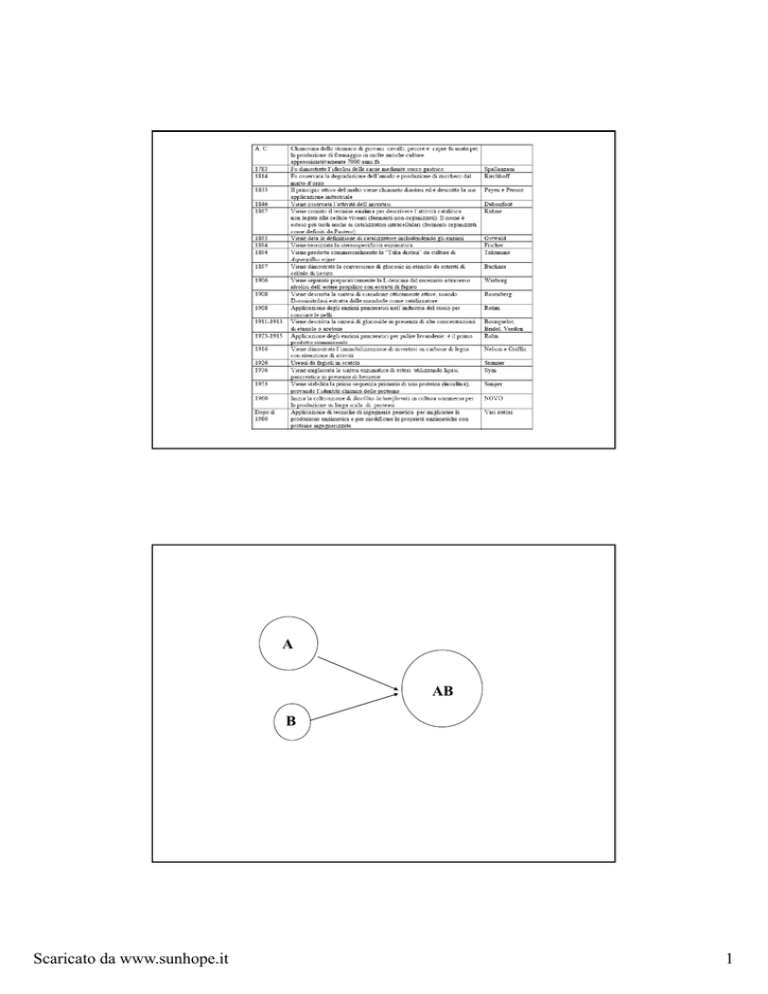
A
AB
B
Scaricato da www.sunhope.it
1
45
40
Numero di mole
ecole
1
2
3
4
5
6
7
8
9
35
1
2
5
20
40
20
5
2
1
1
2
5
20
40
23
12
6
1
30
25
20
15
10
5
0
0
Scaricato da www.sunhope.it
2
4
6
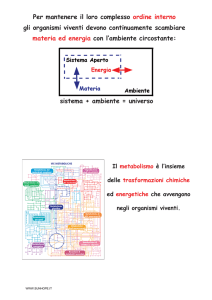
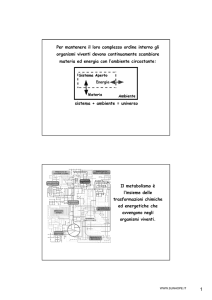
Energia
8
10
2
Scaricato da www.sunhope.it
3
Il sito attivo di un enzima si trova spesso in una fenditura o su una superficie piana irregolare.
Il riconoscimento del substrato è un processo dinamico, che non riguarda soltanto
l’associazione e la dissociazione del substrato, ma può coinvolgere anche movimenti della
catena proteica per adeguarsi al processo di legame con il substrato
•Il legame con il substrato cambia la struttura dell’enzima
•Il legame col substrato induce sottile ma importanti cambi della
dell’enzima
dell
enzima stessa che permettono la reazione.
reazione
distribuzione elettronica
Meccanismi catalitici
•Gli enzimi agiscono attraverso uno o più dei seguenti meccanismi:
• distorsione del substrato: per legarsi al sito attivo il substrato deve essere leggermente
distorto e questo favorisce la successiva trasformazione in prodotto;
• riduzione entropica: diminuzione dei moti molecolari relativi dei due substrati che
devono reagire, perché legati entrambi nel sito attivo;
• desolvatazione: aumento della forza delle interazioni deboli (legami ionici, idrofobici,
ponti H) tra 2 substrati per allontanamento delle molecole d’acqua intorno a loro;
• riduzione della diffusione dei prodotti intermedi: nei complessi multienzimatici, i
prodotti intermedi non abbandonano il complesso proteico (aumenta la velocità e
ll’efficienza
efficienza catalitica).
Scaricato da www.sunhope.it
4
Scaricato da www.sunhope.it
5
Scaricato da www.sunhope.it
6
G0= -RT lnKeq
Meccanismo di azione dell’enzima Cimotripsina
Quando il substrato si lega, la
catena laterale del residuo
adiacente al legame peptidico
che verrà idrolizzato si
inserisce in una tasca
idrofobica dell’enzima
L’interazione tra la ser 195 e His 57 genera
uno ione alcossido sulla ser 195
fortemente nucleofilo che attacca il gruppo
carbonilico del legame peptidico formando
un intermedio acil-enzima
Scaricato da www.sunhope.it
7
OH-
H2O
OH-
Scaricato da www.sunhope.it
H
8
Scaricato da www.sunhope.it
9
Tutti i coenzimi (molecole non proteiche necessarie alla funzione dell’enzima) contengono nella loro
molecola una parte vitaminica: il nostro organismo non è in grado di sintetizzare le vitamine, che devono
essere assunte con l’alimentazione. Una volta assorbite, le nostre cellule sono in grado di trasformarle
nei corrispondenti coenzimi. Data la fondamentale importanza degli enzimi nel consentire il
metabolismo si capisce perché la carenza di vitamine sia una condizione incompatibile con la vita.
K1
quantità di prodotto
E+S
K2
ES
K3
E+P
V 0 k 3ES
160
140
120
100
80
60
40
20
0
S1
S2
S3
0
10
20
30
40
Tempo
Scaricato da www.sunhope.it
10
E+S
K1
K2
K3
ES
E+P
V 0 k 3ES
Velocità di formazione di ES
ES K 1Et ES S
Velocità di demolizione di ES
ES K 2 ES K 3 ES
K 1Et ES S K 2ES K 3 ES
K 1Et ES S K 2ES K 3 ES
K 1Et S K 1 ES S K 2 K 3ES
K 1Et S K 1S K 2 K 3 ES
ES
Scaricato da www.sunhope.it
K 1Et S
K 1S K 2 K 3
11
ES
K 1Et S
K 1S K 2 K 3
ES
Et
E S
S K 2 K 3
K1
ES
ES
V0
Scaricato da www.sunhope.it
Et S
S Km
K 3Et S
S Km
Et S
S Km
V 0 K 3ES
V0
V max S
K m S
12
Scaricato da www.sunhope.it
13
LA VELOCITA’ MASSIMA, Vmax,
VIENE RAGGIUNTA QUANDO
TUTTI I SITI SONO
SATURATI DAL SUBSTRATO
EFFETTO DI
SATURAZIONE
LA Km PUO’ ESSERE DEFINITA COME
QUEL VALORE DI CONCENTRAZIONE DEL
SUBSTRATO A CUI:
LA REAZIONE PROCEDE AD UNA
VELOCITÁ PARI A METÁ DELLA Vmax
Scaricato da www.sunhope.it
14
LINEWEAVER E BURK HANNO ELABORATO
UN METODO PIÚ ACCURATO DI
DETERMINAZIONE DEI PARAMETRI
CINETICI, CHE CONSISTE NEL
RIPORTARE IN GRAFICO, NON V ED [S],
MA I LORO RECIPROCI 1/V e 1/[S].
GRAFICO DI LINEWEAVER-BURK
O DEI DOPPI RECIPROCI
COSÍ FACENDO SI TRASFORMA
L'EQUAZIONE DI UNA IPERBOLE
ELL EQ
E DI
D UNA RETTA
E
NELL'EQUAZIONE
Scaricato da www.sunhope.it
15
V maxS
V0
Km S
1 Km S
V 0 V maxS V maxS
Scaricato da www.sunhope.it
1 Km S
V 0 V maxS
1 Km 1
V 0 V maxS V max
16
Scaricato da www.sunhope.it
17
Scaricato da www.sunhope.it
18
Scaricato da www.sunhope.it
19
Scaricato da www.sunhope.it
20
Scaricato da www.sunhope.it
21
Scaricato da www.sunhope.it
22