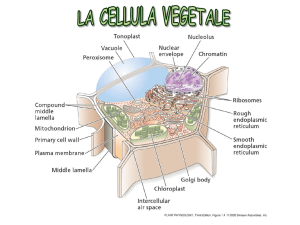
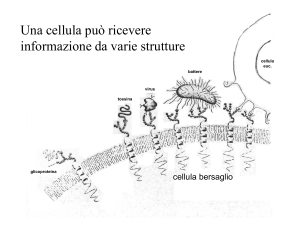
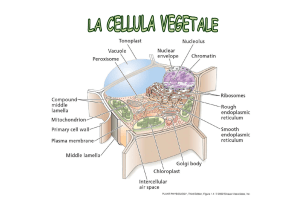
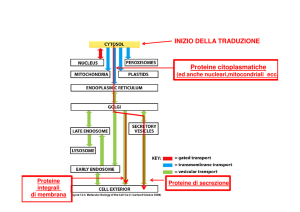
www.slidetube.it
TERMOREGOLAZIONE
OMEOTERMI (mammiferi e uccelli): sono in grado di mantenere la temperatura corporea costante (37
più o meno 1°C per l‟uomo) indipendentemente dalla temperatura esterna.
ETEROTERMI (rettili e pesci): non sono in grado di termoregolarsi; la loro temperatura dipende
dall‟ambiente.
ENDOTERMI: pesci che posseggono organi di riscaldamento il cui calore prodotto viene diffuso dal
circolo sanguigno a specifici organi o apparati.
Gli organismi producono calore attraverso reazioni chimiche:
1) Anaboliche: richiedono calore (endotermiche);
2) Cataboliche: producono calore (esotermiche). Tra le reazioni cataboliche ad esempio ricordiamo
l‟ossidazione di zuccheri e lipidi che danno energia che in parte viene immagazzinato sotto forma di
ATP, mentre il 50% dell‟energia viene liberata sotto forma di calore.
In condizioni di riposo (basali) c‟è produzione di calore, e avvengono per lo più reazioni esotermiche
che endotermiche.
METABOLISMO BASALE (1400-1800 calorie) o TERMOGENESI OBBLIGATA: tale calore è
prodotto involontariamente sotto controllo ormonale (ormoni tiroidei) e sotto il controllo delle
catecolamine che hanno un ruolo secondario.
- Il sistema di termoregolazione è costituito da: ipotalamo, ipofisi e tiroide. I termoreattori registrano la
temperatura dei vari organi e del sangue; se c‟è perdita di calore il sistema di termoregolazione induce
termogenesi per mantenere la temperatura costante (si accelera il metabolismo basale)
TERMOGENESI FACOLTATIVA: produzione di calore in eccesso a quello basale; durante la
termoregolazione aumentano gli ormoni tiroidei, si ha contrazione della muscolatura scheletrica, e
vasocostrizione per non disperdere calore.
Gli ormoni tiroidei hanno due tipi di recettori:
1) DI MEMBRANA: stimolano il catabolismo di glucidi e lipidi;
2) INTRACELLULARI: che attivano la trascrizione genica, favorendo l‟espressione di geni necessari
per la termogenesi: - ATPasi, che portano ad un eccesso di ADP e fosfato che stimolano il catabolismo
di lipidi e glucidi; - Aumento di espressione di proteine disaccoppianti (termogenine).
Gli ormoni tiroidei possono poi modificare i flussi ionici: possono aumentare la produzione di canali
per il calcio, che è necessario per la regolazione delle ATPasi.
La produzione di calore può avvenire anche con il brivido (contrazione involontaria della muscolatura
scheletrica). Se ci troviamo in un ambiente caldo, il nostro organismo tende ad assorbire calore, e vi
sono meccanismi di termodispersione, in particolare vasodilatazione, ma anche sudorazione ed
evaporazione.
L‟evaporazione avviene anche attraverso le vie respiratorie oltre che con il sudore.
SISTEMA DI TERMOREGOLAZIONE
E‟ un complesso sistema di coordinato di tipo neuroendocrino (ipotalamo, regione preottica) e
ormonale.
SISTEMA NEUROENDOCRINO (modello di Hammell):
- Neuroni “W“: neuroni recettivi che percepiscono le variazioni (aumento) di temperatura;
- Neuroni “I“: neuroni insensibili, che agiscono su due tipi di neuroni effettori (insieme ai W): neuroni
“w” che innescano la termodispersione e neuroni “c” che innescano la termoconservazione (rilascio di
ormoni tiroidei e vasocostrizione).
Quando la temperatura è 37°C, gli stimoli inibitori ed eccitatori su entrambi i neuroni effettori si
equilibrano. Al di sopra dei 37°C (febbre) i neuroni “W” prevalgono sui neuroni “I”, per cui si ha
inibizione della termoconservazione e prevalenza della termodispersione.
L‟abbassamento della temperatura, desensibilizza i neuroni “W” e prevalgono i neuroni “I”.
IPERTERMIE DI TIPO NON FEBBRILE
Il sistema di termoregolazione non è alterato, ma non riesce a far fronte ad un eccesso di calore.
Sono dovute a:
- Eccessiva produzione di calore;
- Possono avere causa esogena (colpo di sole, colpo di calore in cui l„elevata temperatura ambientale
stimola l„organismo a disperdere il calore con il sudore, ma l„evaporazione è ostacolata dall„umidità
atmosferica: il paziente continua a disperdere invano acqua ed elettroliti andando incontro a
disidratazione, ipovolemia, aumento dell„ematocrito fino allo shock emodinamico) o endogena (cioè
dipendente da condizioni patologiche come ipertiroidismo, o ipertermia maligna).
IPERTIROIDISMO T3 regola la termogenesi: induce sintesi di ATPasi, e espressione di proteine
disaccoppianti; in eccesso di T3 tutta l‟energia che si libera dalla degradazione dei lipidi, proteine e
glucidi resta sotto forma di calore.
In pazienti ipertiroidei si ha: vasodilatazione, eccessiva sudorazione, insofferenza al caldo,
incrementato appetito.
IPERTERMIA MALIGNA
E‟ una malattia autosomica dominante dovuta a mutazioni congenite del gene RYR1 (canale per il
calcio, presente sul reticolo sarcoplasmatico dei muscoli scheletrici, accoppiato al canale diidropirinico
dei tubuli T che funge da “sensore di voltaggio“). C‟è alterazione dei canali per il calcio; in particolare
i canali fanno difficoltà a richiudersi, e questo comporta un aumento del calcio citoplasmatico.
L‟ipertermia maligna può essere indotta da anestetici.
Il calcio in eccesso attiva le ATPasi, e questo comporta produzione di calore e in alcuni casi
rabdomiolisi ovvero danno muscolare.
IPERTERMIE FEBBRILI
Alterato funzionamento di tutto il sistema neuroendocrine ipotalamico della termoregolazione, con
assestamento della temperatura di riferimento a valori superiori a quelli fisiologici. Ciò è dovuto
all‟azione di citochine pirogene e prostaglandine E2.
1) PIROGENI ESOGENI:
- Endotossine dei batteri Gram negativi: proteine fosfolipido-polisaccaridiche termostabili legate alla
parete batterica con legami non covalenti, che vengono rilasciate in acqua;
- Endotossine dei batteri Gram positivi;
- Peptidoglicano di stafilococco.
2) PIROGENI ENDOGENI:
Sono citochine prodotte dal sistema monocito-macrofagico e da neutrofili. La produzione di pirogeni
endogeni è indotta da pirogeni esogeni, ma anche dal sistema del complemento o dai complessi
antigene-anticorpo (immunocomplessi).
Si distinguono in:
- Diretti: alcune citochine quali IL-1 e TNF;
- Indiretti: GMCSF che stimola produzione di IL-1 e TNF;
- Modulatori: INF- , induce febbre (è pirogeno), ma inibisce la produzione di IL-1 e TNF;
- Antipirogeni: IL-4 e IL-6.
Le citochine agiscono come pirogeni a bassa concentrazione (10-100 mg/kg).
Vi sono due ipotesi:
1) La prima, dice, che non potendo le citochine oltrepassare la barriera emato-encefalica, indurrebbero
la produzione di PGE2 negli endoteliociti; la PGE2, che è un potente pirogeno, verrebbe liberato nel
lato encefalico dove agirebbe su neuroni termoregolatori.
2) La seconda ipotesi invece, contrariamente alla prima, dice che le citochine riuscirebbero a
oltrepassare la barriera ematoencefalica e indurrebbero la sintesi di PGE2 direttamente dai neuroni che
producono a loro volta IL-1, AUTO-amplificando la produzione di PGE2.
MECCANISMI DI INIBIZIONE DEI FENOMENI FEBBRILI: Quando le citochine raggiungono alte
concentrazioni nel sangue scattano meccanismi di “down-regolazione”:
1) Riduzione dei recettori sulle cellule bersaglio;
2) Produzione di recettori circolanti che sequestrano citochine nel sangue;
3) Produzione di proteine antagoniste a IL-1, che si legano ai recettori per citochine (hanno un‟affinità
maggiore).
DECORSO DELLA FEBBRE
1) Rialzo termico:
- Incremento della termogenesi (rapido o lento in risposta a PGE2), ridotta termodispersione
(vasocostrizione);
- Sintomi: brividi, sensazione di freddo, pallore, aumento della pressione arteriosa, aumento della
frequenza cardiaca (otto pulsazioni per ogni grado, a causa di un aumentato metabolismo).
2) Fastigio:
- La temperatura si assesta a un valore di riferimento più alto.
- Sintomi: cessano brividi e freddo, permane l‟aumento della frequenza cardiaca e vasodilatazione da
pirogeni endogeni. (quindi: cessano i brividi e la sensazione di freddo, ma tutto il resto permane!).
3) Defervescenza:
- La temperatura di riferimento torna normale per CRISI (cioè gradualmente) o per LISI (cioè
bruscamente). Nella defervescenza, i pirogeni esogeni vengono eliminati.
- Sintomi: caldo, vasodilatazione.
Le prostaglandine spengono (nella fase di rialzo termico) la funzionalità dei neuroni “W”; rimangono
solo i neuroni “I” che tendono a stimolare i neuroni “c”(termoconservazione) e inibiscono i neuroni
“w”(termodispersione).
Al perdurare della presenza di PGE2, i neuroni “W” ricominciano a funzionare, però si trovano in
un ipotalamo surriscaldato, per cui riconoscono come valore normale (di riferimento) la nuova
temperatura raggiunta; il sistema di termoregolazione nella fase di fastigio funziona ma è “settato” a
una temperatura superiore.
Quando PGE3 diminuisce, i neuroni “W”si risensibilizzano alla nuova temperatura e mettono in atto
meccanismi termodispersivi.
QUINDI:
1) Rialzo termico: La PGE2 spegne i neuroni “W”;
2) Fastigio: I neuroni “W”nell‟ipotalamo surriscaldato si risensibilizzano, ma riconoscono come valore
normale la nuova temperatura;
3) Defervescenza: i sistemi di inibizione abbassano PGE2 e citochine; i neuroni “W” si resettano alla
temperatura normale e si ha termodispersione.
TIPI DI FEBBRE
1) CONTINUA: Il rialzo termico è rapido ed improvviso. La temperatura si mantiene elevata per tutto
il periodo “fastigio” con variazioni giornaliere di 1°C (es. salmonella, pneumococco).
2) REMITTENTE: Il decorso, caratterizzato da intense variazioni giornaliere che non raggiungono mai
la defervescenza, con fastigio prolungato, correla con i cicli proliferativi dello streptococco
-emolitico.
3) INTERMITTENTE: si alternano periodi di apiressia più o meno ampi (malaria);
4) INTERMITTENTE QUOTIDIANA: con apiressia serale.
5) INTERMITTENTE TERZANA;
6) INTERMITTENTE QUARTANA;
7) RICORRENTE: è caratterizzata da picchi febbrili (talvolta con ipopiressia) alternati a giorni di
apiressia. Il decorso correla col ciclo proliferativo del plasmodio (Plasmodium Vivaxfebbre terzana;
Plasmodium Malariae febbre quartana).
8) ONDULANTE: febbre ricorrente con rialzi molto graduali.
9) ERRATICA: un picco di temperatura elevata nella giornata (cistite per E.Coli), che scompare senza
lasciare tracce apparenti..
TERAPIA
1) Antinfiammatori steroidei: glucocorticoidi con doppia azione inibiscono la produzione di IL-1 e
TNF e inibiscono la fosfolipasi A2, che quindi non può produrre acido arachidonico.
2) FANS, come ad esempio l‟aspirina, che inibisce la via delle ciclossigenasi e non viene prodotta
PGE2.
FISIOPATOLOGIA DEL SISTEMA INTEGRATO
IPOTALAMO-IPOFISARIO
Ipotalamo e ipofisi sono strettamente connessi dal punto di vista anatomo-funzionale; costituiscono
l‟asse fondamentale che garantisce la regolazione della secrezione della maggior parte degli ormoni,
rendendo conto delle influenze del SNA sulla secrezione degli ormoni ipofisari e delle rispettive
ghiandole bersaglio.
Il controllo nervoso della funzione endocrina è esercitato appunto da: SNA, neurotrasmettitore e
ormoni ipofisitropi (che interferiscono con attività dell‟adenoipofisi).
La regolazione della secrezione endocrina da parte del SNA è per la maggior parte dei casi di tipo
indiretto, cioè attivata da terminazioni colinergiche ed adrenergiche della rete vascolare ghiandolare
che modulando l‟afflusso ematico possono influire sulla secrezione ormonale:
Term.nervose
che afferiscono
all‟ipofisi:
Ach
GH
PRL
o
(((((((((dipen
de
LH-FSH
TSH
ACTH
=
DA
GABA
Adrenalina
Noradrenalin
a
=
=
o
o
L‟influenza diretta viene invece subita da:
- Epifisi (ghiandola pineale): situata in prossimità della parte posteriore del corpo calloso; parenchima
costituito da pinealociti (ormono-secretori) ed elementi gliali costituenti lo stroma.
Va incontro ad un processo di calcificazione eterotipica.
Sintetizza melatonina (prodotta anche dall‟ipotalamo) con ritmo circadiano (ogni 24 ore), con picchi
durante le ore notturne, cioè quando la retina non è esposta alle radiazioni luminose. Infatti la sintesi
dell‟enzima N-acetiltransferasi che trasforma 5-idrossitriptamina in melanina è modulata tramite
recettori -adrenergici della noradrenalina rilasciata da terminazioni simpatiche della ghiandola.
Segnali luminosi che partono dalla retina sono integrati nei neuroni soprachiasmatici che vanno ai
gangli cervicali del midollo spinale dove avviene la connessione con neuroni adrenergici che portano
impulsi all‟epifisi. Dopodichè avviene l‟inibizione della stimolazione adrenergica.
Mentre è buio si ha liberazione di grandi quantità di noradrenalina.
Effetti della melatonina:
- Riduzione della concentrazione ematica di LH e GH;
- Inibisce il rilascio di GnRH dai neuroni ipotalamici che stimola il rilascio di gonadotropine;
- Favorisce la comparsa del sonno quando gli occhi non sono esposti alla luce;
- Gli estrogeni inducono la liberazione di noradrenalina nell‟epifisi. Questo porta alla diminuzione della
concentrazione di melatonina.
1) MIDOLLARE DEL SURRENE: costituita da feocromociti e cellule parenchimali. Ghiandola
innervata da una rete di fibre colinergiche che liberano Ach stimolando la liberazione di adrenalina e
noradrenalina dalle cellule parenchimali (fibre postgangliari modificate).
2) RENE: a livello dell‟apparato juxtaglomerulare produce renina, la cui secrezione è regolata non solo
dalla concentrazione di sodio, pressione arteriosa, ma anche da stimolazione adrenergica ( 1) che
induce rilascio dell‟ormone tramite attivazione dei recettori . Sempre sotto il controllo -adrenergico
si trovano la secrezione di paratormone, eritropoietina, insulina e glucagone.
IPOTALAMO E NEUROIPOFISI
Nuclei sopraottico e ventricolare (ipotalamo anteriore) secernono:
ADH-VASOPRESSINA: trasportato per via assonica alla neuroipofisi che costituisce l‟organo di
deposito e di rilascio di ADH nel sangue.
La secrezione di ADH è attivata da un aumento dell‟osmolalità plasmatica registrata dagli osmocettori,
neuroni dei nuclei sopraottico e paraventricolare dell‟ipotalamo, capaci di avvertire variazioni minime
dell‟osmolalità plasmatica, che sono più o meno dell‟1% rispetto al valore di riferimento
(290mOsm/Kg).
A livello renale l‟ADH lega il recettore V2 ( Proteina Gs) si attiva l‟adenilato ciclasi questo porta
ad un aumento dell‟AMP ciclico di conseguenza le vescicole citoplasmatiche delle cellule principali
dei dotti collettori, caratterizzate dalla presenza di specifici canali di membrana per l‟acqua
(acquaporina-2), si fondono con la membrana cellulare. Questo porta ad un aumento della permeabilità
all‟acqua, aumento del riassorbimento di acqua dal fluido tubulare e diminuzione dell‟osmolalità
plasmatica, con conseguente urina ipertonica.
La secrezione di ADH è inibita da afferenze sensoriali provenienti da recettori di volume presenti
nell‟atrio destro e nelle grandi vene (il cui volume dipende dallo stato di riempimento del circolo).
Questo porta ad un aumento della volemia (con ripristino della normale osmolalità plasmatica) con
conseguente aumento della scarica afferente dai recettori di volume; diminuisce la secrezione di ADH,
e il rene elimina grandi quantità di acqua per ripristinare i volumi dei liquidi corporei ai valori normali.
DIABETE INSIPIDO: provocato da deficiente sintesi e/o rilascio di ADH (tipo neurogeno) o da
incapacità del rene di rispondere all‟azione ormonale (tipo nefrogeno) per mancata sintesi o alterazione
dei recettori per ADH. Sindrome caratterizzata da poliuria a comparsa brusca o graduale, con
escrezione di urina diluita; i pazienti emettono generalmente 5-10 litri di urina al giorno.
OSSITOCINA: provoca contrazione della muscolatura liscia uterina, contrazione della muscolatura
liscia della mammella associata a secrezione del latte. La scomparsa del latte in fase post-partum può
essere dovuta ad un‟azione inibitoria da parte dello stress sull‟ipotalamo, che causa un deficit nella
secrezione dell‟ossitocina.
Nuclei ipotalamici-ipofisitropi (ipotalamo posteriore) i cui neuroni sintetizzano diversi ormoni peptidici
riversati nei capillari del plesso primario dell‟eminenza mediana dai quali attraverso il sistema portale
ipofisario raggiungono l‟adenoipofisi (trasformando dunque un impulso nervoso in impulso ormonale).
Gli ormoni ipofisitropici, sono dotati tutti di breve emivita.
TRH (fattore rilasciante tireotropine) stimola la secrezione di TSH e prolattina;
GnRH (fattore rilasciante gonadotropine) stimola la secrezione di LH e FSH;
CRH (fattore rilasciante corticotropina) stimola la secrezione di ACTH;
GHRH (fattore rilasciante ormone della crescita) stimola la secrezione di GH;
Dopamina (PIF= fattore inibente la prolattina) inibisce la secrezione di prolattina;
Somatostatina inibisce la secrezione di GH, TSH, prolattina.
Gli ormoni esercitano sul SNC un effetto:
- diretto: interagendo con i recettori specifici espressi dai neuroni;
- indiretto: quando i neuroni subiscono le conseguenze della variazione della concentrazione di
molecole o ioni indotte dagli effetti suscitati dalle cellule bersaglio dall‟azione ormonale.
* BARRIERA EMATOENCEFALICA: la membrana ematoencefalica fa si che la composizione del
liquido cefalorachidiano si mantenga costante, grazie alla morfologia dei capillari della membrana che
sono di tipo continuo senza fenestrazioni, con cellule endoteliali unite fra loro da giunzioni strette,
rivestite da prolungamenti astrocitari con interposizione di una lamina basale. Tali capillari sono
attraversati solo dalle molecole liposolubili per diffusione semplice e da atre molecole solo attraverso
trasporto attivo. Il passaggio di peptidi e altre macromolecole dal SNC all‟organismo e viceversa
avviene solo in corrispondenza di quelle zone in cui i capillari encefalici non formano la barriera e
corrispondono a “filtri neuroematici” costituiti da capillari fenestrati che consentono il passaggio di
ormoni.
ADENOIPOFISI
L‟ipofisi situata nella sella turcica, consta di due lobi, uno posteriore (neuroipofisi, costituita
prevalentemente dagli assoni provenienti dall‟ipotalamo) direttamente connesso per mezzo del gambo
infundibolare all‟ipotalamo, e uno anteriore (adenoipofisi, collegato all‟ipotalamo per via vascolare
tramite il sistema portale).
L‟adenoipofisi è costituita da vari citotipi ognuno dei quali è fornito di una specifica attività
ormono-sintetica:
- Cellule cromofobe: resistenti alla colorazione;
- Cellule Acidofile: che si dividono in somatotrope (GH) e mammotrope (PRL);
- Cellule Basofile: che si dividono in tireotrope (TSH), gonadotrope (LH e FSH) e corticotrope
(ACTH).
Gli ormoni sintetizzati da ciascun citotipo vengono conservati in granuli secretori e rilasciati per
esocitosi.
REGOLAZIONE DELLA SECREZIONE DEGLI ORMONI
Gli ormoni adenoipofisari hanno ognuno per bersaglio specifico una determinata ghiandola endocrina
periferica nella quale innescano un segnale che stimola la biosintesi ed il rilascio di ormoni.
Ciascun ormone periferico rilasciato nel sangue esercita:
- meccanismo di “corto feedback negativo o positivo” a livello dell‟adenoipofisi, ossia quando la
concentrazione dell‟ormone periferico raggiunge un valore soglia l‟adenoipofisi viene bloccata nella
funzione di rilascio.
- meccanismo di “lungo feedback negativo o positivo” agendo sull‟ipotalamo, stimola o blocca, a
seconda della concentrazione plasmatica raggiunta, il rilascio dell‟ormone ipofisitropi attivo sulle
cellule adenoipofisarie che rilasciano ormone glandotropo preposto al rilascio di esso.
Quando la concentrazione periferica dell‟ormone è elevata, la risposta ipotalamica può consistere anche
nel rilascio di un fattore inibente.
Gli ormoni adenoipofisari esercitano:
- meccanismo di “cortissimo feedback negativo” a livello dei nuclei ipotalamici, cioè quando la
concentrazione plasmatica degli ormoni adenoipofisari supera il valore soglia essi vanno ad inibire la
loro ulteriore secrezione.
1) ORMONE DELLA CRESCITA (GH)
Polipeptide derivante da precursore inattivo, pre-GH; codificato dal gene situato sul cromosoma 17 è
sintetizzato dalle cellule somatotrope dell‟adenoipofisi.
Il catabolismo avviene a livello epatico e renale.
GH esercita importanti effetti sulla crescita dell‟organismo regolandone il metabolismo. Si distinguono:
-Effetti diretti (dovuti alla molecola GH): crescita delle cartilagini di coniugazione; proliferazione
cellulare di tutti gli organi; stimolazione della sintesi proteica (ritenzione di sodio e azoto); iperglicemia
e lipolisi. A livello delle cartilagini agisce sui pre-condrociti stimolandone la differenziazione e
proliferazione; durante la differenziazione i precondroblasti producono IGF-1 ed espongono IGF-1R
maturazione dei condrociti allungamento delle cartilagini epifisarie.
- Effetti indiretti, mediati da IGF-1 (fattore insulino-simile) prodotto a livello epatico e da tessuti
periferici. Stimola la sintesi proteica; coopera con GH nella crescita lineare delle ossa; determina
ipoglicemia e lipogenesi; in seguito a captazione di glucosio a livello muscolare ed epatico, con
deposizione di acidi grassi sotto forma di trigliceridi.
Regolazione:
- Aumento della concentrazione di IGF-1: diminuzione della secrezione di GH con feedback negativo a
livello ipofisario; aumentata liberazione di somatostatina (inibitore di GH) a livello ipotalamico.
- Diminuzione della concentrazione di IGF-1: diminuzione della liberazione di somatostatina; aumento
della secrezione di GHRH.
- Aumento della concentrazione di GH: aumento della liberazione di somatostatina.
Anche estrogeni, noradrenalina e dopamina modulano la sua secrezione che avviene con ritmo pulsatile
con picco nelle ore notturne. Nel sangue GH viene trasportato da proteina carrier.
2) PROLATTINA (PRL)
Circola nel sangue legata ad una proteina carrier; la sua secrezione avviene in maniera ritmica con
picchi durante il sonno. Dopo crisi puberale, la prolattina potenzia effetti stimolanti sul sistema
dutto-alveolare della ghiandola mammaria esercitati da altri ormoni (estrogeni, progesterone, GH,
insulina) che non si verificano nei maschi per inibizione da parte del testosterone.
La concentrazione di prolattina aumenta durante gravidanza e allattamento ed il suo effetto sulla
secrezione lattea si manifesta dopo il parto contemporaneamente diminuisce la concentrazione di
estrogeni e progesterone. Lo stimolo fisiologico per la secrezione di prolattina è rappresentata dalla
suzione del capezzolo; il riflesso della suzione determina inibizione della liberazione di dopamina e
aumento di fattori stimolanti la secrezione di prolattina.
Sembra inoltre che la prolattina interferisca a livello gonadico con ricezione dei segnali innescati da
gonadotropine.
Regolazione:
- Aumento della concentrazione di prolattina: attivazione dei recettori espressi dai neuroni
dopaminergici ipotalamici; questo porta alla sintesi e alla liberazione di dopamina, che attraverso il
sistema portale ipotalamo-ipofisario, giunge all‟ipofisi legandosi a recettori D2 presenti sulle cellule
mammotrope; dopodichè si ha inibizione della secrezione di prolattina (meccanismo feedback
cortissimo negativo).
DOPAMINA = (PIF: fattore inibente la secrezione di prolattina).
Altri fattori inibitori sono: GABA, somatostatina, calcitonina.
Altri fattori stimolanti sono: TRH, ossitocina, VIP.
Anche se le cellule mammotrope hanno notevole capacità secretoria spontanea regolazione è
sostanzialmente soppressione tonica mediata dall‟ipotalamo.
3) ORMONE CORTICOTROPO (ACTH)
Rilasciato in circolo, interagisce con recettori presenti nella zona fascicolata e reticolare del
corticosurrene (proteine Gs), con conseguente trasformazione del colesterolo in pregnenolone
steroidogenesi surrenalica stimolazione della sintesi proteica.
La regolazione di ACTH è sotto il controllo di segnali provenienti da centri nervosi superiori innescati
da eventi stressanti (dolore, emozioni, traumi, ipoglicemia) che stimolano il rilascio di CRH
dall‟ipotalamo.
Inoltre se aumenta la concentrazione di cortisolo diminuisce la secrezione di CRH e di ACTH.
L‟azione di CRH (emivita 60 minuti) sulle cellule corticotrope è potenziata dalla vasopressina (azione
CRH simile) e angiotensina II, mentre è inibita dall‟ossitocina.
Il rilascio di CRH avviene in maniera pulsatile con ritmo circadiano nelle prime ore del mattino in cui
si ha secrezione di ACTH e cortisolo.
Quando la concentrazione di cortisolo supera il valore soglia, attraverso feedback negativo riduce
l‟intensità di ciascuna gittata pulsatile, sia a livello ipofisario che ipotalamico, ma non abolendone il
ritmo pulsatile.
La concentrazione di cortisolo è bassissima tra le 22.00 e le 2,00 con picco massimo al risveglio.
4) ORMONE TIREOTROPO (TSH): glicoproteina costituita da subunità alfa e beta, di cui beta risulta
specifica; interagisce con specifici recettori espressi dai tireociti (con conseguente aumento di AMP
ciclico).
L‟ipotalamo stimola la secrezione di TSH tramite TRH, la inibisce tramite somatostatina.
Inoltre gli ormoni tiroidei esercitano meccanismi a feedback negativo sia a livello ipofisario che a
livello ipotalamico, quando superano il valore soglia.
5) GONADOTROPINE (LH, FSH): la secrezione di LH e FSH da parte dell‟ipofisi viene stimolata da
parte di GnRH ipotalamico (secrezione pulsatile). Steroidi gonadici e inibina (ormone gonadico)
esercitano feedback negativo a livello ipofisario e ipotalamico.
L‟aumento della concentrazione degli estrogeni esercita feedback positivo a livello ipotalamico con
aumento di escrezione di GnRH, di conseguenza si ha aumento di liberazione di LH e FSH (picco
preovulatorio). FSH stimola la sintesi e il rilascio di inibina, che esercita sull‟adenoipofisi e
sull‟ipotalamo un meccanismo di feedback negativo nella secrezione di gonadotropine e GnRH.
* Nell‟ovaio: l‟FSH induce sviluppo maturativo del follicolo con successiva increzione di estrogeni
(anche LH). LH favorisce l‟ovulazione in seguito alla quale stimola autonomamente la formazione del
corpo luteo e la produzione di progesterone.
* Nel testicolo LH agisce sulle cellule del Leyding stimolando la sintesi di testosterone.
IPOPITUITARISMI
Condizioni patologiche caratterizzate dall‟insufficiente o assente produzione di uno o più ormoni da
parte dell‟adenoipofisi.
Si definiscono primari se l‟alterazione anatomo-patologica ha sede nell‟adenoipofisi, secondari se la
disfunzione riguarda l‟ipotalamo.
L‟eziologia è pleomorfa anche se viene innescato un comune meccanismo patogenetico corrispondente
ad una lesione comprimente o distruente la ghiandola o le connessioni ipotalamo-ipofisarie o alcuni
nuclei ipotalamici.
- IPOPITUITARISMI MONOTROPICI (deficit della biosintesi di un singolo ormone): la deficienza
monotropica di GH può essere congenita o acquisita nella prima infanzia.
Forma congenita: bambini normali alla nascita e ritardo nella crescita durante il primo anno di vita 1)
nanismo ipofisario: riduzione dell‟accrescimento staturale, altezza inferiore a 1,40m, ridotto ma
armonico sviluppo di tutti gli organi; terapia: hGH ricombinante; caratteristica diminuzione di IGF-1.
Ci sono poi forme di nanismo dovute a secrezioni di GH funzionante inattivo.
2) deficienza monotropica di ACTH: sintomatologia di tipo Addisoniano, può essere primaria o
secondaria ad insufficiente secrezione ipotalamica di CRH. Può associarsi a iposecrezione di LPH.
- PANIPOPITUITARISMI (deficienza di tutti gli ormoni ipofisari): possono essere, dell‟età evolutiva:
- quadri clinici vari; coinvolge in prima istanza gonadotropine e GH, quindi il paziente presenta aspetto
eununcoide, arti di lunghezza sproporzionata rispetto al tronco con assenza di caratteri sessuali
secondari.
Vi sono anche forme dell‟adulto:
- sindrome di Sheehan: forma acuta conseguente a una necrosi ipofisaria causata da grave emorragia
post-partum in un contesto di iperplasia gravidica dell‟ipofisi.
Durante il parto l‟ipofisi raggiunge dimensioni doppie rispetto al normale, ma a questo non segue un
adeguato aumento della vascolarizzazione per cui si ha necrosi (in più durante il parto si ha emorragia e
quindi la vascolarizzazione diminuisce ancora.
La sintesi degli ormoni viene ridotta secondo l‟ordine: gonadotropine, TSH, ACTH, MSH, GH, questo
causa una sintomatologia a carico dell‟apparato genitale con comparsa di manifestazioni
maxi-edematose, ipocorticosurrenalismo, riduzione ipotonica delle masse muscolari.
Se c‟è alterazione anche della neuroipofisi si ha diabete insipido.
IPERPITUITARISMI
L‟iperfunzione dell‟adenoipofisi può essere:
- idiopatica;
- secondaria ad un‟alterazione ipotalamica, costituita da aumento della secrezione degli ormoni
ipofisitropi.
Può anche derivare da una diminuzione della funzione delle ghiandole bersaglio che quindi causa
un‟alterazione del meccanismo di feedback negativo.
Comunque quasi tutte le iperfunzioni sono correlate ad un tumore iperfunzionante.
IPERPROLATTINEMIA: causata da:
- adenoma funzionante (prolattinoma);
- adenoma non funzionante (craniofaringioma che comprimendo in qualche punto il sistema
portale-ipofisario impedisce alla dopamina di giungere alle cellule ipofisarie;
- uso di farmaci che riducono l‟inibizione dopaminergica (origine iatrogena).
Quadro clinico: galattorrea e amenorrea anovulatoria nella donna e galattorrea e impotenza nell‟uomo,
precedute da diminuzione della libido.
Sintomi di deficit degli apparati genitali maschili e femminili sono conseguenza di in ipogonadismo
ipogonadotropico in cui c‟è diminuzione della concentrazione degli ormoni gonadici dovuta a:
- inibizione esercitata dalla prolattina sulle cellule gonadotrope dell‟adenoipofisi;
- diminuzione della secrezione di GnRH;
- diminuzione della risposta alle gonadotropine.
IPERPRODUZIONE DI GH:
Causata da adenoma ipofisario funzionante che secerne in eccesso GH (somatotropinoma).
Determina due sindromi caratterizzate da due diverse età di esordio:
- gigantismo: tipico dell‟infanzia, consiste in un eccessivo accrescimento staturale con abnorme
lunghezza degli arti superiori e inferiori causata dall‟eccessiva stimolazione esercitata dal GH sulle
cartilagini epifisarie.
Si associa a ipogonadismo.
- acromegalia: tipica dell‟età adulta, dovuta a ipersecrezione cronica di GH; poiché le cartilagini
epifisarie sono già saldate, l‟accrescimento osseo si verifica nel senso dello spessore, viene interessato
soprattutto il cranio, la mandibola e le estremità degli arti causando la caratteristica facies leonina nei
pazienti affetti.
Oltre alle ossa si accrescono i visceri (macroglossia, splancnomegalia, cardiomegalia); sudorazione
profusa con astenia.
Inoltre si hanno iperinsulinismo e intolleranza al glucosio, ipogonadismo, ipersurrenalismo,
ipotiroidismo.
Le cellule adenomatosi rilasciano GH continuamente nel corso delle 24 ore con ritmo pulsatile
disordinato, non risentono dell‟azione inibitrice sull‟azione di GH esercitata dal glucosio né, quella
stimolatoria data da ipoglicemia.
MORBO DI CUSHING
Iperpituitarismo primario da corticotropinoma o iperpituitarismo secondario da iperplasia delle cellule
corticotrope in coseguenza di un tumore ipotalamico CRH secernente.
Si verifica un‟eccessiva POMC (pro-opio-melanocortina), precursore dell‟ACTH, MSH e
Beta-endorfine. I sintomi sono quelli tipici dell‟ipercortisolismo (sindrome di Cushing).
SINDROME DI NELSON
Iperpituitarismo primario dovuto alla presenza di un corticotropinoma a rapida crescita che insorge nel
30% circa dei pazienti affetti da sindrome affetti da sindrome di Cushing sottoposti a surrenectomia
bilaterale per il trattamento chirurgico delle sindromi di Cushing.
Alcuni sostengono che la comparsa del corticotropinoma sia secondaria ad insufficiente terapia
sostitutiva con glucocorticoidi che quindi causa iperplasia delle cellule corticotrope ipofisarie e quindi
una neoplasia.
TUMORI IPOFISARI
Per la maggior parte benigni (adenomi) e possono essere funzionanti (secernenti):
- somatotropinoma;
- corticotropinoma;
- gonadotropinoma.
E poi ci sono quelli inattivi (non secernenti, cioè con cellule prive di granuli di secrezione).
ASPETTI FISIOPATOLOGICI DELLA TIROIDE
È una ghiandola endocrina a forma di farfalla situata nel collo, ventralmente alla trachea. Consta
normalmente di due lobi laterali globosi congruenti medialmente uniti da un istmo; è comune la
presenza del lobo piramidale, residuo del dotto tireoglosso, da cui origina l‟intera ghiandola.
L‟unità funzionale è il follicolo, di forma vagamente sferica, costituito da cellule follicolari disposte a
delimitare una cavità contenente colloide: è qui che avviene la sintesi e il deposito di ormoni tiroidei.
Del parenchima fanno parte anche le cellule C che sintetizzano ossitocina.
ORMONI TIROIDEI: prodotti dalle cellule follicolari sotto stimolo del TSH adenoipofisario che
incrementa la sintesi ormonale (effetto immediato) e la captazione dello iodio (effetto ritardato).
Lo ioduro plasmatico viene attivamente captato (“pompa dello iodio”), ossidato ed incorporato nei
residui tirosinici di tireoglobuline in posizione 3‟ e 5‟ a formare MIT e DIT. La tireoglobulina iodata è
riversata nella colloide dove avviene la condensazione delle tirosine iodate (DIT+MIT = T3; DIT+DIT
= T4).
Sotto stimolo ipotalamo-ipofisario, si ha la pinocitosi della colloide: nei fagolisosomi si ha la
liberazione degli ormoni tiroidei per lisi enzimatica delle Ig. T3 e T4, diffondono attraverso la
membrana plasmatica nel sangue dove viaggiano legate a proteine carrier: TBA, TTR(transtiretina),
TBG, lipoproteine.
In periferia, gli ormoni si liberano dai trasportatori e penetrano per diffusione nelle cellule bersaglio.
T4 è degradato in T3; nel nucleo si legano ai rispettivi recettori ed espletano il loro ruolo di modulatori
dell‟espressione genica.
Tra i loro effetti si ricordano:
- aumento del metabolismo basale e termogenesi ( = aumento ATP-asi, aumento del consumo di ATP e
aumento di reazioni cataboliche).
- stimolazione del corretto sviluppo intellettivo;
- controllo della contrattilità e ritmicità cardiaca.
CONTROLLO DELLA FUNZIONE TIROIDEA
-TSH Interagendo con i recettori di membrana espressi dai tireociti, attiva l‟Adenilato Ciclasi con
incremento di cAMP attivazione della fosfolipasi C con aumento del Calcio e fosfoinositolo.
L‟effetto del TSH è difasico, si manifesta con effetti immediati (aumento della sintesi ormonale) e con
effetti tardivi (aumento della captazione dello iodio e della sintesi della tireoglobulina). La stimolazione
protratta con TSH induce anche fenomeni di iperplasia e ipertrofia cellulare. La secrezione di TSH è
inibita da T3 e T4.
-TRHSecreto dall‟ipotalamo stimola la secrezione del TSH.
-BLOCCO DI WOLFF-CHAIKOFF Consistente nella inibizione dell‟organificazione dello iodio,
provocata dalla presenza di un eccesso di ioduro nel parenchima ghiandolare.
IPERTIROIDISMO
Condizione patologica di iperfunzionalità tiroidea, generalmente associata all‟aumento di
concentrazione di T3 e T4 (= tireotossicosi) e al conseguente stato ipermetabolico che si divide in:
- primario: conseguente ad alterazioni intrinseche della tiroide;
- secondario: causato da processi extratiroidei (es. adenoma ipofisario TSH secernente).
Sintomatologia: nervosismo, palpitazioni, polso celere, astenia, debolezza muscolare, ingrossamento
variabile della tiroide, aumento della sudorazione, modificazioni oculari (esoftalmo). Tale
sintomatologia è riferibile ad uno stato ipermetabolico, dovuto ad un eccesso di ormoni, ed a
iperattività del simpatico aumenta la contrattilità del miocardio e il fabbisogno di ossigeno
aumenta la gittata cardiaca tachicardia. La cute appare arrossata, calda per vasodilatazione periferica
necessaria per disperdere l‟aumento del calore dovuto a un aumento del motabolismo. Diagnosi:
Dosaggio T4 libera + TSH
Terapia: Beta-bloccanti, cianamide (blocca sintesi ormonale).
Morbo di Graves-Basedow: è la causa più comune di ipertiroidismo primario. È una malattia
autoimmune dovuta alla presenza nel plasma di diversi autoanticorpi: quelli anti-TSH-R sono
fondamentali nella patogenesi della malattia perché mimano l‟azione dell‟ormone tireotropo
stimolando l‟ipertrofia, l‟iperplasia e l‟iperfunzionalità tiroidea. Sono presenti inoltre Ig stimolanti la
crescita tiroidea, Ig inibenti leganti TSH (impediscono il legame del TSH al suo recettore andando a
mimare l‟effetto del TSH stesso), quindi lo stimolo iniziale per la reazione autoimmune può essere o un
meccanismo di mimica molecolare o di autoimmunità primitiva T-cellulare (le cellule T riconoscono le
proteine MHC esposte dalle cellule epiteliali tiroidee in associazione ai peptidi elaborati derivati da
antigeni tiroidei e si attivano). Questi elementi T attivati collaborano con le cellule B stimolandone
l‟elaborazione di una serie di autoanticorpi tiroide-specifici compresi quelli contro il recettore TSH.
La malattia ha probabilmente un substrato genetico (associazione con HLA-BB, DR3 ed alcuni
polimorfismi CTLA4) che è causa della perdita di tolleranza dei linfociti T helper.
Si manifesta tra i 20 ed i 40 anni, soprattutto nelle donne, con sintomi quali: gozzo tossico diffuso,
oftalmopatia (infiltrazione linfocitaria del connettivo retro-orbitario e dei muscoli estrinseci dell‟occhio
che comporta esoftalmo), mixedema tibiale (ispessimento del derma per deposizione di
glicosaminoglicani e infiltrato linfocitario), stato ipermetabolico associato ad ipertermia, sudorazione,
tachicardia, tachipnea, tremori, perdita di peso e polifagia.
Morbo di Plummer: ipertiroidismo primario non autoimmune, dovuto ad adenomi secernenti della
tiroide, TSH-indipendenti. Si manifesta gozzo nodulare (o multinodulare) tossico e con sintomi simili
al morbo di Graves, ma meno marcati.
IPOTIROIDISMO
Condizione patologica capace di interferire con l‟adeguata secrezione di ormoni tiroidei. Se insorge
durante la prima infanzia o l‟adolescenza determina cretinismo (ritardo mentale e deficit di sviluppo).
Si divide in:
- primario: conseguente ad alterazioni intrinseche della tiroide (es. agenesia, ablazione chirurgica,
distruzione autoimmune, difetti congeniti dell‟ormonosintesi).
- secondario: conseguente ad alterazioni ipotalamo-ipofisarie.
Tiroidite di Hashimoto: è la causa più comune di ipotiroidismo nei paesi con sufficiente apporto di
iodio nella dieta. È una malattia autoimmune dovuta alla progressiva distruzione cellulo-mediata (T
helper macrofagi; CTL, NK ADCC) ed umorale (autoanticorpi) del parenchima tiroideo che viene
sostituito da tessuto fibroso non funzionante. Si ipotizza un substrato genetico (associazione con
HLA-DR3, DR5). Fondamentalmente sono implicati nella patogenesi i linfociti T, nonostante si vada a
riscontare la presenza di anticorpi anti-tireociti, infatti i linfociti T riconoscono antigeni presenti su
cellule tiroidee associati a molecole MHC riconoscendoli come self. Inoltre c‟è una diminuzione dei
linfociti T soppressori associata ad un aumento dei linfociti helper che interagiscono con i linfociti B
stimolando Ig anti tiroide che innescano meccanismo citotossicità mediata da anticorpo. Inoltre i
linfociti T helper vanno a stimolare CD8 citotossici contro tiroide. Gli anticorpi implicati nella
patogenesi di Hashimoto sono diretti contro:
-Tireoglobulina (proteina prodotta dalle cellule follicolari implicata nella produzione di T3 e T4 per
iodazione dei residui tirosinici) o perossidasi (enzima che catalizza iodinazione della tirosina o
accoppiamento DIT/MIT)
-Recettori TSH (bloccano recettori che diventano insensibili alla stimolazione ipofisaria)
- Trasportatori dello iodio (viene inibita la captazione dello iodio e la sua organificazione)
Si manifesta clinicamente con ipotiroidismo progressivo e gozzo nodulare non tossico (costituito da
tessuto fibroso! + con infiltrato linfocitario dovuto a linfociti T contro tireociti). Nelle prime fasi si
osserva tireotossicosi transitoria (detta hashitossicosi) causata dalla distruzione dei follicoli tiroidei e
dal massimo rilascio ormonale che ne consegue.
Tiroidite di Riedel: è una variante della tiroidite di Hashimoto caratterizzata da una più estesa
reazione fibrotica.
Tiroidite di De Quervain: tiroidite subasta granulomatosa associata ad una progressiva infezione
delle vie aeree superiori. Si ritiene che l‟infezione virale sia in grado di danneggiare le cellule tiroidee
determinando il rilascio in circolo di antigeni self: questi a loro volta indurrebbero l‟attivazione
transitoria della risposta autoimmune citotossica.
Si manifesta clinicamente con infiammazione dolente della tiroide ed ipertiroidismo transitorio, al
quale può far seguito una fase di ipotiroidismo autolimitante.
GOZZO
Manifestazione clinica di una patologia tiroidea in grado di determinare l‟incremento delle dimensioni
dell‟organo. È generalmente dovuta a fenomeni iperplastici, conseguenti all‟iperstimolazione operata
dal TSH sui tireociti come risposta compensatoria all‟inadeguata sintesi di T3 e T4.
- GOZZO DIFFUSO NON TOSSICO: è dovuto frequentemente al ridotto apporto alimentare di iodio,
all‟ingestione di alimenti gozzigene, al deficit genetico degli enzimi per l‟ormonosintesi o alla carenza
periferica di recettori per T3 e T4. Si osserva infatti un‟ipersecrezione compensatoria di TSH con
conseguente ipertrofia tiroidea.
Se la risposta compensatoria è adeguata, i livelli ormonali risultano normali, in caso contrario si avrà
ipotiroidismo.
- GOZZO NODULARE NON TOSSICO: dovuto a cisti tiroidee o a tiroiditi infettive o autoimmuni
(simile alla tiroidite di Hashimoto).
- GOZZO NODULARE TOSSICO: dovuto ad una neoplasia tiroidea secernente (simile al morbo di
Plummer).
DIAGNOSI SCINTIGRAFICA
- Noduli freddi (Ipocaptanti): sono espressione di follicoli tiroidei ipofunzionanti (diminuzione dello
iodio) o, più raramente, di metastasi neoplastiche o cisti tiroidee.
- Noduli caldi (Ipercaptanti): sono espressione di aree circoscritte di parenchima iperfunzionante,
TSH-indipendente (il rilascio di TSH è soppresso somministrando T4) come nel caso di neoplasie
secernenti.
FISIOPATOLOGIA DEL SURRENE
Le due ghiandole surrenali poste al di sopra del polo superiore del rene nello spazio retroperitoneale,
hanno forma piramidale e sono formate da due distinte unità dal punto di vista sia morfologico sia
funzionale: corticale del surrene (80-90%), e al suo interno la midollare del surrene.
Nella corticale si riconoscono tre zone concentriche dall‟esterno all‟interno:
1) glomerulare mineralcorticoidi (aldosterone);
2) fascicolata glucocorticoidi (cortisolo);
3) reticolare ormoni sessuali (testosterone).
CORTICALE DEL SURRENE
Sintetizza corticosteroidi, composti lipidici che originano dal colesterolo fornite di attività biologica a
aventi come struttura di base il nucleo di ciclopentano peridrofenantrene.
La biosintesi di ormoni steroidei avviene anche dalle gonadi e dalla placenta, i quali prelevano il
colesterolo dal sangue sotto forma di LDL per poi endocitarlo in vescicole che si fondono con i
lisosomi, in cui gli enzimi idrolizzano le LDL con formazione di aminoacidi e colesterolo libero.
Questo viene trasportato nei mitocondri da una proteina carrier denominata “star” codificata da un gene
regolato da ACTH nel surrene e gonadotropine nelle gonadi.
- ZONA GLOMERULARE: sintesi dei mineralcorticoidi, soprattutto aldosterone, poiché priva
dell‟enzima 17- -idrossilasi (che serve per produrre cortisolo).
Regolazione positiva della secrezione di aldosterone:
Sistema renina-angiotensina: la renina viene liberata per diminuzione della pressione arteriosa
nell‟arteriola afferente al glomerulo renale dalle cellule dell‟apparato juxtaglomerulare costituito dalle
cellule specializzate dell‟epitelio tubulare, dalla macula densa, capaci di rispondere a diminuzioni della
concentrazione di sodio endotubulare.
(l‟angiotensinogeno di produzione epatica, viene scisso dalla renina in angiotensina I che ad opera
dell‟enzima ACE si trasforma in angiotensina II).
L‟angiotensina II si lega ai recettori presenti sulle cellule della zona glomerulare attivando la
fosfolipasi C con formazione di inositolotrifosfato e diacilglicerolo; questi attivano la protein chinasi C
con conversione del colesterolo libero a pregnenolone da cui si forma 18-OH-CORTICOSTERONE e
infine ALDOSTERONE.
ACTH e MSH.
Iponatremia.
Ipercalemia (aumento di potassio): negativizzazione del versante tubulare con conseguente aumento
della differenza di potenziali tra i due versanti; segue l‟apertura dei canali per il calcio e aumento della
sintesi di aldosterone.
Regolazione negativa:
- somatostatina;
- ANP (peptide natriuretico atriale): rilasciato dai cardiomiociti.
L‟aldosterone per il 60% è veicolato dalle albumine, per il 40% è in forma libera.
L‟aldosterone in forma libera diffonde attraverso la membrana raggiungendo il citosol delle cellule
bersaglio (tubuli convoluti distali e dotti collettori del rene) dove sono presenti i recettori per i
mineralcorticoidi (presenti anche nelle cellule delle ghiandole salivari e sudoripare, dell‟endotelio
vascolare, intestinale e della ghiandola mammaria).
Stimola l‟espressione dei geni (dal citosol viene trasferito nel nucleo) che codificano per proteine
coinvolte nell‟omeostasi ionica che porta al riassorbimento del sodio ed escrezione di potassio e
idrogeno: pompa Na+/K+ ATP-dipendente, canali del sodio, cotrasportatori Na+/H+.
Ha una latenza di circa un‟ora.
Con i recettori per i mineralcorticoidi interagisce anche il cortisolo che tuttavia non compete con
l‟aldosterone poiché nelle cellule del tubulo distale e negli epatociti c‟è l‟enzima
11- -OH-steroidodeidrogenasi che trasforma il colesterolo in cortisone.
Effetti dell‟aldosterone:
- regolazione della concentrazione fisiologica di elettroliti (Na+/K+);
- mantenimento di valori normali di volemia e pH;
- regolazione della pressione arteriosa poiché il riassorbimento di Na+ è seguito da quello dell‟acqua.
Il favorimento della ritenzione di sodio coinvolge:
- assorbimento di sodio dal liquido tubulare alle cellule tubulari mediato da canali scambio ionico
Na+/H+.
- estruzione attiva del sodio da parte delle cellule tubulari nei capillari mediata dalla pompa Na+/K+.
L‟aumento della natremia porta ad un aumento della volemia (per concomitante riassorbimento di
acqua, richiamo osmotico).
Nel liquido tubulare si ha diminuzione della concentrazione di sodio cui segue progressiva
negativizzazione che aumenta la differenza di potenziale che costituisce la spinta promuovente
l‟escrezione del potassio nel lume tubulare mediato da canali ionici e pompa Na+/K+ che preleva
potassio dal sangue e riversa sodio in esso.
Questo succede però solo quando la concentrazione di sodio è molto elevata.
DEFICIT DI ALDOSTERONE:
- iponatremia;
- ipovolemia;
- ipotensione;
- ipercalemia;
- diminuzione di escrezione di acidi.
IPERPRODUZIONE DI ALDOSTERONE:
- ipernatremia;
- ipervolemia;
- ipertensione;
- ipocaliemia;
- alcalemia.
- ZONA FASCICOLATA E RETICOLARE: sintetizzano entrambe glucocorticoidi mentre
prevalentemente la reticolare sintetizza ormoni sessuali.
La sintesi e la secrezione dei glucocorticoidi è regolata dall‟ACTH ipofisario e CRH ipotalamico, che
vengono inibiti quando la concentrazione dei glucocorticoidi è elevata.
Nell‟arco delle 24 ore il livello ematico di ACTH e glucocorticoidi è fluttuante, molto basso intorno
alle 24,00, picco invece intorno alle 6,00/8,00 del mattino.
Stress di vario tipo determinano incremento della secrezione di CRH e ACTH con conseguente
aumento della concentrazione di cortisolo.
Il cortisolo per l‟80% è trasportato dalla transcortina, il 15% dall‟albumina, e il 5% in forma libera in
grado di esercitare funzione ormonale.
EFFETTI SUL METABOLISMO:
- glucidico: azione anti-insulinica poiché culminano nell‟aumento della concentrazione di glucosio
ematico dovuto a: 1) incremento della gluconeogenesi epatica; 2) mobilizzazione del glicogeno
muscolare; 3) diminuzione dell‟utilizzazione del glucosio, soprattutto ad opera degli adipociti; 4)
glicogenosintesi epatica per aumentata disponibilità di glucosio; 5) effetto ambivalente sull‟insulina: da
un lato ne favoriscono la secrezione (in risposta all‟iperglicemia) dall‟altro ne bloccano l‟azione a
livello cellulare, ostacolando la penetrazione intracellulare del glucosio (per questo va limitata la
somministrazione di glucocorticoidi ai diabetici).
- lipidico: negli adipociti di alcune regioni del corpo favoriscono la lipogenesi ed in altri la lipolisi, a
causa di una diversa interferenza recettoriale sulla regolazione genica.
- proteico: riducono l‟incorporazione degli aminoacidi nelle proteine favorendo il catabolismo di queste
con conseguente maggiore disponibilità di aminoacidi per la gluconeogenesi (muscolo striato, adipe,
osso, linfoide, connettivo).
Il fegato risponde con incremento della sintesi proteica.
- acidi nucleici: interferiscono negativamente con la replicazione del DNA e la trascrizione dell‟RNA.
EFFETTI IMMUNOSOPPRESSORI ED ANTIINFIAMMATORI
Riportabili all‟attivazione del programma apoptotico, sia nella risposta immunitaria anticorpo-mediata,
che in quella cellulo-mediata. Nel processo infiammatorio acuto, si ha una riduzione dell‟intensità dei
fenomeni vascolo-ematici che culminano nel fenomeno essudativo e la stabilizzazione della membrana
lisosomiale che limita il danno tissutale.
EFFETTI SUL METABOLISMO IDROELETTRICO
Lieve attività dei mineralcorticoidi.
EFFETTI SULL‟EPITELIO E SUL CONNETTIVO
Riduce la proliferazione epiteliale, tuttavia diminuisce la sintesi di collagene, dei glicosaminoglicani e
la crescita dei fibroblasti con conseguente assottigliamento del derma e rallentamento del processo
riparativo.
EFFETTI SULLO SCHELETRO
Diminuzione dell‟attività degli osteoblasti con conseguente diminuzione della formazione di tessuto
osseo. Il potenziamento dell‟attività osteoclastica aggrava il danno. La diminuzione dell‟assorbimento
di calcio, e l‟aumento dell‟escrezione di calcio porta a un quadro di ipocalcemia con aumento della
secrezione di PTH.
EFFETTI SULL‟APPARATO CARDIOCIRCOLATORIO
Aumento della gittata cardiaca, aumento del tono vascolare, ipertensione.
EFFETTI SUL RENE
Aumentata filtrazione glomerulare per aumentata gittata.
EFFETTI SUL SNC
Attraversando MEE vengono utilizzati per la terapia di edemi cerebrali.
ORMONI SESSUALI: sia nel maschio che nella femmina il contributo degli ormoni surrenalici è
scarso. La maggior parte degli androgeni e degli estrogeni è sintetizzato nelle gonadi.
Tra gli effetti indotti abbiano l‟irsutismo con conseguente aumento del sistema pilifero.
SINDROME DI CUSHING (IPER-GLICO-CORTICOIDISMO)
Ipersecrezione autonoma di steroidi glicoattivi (cortisolo) da parte di adenomi o adenocarcinomi del
surrene secernenti eccessiva concentrazione di glucocorticoidi. Nel sangue blocca la secrezione di
ACTH (feedback negativo) con conseguente ipotrofia delle zone fascicolate e reticolate non invase dal
tumore.
Morbo di Cushing: malattia indotta da iperproduzione di steroidi glicoattivi per iperplasia delle zone
fascicolata e reticolare del corticosurrene indotta da ipersecrezione di ACTH da parte dell‟adenoipofisi,
causata da: iperproduzione ipotalamica di CRH, corticotropinoma dell‟adenoipofisi o adenomi a cellule
corticotrope secernenti ACTH.
Sindrome di Cushing ectopica: forma di iperglicorticoidismo causata da produzione fuori sede di
ACTH conseguente alla presenza di lesioni neoplastiche secernenti prevalentemente a livello
polmonare (carcinoma polmonare a piccole cellule), ma anche a carcinomi della tiroide,
feocromocitomi, insulinomi.
Può essere causato inoltre da iperproduzione ectopica di CRH legata a neoplasia prostatica ad attività
secernente che porta ad una forma di ACTH-dipendenza indirettamente attraverso appunto il rilascio di
CRH quindi si ha aumento di produzione di ACTH.
Sindrome di Cushing iatrogena: dovuta ad un‟eccessiva somministrazione di glucocorticoidi e/o
ACTH. È la causa più frequente in assoluto della sindrome di Cushing.
SEQUENZA DI EVENTI CHE PROVOCANO LA COMPARSA DELLA SINTOMATOLOGIA:
- ipersecrezione di ACTH;
- scomparsa del ritmo circadiano di secrezione di ACTH;
- scomparsa dell‟ipersecrezione di ACTH in risposta allo stress;
- iperplasia bilaterale delle zone fascicolata e reticolare del cortico-surrene e ipersecrezione di
glicorticoidi;
- riduzione o blocco del meccanismo di regolazione a feedback negativo;
- alterata secrezione ipotalamica di CRH, TRH, GnRH.
SINDROME DI CUSHING SURRENALICA la concentrazione ematica di glicorticoidi e androgeni
è costantemente elevata, mentre la concentrazione di ACTH è molto bassa; la secrezione ormonale da
parte delle cellule neoplastiche è indipendente dalla regolazione ipotalamo-ipofisaria; in seguito a
questo si ha scomparsa del ritmo circadiano di secrezione del cortisolo.
SINDROME DI CUSHING ECTOPICA il livello di ACTH è elevato; sia che questo sia rilasciato
dalla secrezione ectopica di tumori, sia che consegua a iperproduzione di CRH.
È invece basso nell‟eziologia iatrogena.
Quadro clinico: (derivante da iperproduzione di cortisolo)
- tipica obesità prevalentemente localizzata nel tronco, nel volto (faccia a luna piena), nella nuca (collo
di bufalo); gli arti appaiono relativamente sottili;
- cute atrofica, caratterizzata da strie rubre dovute alla superficializzazione dei vasi sanguigni in seguito
ad assottigliamento del derma (diminuita sintesi di collagene…) (vedi effetti del cortisolo).
- ipertensione;
- intolleranza al glucosio;
- osteoporosi più ipertrofia muscolare;
- aumento degli androgeni che causa nelle donne irsutismo;
Diagnosi differenziale:
- cortisolo e ACTH plasmatici;
- CLU (cortisolo libero urinario);
IPO-CORTICO-SURRENALISMO (MORBO DI ADDISON)
1) primitivo, quando dipende da:
- processi patologici insiti nel parenchima ghiandolare;
- distruzione parziale o totale della corticale o di tutto il parenchima (morbo di Addison);
- surrenectomia bilaterale;
- deficiente biosintesi di uno o più enzimi surrenalici;
2) secondario, quando consegue a:
- ridotta produzione di ACTH causata da processi patologici della ghiandola;
- prolungata e non controllata somministrazione di glucocorticoidi, responsabili del blocco della
secrezione di CRH e ACTH.
Patologie responsabili dell‟insufficienza cortico-surrenalica primitiva sono varie:
- Adrenalite autoimmune, generalmente associata all‟antigene DR3 del sistema HLA o concomitante ad
altre patologie autoimmuni (75%);
- Tubercolosi (20%): progressiva distruzione del parenchima d‟organo con una vera e propria necrosi
caseosa che gradualmente si associa con insufficienza d‟organo;
- Infezioni opportunistiche in pazienti con AIDS;
- Amiloidosi;
- Metastasi;
- Alterazioni vascolari;
- Necrosi emorragica nel corso di sepsi, specie meningococcica;
- Assenza nelle cellule della zona fascicolata dei recettori per ACTH (difetto ereditario legato all‟X).
MORBO DI ADDISON: forma di ipocorticosurrenalismo più tipica, di tipo idiopatico autoimmune
caratterizzata da un processo flogistico cronico, associata ad infiltrazione linfoplasmacellulare diffusa
con progressiva fibrosi che determina distruzione delle ghiandole.
Ci può essere una reazione tra la forma idiopatica e quella virale, infatti l‟infezione virale modifica il
pattern antigenico della cellula creando delle situazioni tali per cui si espongono delle molecole che
sono molto simili per l‟omologia di sequenza a quelle normali, ma che di fatto evocano una risposta
immunitaria.
Con il tempo, cronicizzando, il fenomeno infiammatorio determina una distruzione più o meno estesa
delle cellule self.
Nel morbo di Addison sono presenti oltre ad anticorpi anti-surrene, anche autoanticorpi diretti contro
altri distretti corporei, soprattutto verso la tiroide.
Gli anticorpi anti-surrene costituiscono il 60%, mentre quelli anti-tiroide il 50%.
Quando c‟è concomitanza di manifestazioni autoimmuni geneticamente determinate in diversi organi
(la predisposizione a sviluppare malattie autoimmuni è scritta nel nostro DNA), può essere un clone
anticorpale che produce anticorpi non diversi fra loro ma che riconoscevano molecole considerate
antigeniche con specificità diversa, ma con notevoli analogie di sequenza localizzate in distretti
differenti.
(esistono anche autoanticorpi di classe IgG contro diversi enzimi tra cui: 21-idrossilasi e
17- -idrossilasi).
CRITERI PER STABILIRE PATOGENESI AUTOIMMUNE
- Infiammazione linfocitaria dell‟organo bersaglio;
- Presenza di autoanticorpi circolanti;
- Identificazione di autoantigeni specifici;
- Associazione con altre malattie autoimmuni;
- Riproducibilità delle reazioni autoimmuni umorali e/o cellulo-mediate in animali da esperimento
immunizzati con antigeni omologhi o autologhi;
- Presenza di lesioni organo-specifiche negli animali immunizzati.
SINTOMATOLOGIA
Si rende manifesta quando circa il 90% del parenchima ghiandolare è andato distrutto; quando la
distruzione è lenta e progressiva i sintomi iniziali sono:
- incapacità del surrene di aumentare la secrezione di ormoni glicoattivi in risposta allo stress; crisi di
insufficienza acuta possono comparire in seguito a traumi, infezioni, stress.
Quando la patologia cronicizza aumenta la concentrazione di ACTH e -LPH ( -lipotropina); quindi si
ha aumento della secrezione di MSH che causa iperpigmentazione diffusa (melanodermia) che
coinvolge anche palmo della mano, mucosa orale, pieghe cutanee (morbo bronzino).
Qualche volta c‟è associazione con ipopigmentazione da vitiligine (i pazienti affetti presentano
anticorpi anti-melanociti che sembrano proteggere dal melanoma).
Inoltre sono presenti:
- ipoglicemia;
- iponatremia;
- ipercalemia;
- diminuzione di aldosterone e cortisolo.
Questi insieme portano a debolezza e quindi collasso.
IPERMINERALCORTICOIDISMO
Patologia caratterizzata da eccessiva attività mineralattiva esercitata da: aldosterone, suoi precursori,
cortisolo.
Quadro clinico:
- ipernatremia;
- ipervolemia;
- ipertensione;
- debolezza muscolare;
- ipocalemia;
- polidipsia e poliuria;
- alcalosi metabolica.
Si divide in:
1) Primario: SINDROME DI CONN
Presenza di un adenoma del cortico surrene o carcinoma surrenalico secernente aldosterone o di
iperplasia bilaterale della zona glomerulosa.
Sia l‟ipervolemia che l‟ipernatremia dovute all‟aumento dell‟aldosterone portano a una diminuzione
della produzione di renina da parte dell‟apparato juxtaglomerulare: di conseguenza la diminuzione
della concentrazione di renina e la diminuzione della concentrazione di sodio nelle feci sono reperti di
laboratorio.
L‟ipertensione è causata da ipervolemia e dall‟aumento delle resistenze periferiche per via della
vasocostrizione.
Si osserva deplezione di potassio associata a ritenzione di sodio con conseguente alcalosi metabolica
(determinata da un aumento nei fluidi extracellulari della concentrazione di bicarbonato senza che
avvenga l‟aumento della pressione parziale di anidride carbonica; tutto questo porta ad un aumento del
pH). Subentra in conseguenza a un‟eccessiva perdita di idrogenioni o di eccessiva ritenzione di alcali,
ad esempio in seguito a vomito.
2) Secondario: insorge in seguito all‟attivazione del sistema renina-angiotensina indotto da patologie
che comportano riduzione della perfusione renale:
- insufficienza cardiaca;
- aterosclerosi;
- cisti renali;
- stenosi dell‟arteria renale;
- infarto renale;
- sindrome nefrosica,
O da presenza di tumori con produzione ectopica di renina (es. tumori di Wilms).
Può anche manifestarsi con assenza di ipertensione arteriosa; avviene infatti in pazienti portatori di
edemi diffusi (insufficienza cardiaca congestizia) con formazione del trasudato che comporta passaggio
di liquido e di elettroliti dal compartimento vascolare a quello interstiziale.
Si crea così una condizione ipovolemico per diminuzione del volume ematico circolante e
contemporaneamente si ha blocco del sistema renina-angiotensina.
Sindrome di Bartter: ipertrofia e iperplasia delle cellule dell‟apparato juxtaglomerulare con
iperladosteronemia, ipopotassiemia ed alcalosi metabolica.
PSEUDOIPERALDOSTERONISMO DA DEFICIT DI
11- -IDROSSI-STEROIDO-DEIDROGENASI
L‟11- -idrossi-steroido-deidrogenasi trasforma il cortisolo in cortisone ed è costitutivamente espresso
negli epatociti e nelle cellule tubulari del rene.
In caso di deficit dell‟enzima aumenta l‟emivita del cortisolo con conseguente diminuzione o inibizione
totale dell‟ACTH (feedback negativo).
Il cortisolo non potendo essere più metabolizzato a livello epatico viene direttamente eliminato per via
renale; filtrato nei glomeruli risulta presente in eccesso nell‟ultrafiltrato glomerulare.
Il cortisolo diffonde nelle cellule tubulari, prive anch‟esse dell‟enzima; compete con l‟aldosterone per i
recettori per mineralcorticoidi, con conseguente pseudoiperaldosteronismo, poiché provocato dal
cortisolo e non dall‟aldosterone.
Sindrome di Little: ritenzione sodica ed ipertensione provocata però da anomalia ereditaria nel
trasporto di sodio e potassio a livello tubulare.
IPOMINERALCORTICOIDISMO
- Primario: comprende forme congenite e acquisite.
Forme congenite: causate da ridotta sintesi di ormoni mineralcorticoidi facenti parte dell‟iperplasia
congenita del surrene. Condizioni patologiche congenite accomunate dalla mancata sintesi di enzimi
responsabili della produzione di ormoni steroidei a livello del corticosurrene e gonadi a partire dal
colesterolo. Per feedback negativo l‟assenza dell‟ormone comporta aumento di ACTH e CRH con
iperplasia surrenalica. La trasmissione dei difetti avviene per via autosomica recessiva; entrambi i sessi
possono essere interessati anche se con conseguenze diverse nelle forme che comportano abnorme
sintesi di ormoni sessuali e alterata formazione dell‟apparato genitale, di conseguenza si ha iperplasia
congenita del surrene che corrisponde alla sindrome surreno-genitale.
Forme acquisite: conseguono alla riduzione o alla distruzione della zona glomerulo o a surrenectomia
monolaterale.
Quadro clinico: iponatremia, ipotensione, ipercalemia, acidosi metabolica (patologia caratterizzata da
un sovraccarico acido causato da una maggiore produzione e da una minore escrezione di idrogenioni,
causata generalmente da: diabete mellito scompensato, digiuno prolungato, shock).
- Secondario: condizioni patologiche dipendenti da deficiente o assente produzione di renina o
angiotensina II. L‟eziologia più frequente è quella iatrogena: l‟assunzione di mineralcorticoidi induce
inizialmente iperaldosteronismo con blocco della produzione di renina e conseguente
ipoaldosteronismo.
DEFICIT DI 17- -IDROSSILASI
L‟enzima trasforma il pregnenolone in 17-OH-pregnenolone e il progesterone in
17- -OH-progesterone. Il deficit enzimatico determina blocco della sintesi di GC e androgeni con
conseguente aumento di ACTH e iperplasia del surrene. La diminuita sintesi di androgeni porta a
ipogonadismo (infantilismo sessuale).
DEFICIT DI C21-IDROSSILASI
Enzima che trasforma il progesterone in deossicortisone e il 17- -OH-progesterone in deossicortisolo.
La mancata sintesi di cortisolo e aldosterone porta ad aumento di ACTH con iperplasia congenita del
surrene.
MIDOLLARE DEL SURRENE
Deputato alla sintesi di catecolamine mediata dalle cellule cromaffini: 80% adrenalina, 20%
noradrenalina.
TIROSINA
tirosina idrossilasi
DOPA
DOPA-decarbossilasi
DOPAMINA
dopamina- -idrossilasi
NORADRENALINA
feniletanolamina-N-metil-transferasi
ADRENALINA
Effetti diretti: dipendono dalla risposta delle cellule bersaglio;
Effetti indiretti: determinati da altri ormoni il cui rilascio è stimolato da catecolamine.
L‟aumento della pressione sistolica e la diminuzione della pressione diastolica, tachicardia (NA invece
bradicardia), vasocostrizione a livello cutaneo, mucoso, renale, vasodilatazione a livello muscolare e
scheletrico, aumento del flusso ematico epatico, riduzione della motilità intestinale, contrazione degli
sfinteri, broncodilatazione, midriasi, iperglicemia termogenesi (dovuta alla vasodilatazione).
IPERFUNZIONE DELLA MIDOLLARE: in seguito a surrenectomia bilaterale non si riscontra
diminuzione della concentrazione di catecolamine marcata, poiché il contributo surrenalico è del 2/8%
circa, il restante è dato dalla funzionalità della branca adrenergica del sistema neurovegetativo.
FEOCROMOCITOMA
Tumore funzionante della midollare, generalmente benigno; cellule neoplastiche secernono in eccesso
adrenalina mentre quelle di tumori insorti in altre sedi del sistema simpatico secernono in eccesso solo
NA.
Questo tumore è riscontrato nel 5% dei casi in varie sindromi neoplastiche a substrato ereditario:
- MEN2: in associazione ad adenomi delle paratiroidi e a carcinoma midollare della tiroide.
- Neurofibromatosi;
- Atassia cerebellare ereditaria.
L‟aumento della concentrazione di catecolamine provoca ipertensione farmaco-resistenza caratterizzata
da crisi parossistiche che si presentano con forte cefalea, palpitazioni, profusa sudorazione, tremori,
vomito.
Diagnosi: esami strumentali (TAC, risonanza) e presenza di glicosuria.
DIABETE MELLITO
Sindrome caratterizzata da iperglicemia conseguente alla diminuzione assoluta o relativa della
secrezione e/o dell‟azione dell‟insulina.
Oggi la diagnosi è precoce e la malattia è ben gestita, infatti il problema non è tanto la malattia in sé,
ma le complicanze associate alla malattia.
Il diabete mellito è un insieme di patologie diverse per eziologia e patogenesi.
L‟eziologia è multifattoriale: poligenica, ambientale e legata a risposte (autoimmuni) dell‟organismo.
Si tratta di una patologia cronica progressivamente invalidante.
Può portare al rischio di coma da chetoacidosi (tipo 1) o da iperosmolarità non chetosica (tipo 2).
Ultima definizione:
“il diabetico è colui che dopo due controlli (un solo controllo può non essere oggettivo) della glicemia
a digiuno avrà avuto in due occasioni una glicemia maggiore di 126mg/dl (nel plasma)”.
Prima era definita ridotta tolleranza ai carboidrati la situazione che caratterizzava quei pazienti che
avevano una glicemia dopo carico di glucosio (2 ore) di 140-200 mg/dl.
Gli americani hanno introdotto il concetto della ridotta tolleranza della glicemia a digiuno, cioè senza
cura da carico, stabilendo che sono a rischio di diabete tutti i soggetti con glicemia a digiuno compresa
fra 110 e 125 mg/dl.
E‟importante valutare anche i valori dell‟insulina nel sangue: nel diabete di tipo II si verifica il picco
dopo carico, ma i valori non tornano a livello normale ( esposizione cronica a insulina per livelli
basali superiori alla norma); nel diabete I invece non si alzano dopo il carico.
DIABETE PRIMITIVO:
Tipo I: (10-15% dei casi)
- insulino-dipendente;
- magro;
- chetosico;
- giovanile;
- associato ad alcuni aplotipi HLA.
Il diabete di tipo I è a patogenesi prevalentemente autoimmunitaria; si divide in:
Ia: c‟è autoimmunità presente all‟inizio, crea il danno, ma poi tende a sparire.
Ib: l‟autoimmunità persiste più a lungo nel tempo; la distruzione delle cellule Beta è progressiva e
continua per tutta la vita.
Tipo II:
- insulino-indipendente;
- obeso;
- non chetosico;
- senile (compare in età adulta dopo intolleranza al glucosio);
N.B. Il diabete MODY ha le caratteristiche del diabete di tipo II ma si sviluppa nel giovane.
N.B.(2) C‟è correlazione inequivocabile fra obesità e diabete di tipo II: geni che determinano obesità
donano maggiore suscettibilità al diabete di tipo II.
DIABETE SECONDARIO:
Deplezione di cellule Beta:
- trauma;
- pancreasectomia;
- Carcinoma del pancreas;
- Pancreatite alcolica;
- Fibrosi cistica;
- Amiloidosi.
Squilibri ormonali:
- Endocrinopatie: Malattia di Cushing, Acromegalia;
- Gravidanza.
Forme iatrogene:
- Glucocorticoidi;
- Ormoni tiroidei.
L‟insulina viene secreta per liberazione di granuli e contemporaneamente all‟ insulina viene liberato
il peptide C.
- I suoi livelli sono indicativi dei livelli di insulina.
- Ha un‟emivita più lunga.
Non tutti i tessuti rispondono all‟insulina nello stesso modo. Ci sono aree, soprattutto il SNC, definite
“privilegiate” che hanno pochi o nulli recettori, ma che possono captare il glucosio anche senza lo
stimolo dell‟insulina.
Ci sono poi tessuti insulino-dipendenti (muscolo, tessuto adiposo), cosiddetti perché necessitano di
insulina per permettere al glucosio di entrare nelle cellule.
EFFETTI DELL‟INSULINA:
- Aumento della permeabilità delle cellule al glucosio e agli aminoacidi; effetti su metabolismo di
carboidrati, lipidi e proteine: un‟alterazione dei livelli di insulina ha effetti su tutti questi metabolismi.
- Diminuzione rapida e duratura della glicemia;
- Aumento della sintesi di glicogeno.
RECETTORE PER L‟INSULINA:
Costituito da due subunità (che legano l‟insulina) esterne connesse da ponti disolfuro e due subunità
interne che contengono il dominio per la fosforilazione del recettore in tirosina.
Il gene (localizzato sul cromosoma 19) a causa di mutazioni può codificare per recettori dimerici
funzionalmente compromessi.
Il legame con il recettore determina la traslocazione del GLUT4 (trasportatore) alla membrana. Il
recettore viene riciclato (internalizzato e poi riesposto), ma ciò sembra non avvenire nel diabete di tipo
II, in cui si ha perdita graduale dei recettori, che vengono degradati e non riesposti.
E‟ probabile che il diabete di tipo II si abbia fin dalla nascita, ma i sintomi si manifestano nel tempio
per la progressiva perdita del numero dei recettori.
DIABETE DI TIPO I
10-15 % di tutti i casi.
Il pancreas produce poca insulina, per cui il paziente andrà trattato con terapia insulinica.
Ci sono fattori ereditari che determinano una predisposizione genetica sulla quale si devono inserire
fattori esogeni di vario tipo.
Si ha un deficit di insulina dovuto a distruzione delle cellule Beta del pancreas indotto da una risposta
autoimmune cellulo-mediata con infiltrazione di linfociti, ma anche di autoanticorpi (e questo è stato
provato anche con test su animali da laboratorio).
Aplotipi a rischio sono DR3 e DR4 (HLAII), mentre DR2 sembra protettivo.
E‟ stato provato in animali da esperimento che l‟immunosoppressione riduce l‟insulino-dipendenza (si
assiste a fasi di remissione).
C‟è associazione con altre malattie endocrine autoimmuni.
Un recente lavoro su animali ha dimostrato che transfettando linfociti T da un animale affetto con
diabete, si può indurre diabete. Le cellule Beta del pancreas rilasciano peptidi antigenici in grado di
evocare una risposta immunitaria. Il danno è citotossicità mediata da linfociti CD8+.
Per avere il diabete di tipo I c‟è distruzione di almeno il 90% di cellule Beta insulino-secernenti.
E‟ stato dimostrato che:
- In gemelli identici la concordanza è di circa il 50%; Vedere la concordanza in geni identici ci
permette di capire il peso dei fattori genetici.
Nel diabete di tipo II la concordanza è del 100%.
- Anche DQ2 e DQ8 sembrano a rischio.
Ci sono fattori esogeni che agiscono su soggetti predisposti:
1) Virus: rosolia congenita, EBV, e virus Coxsackie B promuoverebbero la distruzione asintomatica
delle cellule Beta.
2) Allattamento con latte vaccino: una specifica sequenza dell‟albumina presente nel latte vaccino può
cross-reagire con le proteine insulari.
3) Presenza di gruppi etnici con alta prevalenza (indiani dell‟Arizona): forse ci sono geni che non
predispongono direttamente alla malattia ma rendono più suscettibili alle infezioni virali.
Infezioni virali possono determinare infiltrazione linfocitaria con produzione di IgG citotossiche.
Linfociti e IgG causano insulite a carico delle cellule Beta del pancreas. I virus oltre a modificare
cellule target e fare esprimere antigeni diversi possono fare mimetismo molecolare.
I meccanismi immunitari/autoimmunitari scatenano la malattia che poi può avere un periodo di
remissione lungo fino a due anni seguito da una ripresa in forma stabile.
AUTOANTICORPI:
- anti-cellule Beta;
- anti-insulina;
- anti-decarbossilasi glutammica.
Gli autoanticorpi legano antigeni su cellule Beta del pancreas. Alcuni autoanticorpi sicuramente
facilitano la distruzione delle cellule Beta, altri autoanticorpi hanno un ruolo significativo per la
diagnosi della malattia, ma non è ancora chiaro che ruolo hanno nella patogenesi della malattia.
L‟autoimmunità potrebbe essere una conseguenza del processo infiammatorio: il sistema immunitario
non riconosce più come self le cellule Beta danneggiate dall‟insulite.
Ci sono autoanticorpi in soggetti ancora sani; ciò indica che il processo patogenetico inizia ben prima
dell‟esordio della malattia.
IPOTESI APOPTOTICA:
Le cellule Beta risultano vulnerabili all‟azione tossica di radicali ossidi e citochine.
L‟apoptosi delle cellule Beta è mediata da:
1) Sostanze in grado di indurre in tali cellule L‟espressione di Fas (IL-1 e NO);
2) Interazione delle cellule Beta con FasL.
Remissioni prolungate in soggetti giovani si ottengono con terapie immunosoppressorie: si ferma
l‟evolversi di attacco del sistema immunitario; se il danno esteso non si può fare niente.
CHETOACIDOSI DIABETICA
Il diabete di tipo I evolve verso chetoacidosi diabetica. La tendenza a chetoacidosi è esclusiva del
diabete di tipo I perché qui si ha deficit assoluto di insulina.
Dato che le cellule non possono utilizzare glucosio si incrementa la lipolisi e si liberano acidi grassi nel
sangue; questo porta a due diversi effetti:
1) esterificazione di acidi grassi in trigliceridi incorporati in lipoproteine;
2) ossidazione epatica di acidi grassi (nei mitocondri); questo porta a iperproduzione di AcetilCoa; si
ha formazione di corpi chetonici (acetone, acido acetoacetico, acido -idrossibutirrico) con
conseguente acidosi con liberazione di H+ e squilibri di Na+ e K+.
I corpi chetonici sono acidi forti e abbassano il pH; per neutralizzare gli H+ l‟organismo ha dei sistemi
tampone di cui il principale è HCO3- che antagonizza gli H+ e forma H2CO3.
Se questo si perpetua nel tempo i sistemi tampone non ce la fanno a tamponare gli idrogenioni in
eccesso e si ha coma chetoacidosico:
- Respiro di Kussmaull: per eliminare CO2.
- Anoressia, vomito, dolori addominali.
- Disidratazione con bulbi oculari incavati.
Nel diabete di tipo II non c‟è lipolisi perché c‟è ancora un po‟ di insulina e un po‟ di glucosio
all‟interno delle celluleci sono pochi corpi chetonici.
DIABETE DI TIPO II
I fattori genetici hanno un ruolo importante (la concordanza tra gemelli identici si approssima al
100%). Non c‟è un unico gene, ma più geni.
Il diabete di tipo II però, non è dovuto solo a fattori genetici, ma anche ad altri fattori.
Nella curva da carico il picco di insulina è minore, ma i livelli basali (di insulina) sono maggiori per
stimolazione cronica delle cellule Beta a causa di iperglicemia prolungata.
- I soggetti affetti da diabete di tipo II sono generalmente obesi, ma non è chiaro se l‟obesità sia la
causa del diabete o compaia insieme al diabete.
- I recettori dell‟insulina sono di meno, e meno affini all‟insulina (insulino-resistenza).
E‟ la forma più comune di diabete; colpisce per lo più soggetti con vita sedentaria (obesi). I fattori
genetici sono fondamentali, ma non è stato identificato un aplotipo a rischio. Ci sono anche qui
autoanticorpi come nel diabete di tipo I.
Già prima che il diabete si sviluppi i pazienti perdono la risposta secretoria insulinica precoce al
glucosio e possono secernere quantità relativamente elevate di proinsulina.
Questo è dovuto probabilmente a iposensibilità delle cellule Beta al glucosio che causa un ritardo nella
produzione di insulina.
Successivamente, l‟insulina prodotta in ritardo e non in modo graduale, satura rapidamente tutti i
recettori insulinici. L‟iperinsulinemia, in presenza di recettori saturi, causa down-regolazione dei
recettori.
L„iperglicemia è il risultato di due eventi:
1) alterazione nella secrezione di insulina in risposta al glucosio;
2) l„insulina non riesce a far captare glucosio alle cellule resistenza insulinica.
Molti pazienti con insulino-resistenza non sviluppano il diabete.
L‟obesità, anche in assenza di diabete, può essere correlata a insulino-resistenza.
Ci potrebbero essere geni responsabili sia dell‟obesità che dell‟insulino-resistenza.
L‟incidenza del diabete di tipo II diminuisce in periodi di guerra e carestia (c‟è meno obesità). I
mammiferi in cattività hanno maggiore incidenza.
Vi sono due geni sicuramente implicati nell‟obesità, e quindi nel diabete di tipo II.
- Nel 6% degli obesi si ha alterazione del recettore MC4R (melanocortina, anoressizzante);
- Nell‟1% degli obesi si ha alterazione del recettore LEPR (leptina, anoressizzante).
AMILOIDE:
Un‟elevata percentuale di pazienti con diabete di tipo II mostra la presenza nelle isole pancreatiche di
tessuto amiloide derivante dalla deposizione di amilina o IAPP (peptide prodotto dalle cellule Beta del
pancreas, secreto insieme all‟insulina).
Insulina e IAPP possono essere secrete in eccesso, ma la loro relazione con la patogenesi del diabete
mellito di tipo II non è stata chiaramente stabilita.
COMA IPEROSMOLARE NON CHETOSICO:
Nel diabete di tipo II non si ha tendenza a formare corpi chetonici, nonostante sia comunque presente
un aumentata produzione di glucagone.
C‟è limitata capacità di assumere liquidi nei pazienti anziani. Si ha un quadro neurologico iniziale che
porta a coma iperosmolare non chetosico.
Differenze fra le due forme:
- Nel diabete di tipo I c‟è probabile predisposizione genetica;
- Nel diabete di tipo II c‟è influenza genetica certa ma non sono stati inequivocabilmente identificati i
geni.
- Nel diabete di tipo I i fattori ambientali sono virus e agenti tossici;
- Nel diabete di tipo II l‟unico fattore ambientale può essere considerata l‟alimentazione legata
all‟obesità.
Nella genesi della patologia però i fattori ambientali sono più importanti nel diabete di tipo I.
- Il diabete di tipo II non è autoimmune, però sono stati trovati degli autoanticorpi anti-insulina, che a
quanto pare non sembrano implicati nella patogenesi.
Caratteristiche comuni:
1) Iperglicemia;
2) Poliuria: aumenta la quantità di urine emessa nell‟arco delle 24 ore, con tendenza a disidratazione
(ciò avviene perché nel tentativo di eliminare il glucosio in eccesso si elimina anche urina).
3) Glicosuria: presenza di glucosio nelle urine (il glucosio compare nelle urine quando supera la soglia
di tolleranza al glucosio >180mg/dl);
4) Senso di sete e fame: per aumentato catabolismo proteico.
Caratteristiche non comuni:
1) Insulite: presente solo nel diabete di tipo I.
PATOGENESI DELLE COMPLICANZE:
- Advanced Glication Ends Products(AGE): prodotti finali di glicosilazione.
L‟elevata concentrazione intracellulare di glucosio determina attacco a residui glicosilici o gruppi
aminici di proteine in assenza di enzimi catalizzatori.
Ne conseguono alterazioni conformazionali e funzionali irreversibili delle proteine che tendono anche a
formare legami crociati con altre proteine AGE che possono essere patogeni: per esempio si legano
alle LDL incrementando la deposizione di colesterolo nell‟intima dei grandi vasi: aterosclerosi.
Sono stati identificati recettori per AGE su cellule endoteliali, fibroblasti, cellule del mesangio,
macrofagi e linfociti, che se attivati possono rilasciare citochine implicate nell‟insorgenza di alcune
complicanze del diabete.
Esempio di glicosilazione non enzimatica è la formazione di un legame fra glucosio e emoglobina:
HbA1C.
Una volta prodotto, questo legame è irreversibile e l‟analisi della HbA1C può servire a valutare
l‟efficacia della terapia.
COMPLICANZE:
- Aterosclerosi;
- Patologia cronica degli arti inferiori (ipoperfusione da atero e arteriolosclerosi; aumento delle
infezioni e ulcere per alterata attivazione delle cellule nelle risposte dell‟organismo);
- Trombosi;
- Nefropatia;
- Difetti visivi progressivi;
- Polineuropatia periferica.
PATOLOGIE DEGLI ARTI INFERIORI:
Se c‟è aterosclerosi, c‟è ipoperfusione. Rischio aumentato di gangrena per trombosi. Infezioni e ulcere
per alterata attivazione delle cellule nelle risposte dell‟organismo:
- fagocitosi poco efficiente;
- immunodeficit.
PATOLOGIA DA ATEROSCLEROSI PROGRESSIVA:
- Microangiopatia: glomerulopatie e retinopatie.
- Macroangiopatia: coronaropatie (ischemia cardiaca) e ischemie cerebrali.
- Neuropatie da ostruzione vascolare (lesioni della sensibilità).
- Necrosi ischemica degli arti inferiori (gangrena secca).
- Dermopatie (placche, necrobiosi, xantomatosi).
- Tendenza a infezioni batteriche e virali.
CAUSE DI MORTE:
- Infarto del miocardio;
- Insufficienza renale;
- Malattie cardiovascolari (ictus);
- Alterazioni ischemiche del cuore (angina);
- Aumentata suscettibilità alle infezioni;
- Gangrena delle estremità;
- Trombosi mesenterica.
FISIOPATOLOGIA DELLE CELLULE ENDOTELIALI
L‟endotelio è una barriera tra sangue e tessuti estremamente sensibile a cambiamenti del
microambiente; è infatti capace di reagire agli stimoli di quest‟ultimo grazie a risposte localizzate e
diversificate.
È coinvolto nell‟omeostasi dell‟emostasi e nella complessa fisiopatologia della trombosi.
L‟endotelio ha la morfologia di un epitelio squamoso che ricopre la parete interna di tutti i tipi di vasi.
L‟integrità dell‟endotelio garantisce la biocompatibilità tra sangue e sistema circolatorio.
Le cellule sono legate tra loro da giunzioni formate da un complesso sistema di proteine di adesione in
connessione con il citoscheletro.
Altre proteine di adesione permettono l‟ancoraggio alla membrana basale formata dall‟insieme di
proteine della matrice prodotte dall‟endotelio stesso e dalle cellule mesenchimali sottostanti.
L‟endotelio è formato da cellule polarizzate e cioè la loro membrana basale ed apicale presentano
caratteristiche diverse e una differente distribuzione di proteine di superficie (molecole di adesione
leucocitaria sulla parte apicale; proteine di ancoraggio alla matrice sulla parte basale).
Per la sua collocazione anatomica l‟endotelio costituisce un‟interfaccia biologicamente rilevante
definendo i due compartimenti intra ed extravascolare ed inoltre è capace di filtrare, integrare e tradurre
i segnali che vengono dal sangue.
Può rispondere quindi in maniera specifica ad esempio modulando il tono vascolare, inducendo la
migrazione e proliferazione delle cellule muscolari lisce, esprimendo molecole adesive e chemochine
per i leucociti circolanti.
Pur sembrando simili, le cellule endoteliali sono molto diverse funzionalmente a seconda dell‟organo in
cui si trovano:
- nelle venule post-capillari presentano giunzioni cellula-cellula molto lasse che permettono il
passaggio di proteine e cellule circolanti tra sangue e tessuti;
- nel microcircolo cerebrale invece le cellule endoteliali formano la barriera ematoencefalica che regola
gli scambi fra sangue e tessuti per proteggere il SNC da componenti ematiche tossiche;
- gli endoteli ghiandolari e midollari presentano invece sistemi specializzati per il passaggio di ormoni
o cellule dai tessuti al sangue: le “Fenestrae” derivate dalla fusione della membrana apicale e basale
che così formano un diaframma capace di aprirsi sotto pressione; i sistemi vescicolari formati da
vescicole aperte sulla parte apicale della cellula, capaci di legare mediante recettori specifici diverse
proteine plasmatiche, quindi di richiudersi e attraversare il citoplasma per poi riaprirsi a livello della
membrana basale dell‟endotelio.
(La proteina regolatrice dei sistemi vescicolari è la caveolina che ne regola apertura/chiusura)
N.B. Fenestrae e sistemi vescicolari regolano la permeabilità transcellulare; le giunzioni cellula-cellula
invece regolano la permeabilità paracellulare.
STRUTTURE ADESIVE
La Matrice
L‟endotelio è capace di sintetizzare ed organizzare la sua matrice.
La matrice è costituita da una rete di proteine ad alto peso molecolare come collagene, laminina e
glicosamminoglicani e inoltre, solo nella matrice endoteliale è presente il fattore Von Willebrand,
prodotta esclusivamente dall‟endotelio e dai megacariociti in quanto media l‟attivazione e l‟adesione
delle piastrine in caso di danno vascolare.
Oltre a fare da base di ancoraggio alla parete vascolare, la matrice ha il compito di regolare le attività
funzionali delle cellule endoteliali (crescita, migrazione, apoptosi) ed inoltre varie proteine della
matrice o loro frammenti modulano la crescita e l‟organizzazione di nuovi vasi nonché la migrazione
dei leucociti.
Essendo un substrato adesivo, la matrice endoteliale è altamente trombogenica: se esposta a danno su di
essa si depositano rapidamente le piastrine e si attiva la coagulazione e la formazione di fibrina.
Tuttavia nei grossi vasi arteriosi a seguito del distacco dell‟endotelio, dopo alcuni giorni la matrice
tende a divenire passiva; sebbene le cause di questo cambiamento di reattività non siano ancora
note,questo rappresenta un importante meccanismo di difesa!
Quando il monostrato endoteliale viene leso, le cellule endoteliali ai bordi della ferita riprendono a
dividersi, migrando sul sottoendotelio esposto fino alla formazione di uno strato cellulare confluente.
La matrice sottoendoteliale esposta al flusso ematico è detta “Matrice Provvisoria”,in quanto
formata,oltre che dai componenti costitutivi anche dalla deposizione di proteine plasmatiche come
fibrinogeno, fibronectina e vitronectina.
Quando le cellule endoteliali hanno raggiunto la confluenza, la matrice provvisoria viene modificata e
sostituita ma appare quindi chiaro che la sua presenza è importante per promuovere la crescita e
motilità dell‟endotelio (quella definitiva è invece necessaria per la sopravvivenza e l‟omeostasi).
Le proteine della matrice sono importanti anche per l‟Angiogenesi:i componenti sintetizzati dalle
cellule mesenchimali fungono da “guida” per l‟allungamento dei vasi in formazione.
Le Integrine
L‟aggancio delle cellule endoteliali alla loro matrice è mediato dalle integrine.
Le integrine sono proteina eterodimeriche (α-β). Le cellule endoteliali possono avere diverse integrine
capaci di legare la stessa proteina della matrice,oppure può accadere che una stessa integrina possa
interagire con più ligandi.
Le integrine endoteliali sono fondamentali nel mediare la migrazione e la proliferazione dell‟endotelio,
e quindi di conseguenza la formazione di nuove strutture vascolari o la capacità dell‟endotelio di
riparare il danno.
L‟espressione delle integrine è modulata dall‟attivazione delle cellule con fattori di crescita come
VEGF,FGF e TGF- β; inoltre le integrine sono responsabili della riorganizzazione della matrice in
strutture fibrillari e contribuiscono alla sua degradazione facilitando l‟azione di diversi enzimi litici.
Come la maggior parte delle molecole di adesione, anche le integrine sono capaci di trasferire segnali
intracellulari:
- direttamente, tramite l‟attivazione di vie di segnalazione classiche
- indirettamente, legando recettori per fattori di crescita come VEGF-R modulandone così la capacità di
trasferire il segnale.
In generale comunque il legame delle integrine ai loro ligandi induce proliferazione endoteliale e si
dice che le integrine sono “permissive”cioè consentono alle cellule di rispondere adeguatamente ai
fattori di crescita.
Le giunzioni
Le giunzioni cellula-cellula sono altamente organizzate e visibili al microscopio elettronico come
strutture elettrondense.
Le giunzioni intercellulari sono formate da proteine che mediano l‟adesione omotipica (tra cellule
identiche) ed omofilica (tra proteine uguali).
Le proteine giunzionali sono transmembrana e polimerizzano formando strutture simili a cerniere
lampo (zipper-like) attorno alla periferia cellulare.
Le cellule endoteliali hanno vari tipi di giunzioni:
- Giunzioni AJ cioè di “adesione”, caratterizzate dalla presenza di uno spazio di diversi micron tra una
cellula e l‟altra.
Le proteine responsabili dell‟adesione appartengono alla famiglia delle Caderine (le cellule endoteliali
hanno una caderina specifica detta VE-caderina) un gruppo di proteine tessuto-specifiche
Ca2+-dipendenti aventi varie funzioni: mediano il cell-sorting durante lo sviluppo embrionale;
determinano la polarità cellulare; agiscono da tumori soppressori (l‟inibizione della E-caderina genera
infatti un fenotipo invasivo, mentre la sua sovraespressione reverte il fenotipo tumorale in non
invasivo); mediano la trasduzione del segnale (si associano con i recettori TK e competono con i
segnali WT per le β-catenine); mediano l‟inibizione da contatto.
- Giunzioni TJ, mediano l‟adesione di cellule epiteliali ed endoteliali.
TJ cioè giunzioni “strette” formano una barriera che controlla la diffusione di lipidi e proteine fra le
porzioni apicali e basolaterali delle cellule.
Il passaggio di acqua e solventi attraverso le TJ è regolato attivamente.
Le proteine specifiche contenute nelle TJ sono: le Claudine che formano “tetraspam”cioè trapassano la
membrana 4 volte, implicate nel controllo della permeabilità cellulare; le Occludine aventi anch‟esse
struttura formata da 4 domini transmembrana; le JAM aventi un solo dominio transmembrana.
Tutte le proteine specifiche delle TJ sono contenute nei “ridges”cioè assemblamenti nastriformi di
proteine e lipidi a cui si associano proteine della famiglia MAGUK (“Membran Associated Guanilate
Kinasi Homologues) che regolano i rapporti con l‟actina.
Le MAGUK possono essere alterate nei tumori dai meccanismi di metastasi.
Le proteine intracellulari localizzate nelle giunzioni TJ sono dette ZO, responsabili del legame
all‟actina.
-Giunzioni GAP formate da proteine dette “Connessine”organizzate in “connessoni”cioè canali di 1,5
nm che lasciano passare ioni e molecole di basso peso molecolare tra una cellula e l‟altra.
Ogni membrana contiene un emicanale(connessone) formato da sei connessine
N.B. Le Catenine e la ZO-1 una volta libere e stabilizzate nel citosol possono agire come fattori
trascrizionali.
?cell-cell adhesions molecole: sono strutture intercellulari più lasse,spesso di tipo transiente.
Strutture di controllo della permeabilità para e transcellulare
Ricorda:
- Permeabilità paracellulare mediata da giunzioni;
- Permeabilità transcellulare mediata da sistemi di Fenestrae e Vescicolari.
Gli agenti in grado di aumentare la permeabilità (istamina,trombina VEGF) inducono lo
smantellamento delle strutture giunzionali spesso seguito da retrazione dell‟endotelio ed esposizione
del sottoendotelio.
La retrazione apre così delle discontinuità che lasciano passare proteine plasmatiche attraverso la
parete.
Gli stessi agenti che aumentano la permeabilità paracellulare sono anche in grado di aumentare il
numero di fenestrae o di vescicole di trasporto.
Quindi, molto probabilmente le due vie di regolazione agiscono in maniera sinergica.
Molecole di adesione leucocitaria
In condizioni normali i leucociti e i globuli rossi circolano rimanendo nella parte centrale della colonna
di flusso sanguigno.
In caso di infiammazione i piccoli vasi si dilatano, il flusso si riduce, permettendo così un contatto più
facile fra leucociti e cellule endoteliali.
Gli stimoli infiammatori cambiano anche le proprietà della membrana dell‟endotelio che diventa
adesiva per i leucociti, infatti le citochine infiammatorie (TNF,IL-1) inducono l‟espressione di
SELECTINE che mediano il rotolamento dei leucociti: E-selectina sulle cellule endoteliali (neosintesi);
P-selectina sulle piastrine,(neospeosizione); L-selectina sulla superficie leucocitaria.
Le selectine legano oligosaccaridi a loro volta associati a proteine; il legame fra zuccheri e proteine è
inizialmente blando, per questo motivo i leucociti rotolano!
Tuttavia l‟adesione parziale indotta dall‟aumento di espressione di selectine permette il rallentamento
dei leucociti.
A questo punto i leucociti si attivano ad opera delle chemochine prodotte nella zona di infiammazione,
aderendo più stabilmente all‟endotelio anche grazie alle Integrine che legano sull‟endotelio infiammato
VCAM, ICAM-1 ed ICAM-2.
Anche l‟espressione di queste ultime sull‟endotelio è regolata da citochine infiammatorie
I leucociti quindi inizialmente tendono a rotolare per poi fermarsi in punti specifici, appiattirsi contro la
superficie endoteliale, emettere pseudopodi tra le giunzioni interendoteliali e passare tra di esse; si
muovono quindi poi nel sottoendotelio e giungono alla zona di infiammazione.
DIFFERENZE MORFOFUNZIONALI FRA CELLULE ENDOTELIALI
Cellule endoteliali continue sono presenti nei capillari dei muscoli striati, del cuore, dei polmoni del
cervello.
Cellule endoteliali fenestrate sono presenti nei capillari delle ghiandole endocrine ed esocrine, nei
plessi vascolari nei villi intestinali; cioè essendo più permeabili sono espressi negli organi che devono
filtrare, assorbire, secernere.
Cellule endoteliali discontinue sono invece presenti nei capillari del fegato, di milza e dei linfonodi,
aventi pori cellulari ed aperture e membrana basale parzialmente/totalmente assente.
(vedi figura 48.10 pag. 1140)
Marcatori Endoteliali
Le cellule endoteliali esprimono marcatori specifici (utili per distinguerle da quelle circostanti) presenti
anche su cellule staminali emopoietiche o su leucociti e piastrine.
Endotelio Linfatico
È costituito da una rete di capillari a fondo cieco e a parete molto sottile, specializzati nel drenare la
linfa e i linfociti dal parenchima e convogliarli nel circolo sanguigno.
Al contrario del sistema ematico i linfatici formano un sistema che va in una sola direzione
convogliando la linfa al sistema venoso.
I capillari linfatici sono caratterizzati da un basso controllo della permeabilità, una membrana basale
molto sottile o assente, e spesso mancano di periciti.
Le cellule endoteliali si sovrappongono parzialmente a livello giunzionale in modo da poter espandere
il diametro vascolare in caso di sovraccarico di liquido.
FUNZIONI SPECIFICHE DELLE CELLULE ENDOTELIALI
Regolazione del flusso ematico e del tono vascolare
Le cellule vascolari hanno sviluppato alcuni “sensori”che monitorano le forze emodinamiche a cui esse
sono sottoposte: a questi segnali l‟endotelio può rispondere rilasciando sostanze vasoattive:
VASODILATATORI(prodotti esclusivamente dall‟endotelio arterioso)
NO:
- induce rilasciamento della muscolatura liscia dei vasi in quanto attiva la Guanilato-ciclasi;
- contrasta l‟azione vasocostrittrice dell‟angiotensina II e dell‟endotelina-1;
- è un inibitore dell‟aggregazione piastrinica, dell‟attivazione dei leucociti e della proliferazione delle
cellule muscolari lisce della tonaca media;
- è sintetizzato sia costitutivamente (atto a mantenere il normale tono vascolare) che in modo inducibile
(in seguito a stimoli rappresentati da TNF e IL-1) da due diversi enzimi;
- la diminuzione della produzione di NO è associata a patologie vascolari come aterosclerosi e diabete;
- una produzione esagerata ed incontrollata di NO può contribuire ad acuta vasodilatazione e calo
pressorio (shock settico);
- il NO è un effettore paracrino,cioè capace di agire solo sulle cellule muscolari lisce della tonaca
media immediatamente contigue alle cellule endoteliali che lo hanno prodotto.
Prostaciclina
- è una prostaglandina prodotta a partire dall‟acido acetilsalicilico dalla cicloossigenasi;
- il blocco della produzione di prostaciclina (da parte di aspirina per es.) non porta a variazioni
pressorie importanti;
- si pensa che sia un sistema di riserva che entra in azione per rafforzare l‟attività del NO in caso di
danno vascolare.
- inibisce adesione ed aggregazione piastrinica e quindi la formazione di trombi sulla parete
danneggiata.
VASOCOSTRITTORI
Endotelina-1
- piccola molecola in grado di indurre vasocostrizione e proliferazione delle cellule muscolari lisce
della tonaca media.
- stimola l‟attività vasocostrittrice di angiotensina II, serotonina e noradrenalina;
- induce ATTIVAZIONE delle piastrine e dei leucociti e facilita eventi trombotici o pro-aterosclerotici;
- esistono tre tipi di endotelina (1, 2, 3) codificate da geni diversi, ma l‟endotelio produce solo quella di
tipo 1; una volta prodotte non sono immagazzinate ma continuamente sintetizzate e secrete in maniera
costitutiva a concentrazioni molto basse;
- in alcune patologie come insufficienza renale, infarto del miocardio le concentrazioni di endotelina
aumentano notevolmente;
- l‟endotelina viene rimossa dal rene o dal polmone per internalizzazione.
Inoltre vengono prodotte anche angiotensinasi A e C, renina e Angiotensinaconvertasi(ACE).
L‟endotelio vascolare gioca ruoli critici nell‟emostasi, e una sua disfunzione contribuisce
all‟insorgenza di molti processi patologici.
Il mantenimento dello stato fluido del sangue è una funzione delle proprietà anticoagulanti
dell‟endotelio integro.La perdita di questa funzione è causa di trombi.
Nelle cellule endoteliali predominano le proprietà di controllo della coagulazione e della risposta
piastrinica(proprietà antitrombotiche).
Invece nelle cellule muscolari, nei fibroblasti, nelle componenti proteiche del sottoendotelio e nella
membrana basale prevalgono stimoli di attivazione dell‟emostasi (proprietà trombofiliche).
Agenti che influenzano l’endotelio in senso protrombotico
Sistemici: Ipertensione, Shock endotossico, Invecchiamento, Diabete, Aterosclerosi;
Organospecifici: Corononaropatie, Ipertensione polmonare, Insufficienza renale acuta e cronica,
Ischemia cerebrale.
Tutte le condizioni che determinano modificazioni del flusso ematico, causano danni all‟endotelio e
quindi disfunzione endoteliale che predispone a trombosi.
Pertanto un danno può essere dovuto:
1) a Turbolenza (quindi alle forze emodinamiche) in caso di:
- ipertensione;
- fibrosi delle valvole cardiache o placche arteriosclerotiche;
- endotossine batteriche;
- immunocomplessi;
2) a Stasi:
- dilatazioni anomale di arterie (aneurismi);
- nell‟infarto, dove la formazione di trombi è favorita dalla stasi che si crea per la presenza di regioni di
miocardio non contrattile;
- fibrillazione striale;
- RBCs deformi nell‟anemia falciforme;
- iperviscosità del sangue.
Agenti antitrombotici(proprietà anticoagulanti)
- Stimolo dell‟azione di Antitrombina III (AT-III);
- Produzione di Trombomodulina che è l‟attivatore della proteina C;
- Produzione di Proteina S;
- Produzione di Attivatore del Plasminogeno.
L‟eparano delle cellule endoteliali (o l‟eparina) stimola l‟attività di AT-III di circa 750 volte,
inducendo una modificazione allosterica del suo sito catalitico.
La Proteina C attiva la fibrinolisi che inattiva l‟Attivatore del Plasminogeno, degrada i Fattori VIII e V
della coagulazione.
L‟attività della proteina S è inibita dal legame con il frammento C4b del complemento, le cui
concentrazioni aumentano notevolmente durante i processi infiammatori o negli stati infettivi
(condizioni protrombotiche)
Le deficienze congenite o acquisite di proteina S sono responsabili di manifestazioni tromboemboliche
venose.
Modulazione della fibrinolisi: l‟attivatore del plasminogeno si lega insieme al plasminogeno alla fibrina
portando alla formazione di plasmina.
TRIADE DI VIRCHOW
Danno endoteliale(causa principale)
Alterazioni del flusso ematico
(concause)
Ipercoagulabilità
TROMBOSI!
ALTERAZIONI DELLE FUNZIONI DELLE CELLULE ENDOTELIALI
- Alterata produzione di prostacicline congenita o conseguente a farmaci (aspirina) o a patologie;
- Alterazioni del ricambio cellulare;
- Avitaminosi.
ATEROSCLEROSI
L‟aterosclerosi è una patologia da infiammazione cronica che causa l‟ispessimento delle arterie e la
perdita di elasticità. È caratterizzata dalla comparsa di tipiche lesione dette placche ateromatosa che si
sviluppano nel contesto dell‟intima e protrudono nel vaso riducendone il lume e indebolendone la
sottostante tonaca media.
N.B. La patologia colpisce principalmente le grosse e medie arterie ( = elastiche e muscolari) come
l‟aorta, le carotidi, coronarie e arterie poplitee. È tipica dei paesi progrediti essendo legata a
determinate abitudini alimentari e all‟invecchiamento.
COMPONENTI DELLA PARETE DELLE ARTERIE:
1) Cellule endoteliali;
2) Cellule della muscolatura liscia;
3) Matrice extracellulare (elastina, collagene, glicosaminoglicani).
Ogni arteria è costituita da:
- Tonaca intima;
- Tonaca media (nelle arterie muscolari prevalgono cellule muscolari, nelle arterie elastiche prevale la
matrice);
- Tonaca avventizia.
Le arterie si dividono in:
1) Grandi arterie (elastiche);
2) Medie arterie (muscolari);
3) Piccole arterie (arteriole).
Le vene non sono interessate da questo tipo di patologie.
SITI PREFERENZIALI DI SVILUPPO DEGLI ATEROMI
A) arterie elastiche (aorta; cardiali; iliache);
B) arterie muscolari (coronarie);
C) arterie che irrorano: cuore, cervello, reni, arti inferiori.
Nelle arterie in genere gli ateromi si sviluppano in zone di biforcazione dove il flusso è turbolento.
I PROTAGONISTI DI PATOLOGIE DI TIPO ATEROSCLEROTICO SONO CELLULE
MUSCOLARI LISCE E CELLULE ENDOTELIALI
CELLULE ENDOTELIALI:
- Intervengono nel mantenimento della permeabilità vasale;
- Intervengono nella regolazione dell‟emostasi (producendo molecole procoagulanti e anticoagulanti);
- Intervengono nella modulazione del flusso ematico (producendo vasocostrittori e vasodilatatori come
l‟NO);
- Intervengono nella regolazione dell‟infiammazione, producendo citochine proinfiammatorie come
IL-1, chemochine, molecole di adesione come PECAM, E o P-selectina, VCAM;
- Intervengono nella crescita cellulare e nella riparazione dell‟endotelio (producendo fattori di crescita
come ODGF, FGF, CSF);
- Intervengono nell‟ossidazione delle LDL: nella forma non ossidata sono nel sangue, mentre nella
forma ossidata oltrepassano l‟endotelio ed entrano nell‟intima.
CELLULE MUSCOLARI LISCE:
- Hanno attività contrattile (hanno fenotipo contrattile, ma possono anche secernere elementi di
matrice);
- Intervengono nella produzione di collagene, elastina e glicosaminoglicani;
- Normalmente sono localizzate nella tonaca media, molto vicino ai fibroblasti; sono in grado di
migrare verso l‟intima indebolendo la tonaca muscolare. Questo processo è noto come “ispessimento
intimale” (fisiologico con l‟età) e avviene anche a causa della produzione di matrice extracellulare di
tipo fibroso.
Nell‟aterosclerosi questo tipo di migrazione è amplificata.
FATTORI DI RISCHIO
1) ETA‟: L‟aterosclerosi è una patologia degenerativa che si sviluppa in età avanzata.
2) SESSO: Gli ormoni femminili, prodotti in età fertile, sono protettivi.
3) FATTORI GENETICI.
4) IPERLIPIDEMIA: patologia che porta ad aumento di LDL ematiche.
5) IPERTENSIONE: aumenta la tensione in alcune diramazioni; il sangue provoca sollecitazione più
significativa nei vasi.
6) FUMO DI SIGARETTA: è un fattore di rischio a causa degli stimoli proinfiammatori che ha
sull‟endotelio.
7) DIABETE: c‟è un‟alterata mobilizzazione dei lipidi.
8) OMOCISTEINURIA: l‟omocisteina induce stimolo proinfiammatorio sull‟endotelio.
In generale questi sopraelencati sono stimoli che tendono ad attivare le cellule endoteliali.
Un fattore protettivo nei confronti dell‟aterosclerosi è l‟alto livello di HDL circolanti: le LDL che
penetrano nell‟intima vengono captate e internalizzate dai macrofagi grazie a recettori scavenger
diventando HDL che sono rimosse in circolo.
FASI DI FORMAZIONE DI PLACCA ATEROMATOSA
1) Sollecitazione endoteliale di tipo perturbativo: infiammazione, tensione etc.
2) Disfunzione endoteliale: aumento della permeabilità, adesione leucocitaria e delle piastrine.
3) Migrazione di monociti e linfociti T nell‟intima: produzione di IL-1 e TNF, con richiamo di altri
monociti e produzione di ROS (si instaura un processo infiammatorio); ossidazione di LDL che
penetrano nello strato sottoendoteliale per aumentata permeabilità vasale e non legano più recettori per
LDL, ma recettori scavenger.
4) Formazione di cellule schiumose: i macrofagi con recettori scavenger fagocitano le LDL.
5) Le cellule schiumose producono PDGF, FGF e TGF (da parte dei macrofagi nella parete): questo
stimola la migrazione e il richiamo di cellule della muscolatura liscia, che cambiano il loro fenotipo da
contrattile a secernente.
Sono richiamate perché c‟è un danno sull‟intima a causa dell‟infiammazione. Queste cellule vanno a
ricoprire le cellule schiumose sul sito infiammatorio con un “cappuccio” di collagene prodotto dalle
cellule muscolari lisce stesse, formando l‟ateroma che si ingrandisce sempre di più per deposizione di
tessuto fibroso.
Si forma un core centrale lipidico e necrotico che richiama nuovi macrofagi.
Le caratteristiche di aterosclerosi sono quelle di infiammazione cronica.
ROTTURA DELLA PLACCA: gli ateromi più fragili, (cioè quelli con una capsula fibrosa sottile, o
infiltrati da numerosi vasi deformatosi per consentire l‟accrescimento della lesione stessa), possono
rompersi in maniera improvvisa dando luogo all‟attivazione del processo coagulativo che può esitare
nella formazione di un trombo, che occludendo il vaso determina ischemia del distretto a valle.
CLASSIFICAZIONE DELLE LESIONI ATEROMATOSE
- TIPO I (iniziale): macrofagi isolati e poche cellule schiumose;
- TIPO II (stria lipidica): stria gelatinosa di cellule schiumose subendoteliale, si ritrova in maniera
ubiquitaria in tutti i tipi di arterie, non è patogenetica; (il deposito lipidico è intracellulare);
- TIPO III (intermedia): stria lipidica con alcune cellule schiumose morte che rilasciano il contenuto
lipidico;
- TIPO IV(ateroma): nucleo di lipidi extracellulari e frammenti di cellule necrotiche circondato da
cellule schiumose;
- TIPO V (fibroateroma): ateroma racchiuso in una capsula fibrosa calcificata;
- TIPO VI (aterosclerosi complicata): l„ateroma si rompe e i frammenti vagano in circolo come emboli.
Si ha inoltre l‟attivazione del processo coagulativo con formazione di un trombo che può occludere il
vaso causando necrosi ischemica nei tessuti a valle.
Esempi di ciò che accade nei tessuti a valle: 1) IMA coronarie; 2) ictuscarotidi; 3) gangrena secca
poplitea.
COMPONENTI DELLA PLACCA ATEROMATOSA (TIPI V E VI)
- Cellule endoteliali;
- Matrice extracellulare composta prevalentemente da collagene e cellule della muscolatura liscia
(cappuccio fibroso),
- Cellule della muscolatura liscia e macrofagi infarciti di lipidi (cellule schiumose);
- Linfociti T;
- Nucleo centrale necrotico con lipidi extracellulari.
N.B. Nelle lesioni più avanzate c‟è angiogenesi con formazione di nuovi capillari.
La dimensione, la vascolarizzazione e il cappuccio fibroso permettono all‟ateroma di diventare
complicato.
- Se si rompe il cappuccio l‟intima è esposta e si innescano processi coagulativi con il rischio di
formazione di trombi. La presenza di capillari favorisce la rottura perché destabilizza il cappuccio.
- L‟ateroma può staccarsi, passando in circolo, aumentando il pericolo di embolie.
CONSEGUENZE CLINICO-PATOLOGICHE
PATOLOGIE CRONICHE ISCHEMICHE: infarto del miocardio; infarto cerebrale (ictus); gangrena
delle estremità; aneurisma aortico-addominale: c‟è perdita di consistenza e indebolimento delle arterie
a causa di migrazione di cellule della muscolatura liscia verso l‟intima.
- PREVENZIONE PRIMARIA: ritardo o regressione degli ateromi, con controllo dell‟alimentazione e
abitudini della popolazione.
- PREVENZIONE SECONDARIA: prevenzione di recidive di infarto in pazienti con patologia
sintomatica.
Si basa su: astensione dal fumo, controllo dell‟ipertensione, moderazione nel consumo di alcool (che
aumenta la produzione e la mobilizzazione dei lipidi), riduzione di LDL e aumento di HDL ematici.
PATOLOGIA VASCOLARE
La circolazione sanguigna, grazie ad un‟adeguata perfusione degli organi periferici, assicura ossigeno e
nutrienti ai tessuti e rimuove i cataboliti.
EMORRAGIA: perdita di sangue attraverso un vaso lesionato.
Cause della lesione:
- traumi (ferite);
- aneurismi (dilatazione) che indeboliscono la parete;
- esposizione all‟endotelio (flogosi o infiltrazione neoplastica);
- diminuzione delle piastrine o dei fattori della coagulazione.
L‟emorragia può essere:
- esterna;
- interna:
1) petecchia: emorragia cutanea puntiforme;
2) ecchimosi: raccolta di sangue nel sottocute conseguente ad un trauma non lacerante o a malattia
emorragica;
3) ematomi: raccolta di sangue nei tessuti molli;
4) emotorace/emopericardio/emoperitoneo;
5) porpora: emorragie cutanee diffuse di 1 cm di diametro (malattie della coagulazione).
I meccanismi fisiologici attuati in risposta all‟emorragia sono:
- vasocostrizioneriduce la fuoriuscita di sangue, mantiene la pressione arteriosa, sposta il sangue
dagli organi periferici a quelli vitali.
- aumento della frequenza cardiaca.
- richiamo di liquidi dal liquido extracellulare mantiene la volemia (diminuzione ematocrito).
- eritropoiesi ristabilisce l‟ematocrito normale.
IPEREMIA ATTIVA E PASSIVA
Condizione di aumento della quantità di sangue in un organo o tessuto.
Si ha per aumento del flusso per apertura degli sfinteri precapillari e reclutamento della circolazione dei
capillari esclusi (iperemia attiva) oppure per impedimento a valle del deflusso venoso (iperemia passiva
o congestizia).
IPEREMIA ATTIVA: associata all‟esercizio fisico e ad alcune condizioni ormonali (ipertiroidismo,
mucosa uterina e tessuto mammario in alcune fasi del ciclo, menopausa) e all‟attivazione locale della
risposta infiammatoria.
Esempi:
- vampate e rossore al viso;
- reattività della cute agli stimoli meccanici (soggettivo);
- dermografismo (ogni lieve pressione provoca arrossamento ed edema).
IPEREMIA PASSIVA: si ha un accumulo di sangue venoso per un impedito flusso. Più spesso
associata a insufficienza acuta della pompa sinistra (infarto del miocardio, miocardite acuta, ecc.).
Il sangue si accumula soprattutto nei polmoni originando edema polmonare.
L‟aumento della pressione idrostatica, a livello del microcircolo polmonare, è responsabile della
formazione di trasudato; questo si accumula nell‟interstizio e negli alveoli dando luogo ad una grave
sindrome respiratoria, metabolica ed emodinamica, fino allo shock.
Altri organi che possono essere colpiti sono: fegato, milza e reni. Il trasudato si accumula
proporzionalmente negli interstizi (edema) e parzialmente nelle grandi cavità associate agli organi e
tessuti coinvolti, come la cavità peritoneale (ascite) e pleurica (trasudato pleurico).
ISCHEMIA: mancata perfusione di un tessuto. Può essere dovuta a:
- diminuzione della pressione arteriosa (shock);
- ostruzione dell‟arteria afferente (per trombo o embolo);
- ostruzione del deflusso venoso (per trombo o embolo).
Nei tessuti ischemici si ha un risotto apporto di ossigeno e nutrienti, quindi si ha diminuzione della
sintesi di ATP, che porta quindi a:
- attivazione di glicolisi in condizioni anaerobie che porta ad aumento di acido lattico (quindi acidosi);
- disfunzione mitocondriale: aumento di ROS = stress ossidativo;
- alterata omeostasi ionica (malfunzionamento delle pompe) che porta a rigonfiamento cellulare,
ingresso di calcio, attivazione di caspasi e quindi apoptosi.
Le cellule ischemiche subiscono un danno inizialmente reversibile, che in un secondo momento può
diventare irreversibile e causare necrosi.
Esempi:
- Infarto: necrosi ischemica di un numero consistente di cellule; può essere:
1) bianco (ischemico): è dovuto all‟occlusione di un‟arteriola terminale con conseguente necrosi
ischemica del tessuto a valle; le vene drenano il sangue rimasto nell‟organo che così appare esangue.
Sono suscettibili a infarti bianchi: cuore, rene e milza.
2) rosso (emorragico): è dovuto alla rottura di vasi in prossimità nell‟area ischemica necrotica, oppure
all‟ostruzione di deflusso venoso con conseguente iperemia passiva.
SHOCK (collasso cardiocircolatorio): grave cedimento emodinamico con conseguente ipoperfusione
degli organi vitali. Si manifesta con:
- ipotensione grave;
- ipotensione repentina;
- ipotensione prolungata.
Esistono diversi tipi di shock:
1) SHOCK CARDIOGENO insufficienza della pompa cardiaca che porta ad una diminuzione della
gittata cardiaca (esempi sono: IMA, miocarditi fulminanti, tamponamento, scompenso).
Gli organi periferici congesti di sangue venoso. L‟ematocrito è normale.
2) SHOCK IPOVOLEMICO diminuzione della volemia causato da: emorragia acuta, perdita di
liquidi (sudorazione, vomito, diarrea, ustioni estese).
Si assiste alla vasocostrizione cutanea per cui il paziente appare pallido e freddo, in più c‟è un richiamo
di liquidi dal liquido extracellulare che porta ad una diminuzione dell‟ematocrito.
3) SHOCK SETTICO è la conseguenza di una risposta sistemica sregolata alla setticemia da batterio
gram negativo.
Si assiste all‟iperattivazione dei leucociti che rilasciano grandi quantità di citochine (tempesta
citochinica). Tali citochine stimolano gli endoteliociti al rilascio di vasodilatatori (vasodilatazione) e
inducono gli endoteliociti all‟apoptosi (insensibilità ai vasocostrittori). Tutto questo comporta un
quadro di grave ipotensione.
4) SHOCK ANAFILATTICO è dovuto all‟abbondante rilascio di vasodilatatori (ipotensione) e
permeabilizzanti (diminuzione della volemia e aumento dell‟ematocrito) in seguito all‟esposizione di
un individuo allergico ad un allergene.
IPERTENSIONE (la pressione arteriosa deve essere compresa in condizioni normali fra 140/90
mmHg): è uno dei più importanti fattori di rischio cardiovascolare; può portare a:
- cardiopatia ipertensiva: ipertrofia ventricolare più scompenso;
- aterosclerosi: dissezione dell‟aorta;
- insufficienza renale;
- ictus.
PRESSIONE ARTERIOSA (PA) = gittata cardiaca (GC) x resistenze periferiche.
La gittata cardiaca dipende dalla volemia (a sua volta determinata dall‟omeostasi sodica
dell‟organismo, dal ritorno venoso (e conseguentemente dalla forza di contrazione sviluppata dal
miocardio, per la legge di Starling), dalla frequenza cardiaca (essendo la GC = (volume telediastolico volume telesistolico) x frequenza cardiaca).
La resistenza dipende principalmente dal tono delle arteriole che viene regolato attraverso:
- regolazione sistemica: il rene ipoperfuso, libera renina che attiva il sistema
renina-angiotensina-aldosterone. L‟angiotensina II è un vasocostrittore. Il SNA riceve riflessi
barocettivi e chemocettivi e provoca vasocostrizione con le fibre adrenergiche ortosimpatiche e
vasodilatazione con quelle colinergiche parasimpatiche.
- regolazione locale: equilibrio tra vasodilatatori (PGI2 e NO) e vasocostrittori (ET).
Ipertensione secondaria (5%):
- feocromocitoma: tumore della midollare del surrene secernente adrenalina (vasocostrizione).
- iperaldosteronismo primario (sindrome di Conn): eccessiva produzione di aldosterone con
conseguente riassorbimento di sodio e acqua (che porta ad un aumento della volemia).
- ipercortisolismo primario (sindrome di Cushing): il cortisolo prodotto in eccesso mima l‟azione
dell‟aldosterone sul suo recettore (aumento della volemia).
- ipertensione da abuso di liquirizia: alcuni componenti della liquirizia impediscono la conversione del
cortisolo in cortisone, che accumulandosi mima l‟azione dell‟aldosterone.
- ipertensione nefrovascolare: la stenosi dell‟arteria renale causa ipossia nell‟organo che così libera
renina attivando il sistema renina-angiotensina-aldosterone (aumento della volemia).
Ipertensione primaria (idiopatica o essenziale) (95%):
- malattia multifattoriale ad indiscutibile base genetica ereditaria; sono diversi i geni che possono
risultare alterati, implicati nella regolazione della volemia (renina, angiotensinogeno, ACE,
angiotensina-II-R, aldosterone e suo recettore, ADH, acquaporine) o delle resistenze periferiche
(angiotensina-II-R, recettori per: A/NA/A/5HT, ET e suo recettore).
Inoltre è certo che nella patogenesi della malattia giochino un ruolo fondamentale fattori ambientali
quali: fumo, stress, dieta ricca di sale, sedentarietà.
Esistono malattie genetiche rare responsabili dell‟alterato controllo delle volemie da parte del rene
(sindrome di Lidde: ipersensibilità all‟aldosterone con conseguente eccessivo riassorbimento di NaCl
da parte delle cellule principali del dotto collettore.
FISIOPATOLOGIA GENERALE DEL CUORE
Organo muscolare cavo provvisto di 4 camere (due atri e due ventricoli), la cui funzione è quella di
generare il gradiente pressorio necessario per spingere il sangue nei circoli polmonare e sistemico.
Sistema di conduzione:
a) nodo seno-atriale;
b) nodo atrio-ventricolare;
c) fascio di His.
Le cellule del sistema specifico generano e conducono l‟impulso, e sono responsabili del ritmo.
- Cardiomiociti: voluminose singole cellule contrattile disposte a spirale a costituire le pareti delle
camere cardiache unite in un sincizio funzionale (miocardio) per mezzo dei dischi intercalari, ove si
realizza l‟accoppiamento meccanico ed elettrico. Sotto certi stimoli i cardiomiociti possono rigenerare.
- Cellule P (pacemaker): cellule non contrattili autoeccitabili dei nodi, preposte alla genesi dello
stimolo depolarizzante;
- Cellule di Purkinje: cellule non contrattili autoeccitabili a bassa frequenza presenti nel sistema di
conduzione, preposte alla trasmissione dello stimolo depolarizzante;
- Cellule endoteliali: rivestono dall‟interno le camere cardiache, costituendo l‟endocardio;
- Pericardiociti.
Esistono tre livelli di regolazione del cuore:
1) Nervoso: le fibre noradrenergiche del simpatico (recettori Beta-1) hanno un effetto inotropo,
cronotropo, e dromotropo positivo. Azione opposta determinano le fibre colinergiche parasimpatiche a
livello dei recettori muscarinici M2.
2) Ormonale: il T3 incrementando il metabolismo ossidativo produce tachicardia.
3) Intrinseco al cuore stesso: il cuore regola autonomamente la propria attività in base alla disponibilità
di substrati energetici grazie ai recettori per l‟AMP (bradicardizzanti) e per l‟ATP (tachicardizzanti).
Inoltre l‟aumento del ritorno venoso, determinando l‟ottimale distensione dei sarcomeri, produce un
effetto inotropo positivo (legge di Franklin-Starling).
* 4) Elettrolitico: l‟ipercalcemia porta alla contrazione spastica del cuore; l‟ipocalcemia si associa a
flaccidità, l‟ipercalemia iperpolarizza le cellule con effetto dromotropo e batmotropo negativo.
METABOLISMO CARDIACO è basato essenzialmente sull‟ossidazione degli acidi grassi.
Il cuore è irrorato dalle arterie coronarie che originano direttamente dall‟aorta distale; decorrono sulla
superficie del cuore (arterie coronarie epicardiche), penetrano nel miocardio (arterie coronarie
intramurale) e generano un plesso subendocardico. A riposo il flusso coronarico prevalentemente
diastolico, è pari al 5% della gittata cardiaca.
CONDIZIONI CHE CAUSANO UN DEFICIT DI FUNZIONE DI POMPA (scompenso o
insufficienza cardiaca):
- alterazioni strutturali del miocardio;
- difetti molecolari (es. per mutazioni genetiche) delle proteine contrattili del miocardio;
- alterazioni del metabolismo delle fibre cardiache;
- patologie pericardiche o valvolari;
- sovraccarico di una o di tutte le sezioni del cuore (es. ipertensioni).
Se il cuore è in sovraccarico deve fare più lavoro e questo può dare patologia.
Potenzialmente tutte le patologie del cuore possono dare scompenso; lo scompenso è una condizione
patologica in cui il cuore non riesce a pompare sangue adeguato alle richieste metaboliche
dell„organismo.
Il cuore è dotato di “riserva cardiaca”, e cioè capace di attivare meccanismi fisiologici (dilatazione e
ipertrofia) per adattarsi alle aumentate richieste di lavoro (L = VxP).
Se il cuore viene sottoposto a stimoli patologici intensi e prolungati (- sovraccarico pressorio cronico
postcarico dovuto ad ipertensione arteriosa, polmonare, e stenosi valvolare; - sovraccarico di
volume cronico precarico dovuto ad insufficienza valvolare, ipervolemia; dovuta a proteine
contrattili mutate, infarto del miocardio endocarditi, pericarditi), entro certi limiti (che non sono
facilmente distinguibili) comunque può compensare.
Nella fase iniziale lo scompenso riguarda l‟uno o l‟altro ventricolo (camera); in un secondo momento
diventa globale.
Lo scompenso di manifesta con diminuzione della gittata cardiaca e ristagno di sangue nel circolo
venoso.
Quando la contrazione torna ad essere efficiente, per i suoi meccanismi automatici, o per terapia
farmacologica, si dice che l‟insufficienza è stata compensata.
Ipoperfusione e congestione sono alla base di tutti i sintomi di insufficienza cardiaca.
L‟insufficienza si divide in:
- anterograda: il cuore scompensato ha una diminuita gittata cardiaca, da cui deriva una diminuzione
della perfusione periferica. L‟ipoperfusione renale, avvertita dall‟apparato juxtaglomerulare, determina
l‟attivazione del sistema renina-angiotensina-aldosterone con conseguente riassorbimento di sodio e
acqua dal torrente circolatorio periferico e un aumento della volemia: ciò favorirà l‟iperemia passiva
degli organi e dunque la formazione di edema (caratteristico dall‟insufficienza perfusionale).
- retrograda: il cuore scompensato ha una diminuita frazione d‟eiezione: l‟incrementato volume
telesistolico, impedisce il corretto riempimento diastolico e determina l‟aumento della pressione venosa
a monte. La congestione venosa polmonare, determina edema polmonare e dispnea; la congestione
venosa sistemica determina edema generalizzato, ma l‟organo che più risente della stasi sanguigna è il
fegato che va incontro a processi degenerativi (fegato da stasi e cirrosi cardiaca) insufficienza
congestizia.
CAUSE CHE PREDISPONGONO A SCOMPENSO:
- Insufficiente contrazione del miocardio (miocardite acuta, insufficienza coronarica);
- Eccesso di lavoro per il cuore (ipertensione, stenosi o insufficienza valvolare).
FATTORI PRECIPITANTI DEL QUADRO DI SCOMPENSO:
Sono fattori che agiscono su un quadro cronico preesistente.
Tra questi abbiamo:
- infezioni, endocarditi e crisi ipertensive.
(I sintomi di insufficienza cardiaca riguardano l‟apparato respiratorio, la muscolatura e il cervello).
Una maggiore richiesta di lavoro per il cuore può essere soddisfatta con due meccanismi:
1) Dilatazione patologica;
2) Ipertrofia del miocardio.
Entrambi questi meccanismi possono determinare specifiche cardiopatie generando quadri patologici in
grado di esitare nello scompenso cardiaco.
Esempi di condizioni che danno un sovraccarico di lavoro sono:
1) ipertensione arteriosa;
2) stenosi aortica o polmonare;
3) insufficienza mitralica;
4) stenosi mitralica.
Una maggiore richiesta di lavoro può determinare:
- Sovraccarico di pressione (aumenta la componente pressoria, senza che venga alterato il volume delle
camere);
- Sovraccarico di volume quando la richiesta di lavoro cresce ancora (aumento stabile del volume di
una sezione del cuore).
Tale distruzione si riflette in diversi tipi di ipertrofia (caratterizzato nei miociti da aumento della
sintesi proteica, aumento del numero dei sarcomeri, aumento del numero dei mitocondri, e aumento di
dimensione/massa delle cellule).
1) Ipertrofia concentrica (sovraccarico pressorio) dovuta ad un aumento del postcarico con
aumentato diametro e spessore dei miociti, in quanto i sarcomeri in aggiunta sono assemblati in
parallelo; lo spessore della parete aumenta proporzionalmente alla forza di contrazione, ma il volume
della camera si riduce disfunzione diastolica.
2) Ipertrofia eccentrica (sovraccarico di volume) dovuta ad un aumento del precarico con aumentata
lunghezza dei miociti, in quanto i sarcomeri in aggiunta sono assemblati disordinatamente. Il volume
della camera aumenta nel tentativo di mantenere invariata la gittata cardiaca, mente lo spessore della
parete è invariato o ridotto disfunzione sistolica.
Un esempio di ipertrofia fisiologica si osserva negli sportivi, specie se si trovano in montagna, perché il
sangue è più viscoso e il cuore deve fare più lavoro.
Anche persone che vivono a 2500 metri hanno fisiologicamente ipertrofia del miocardio.
BASI MOLECOLARI
Alla base del passaggio tra ipertrofia fisiologica e ipertrofia patologica, ci sono basi molecolari ben
diverse.
In entrambi i casi si osserva aumento della sintesi proteica, per aumentata trascrizione dei geni
dell‟RNA ribosomiale.
L‟ipertrofia è il risultato di due fasi: induzione e mantenimento.
La componente importante nell‟induzione dell‟ipertrofia è l‟alterazione a carico dello stroma,
rappresentata da fibrosi interstiziale che determina incremento della matrice proteoglicanica e aumento
del collagene.
Nella fase di induzione (angiotensina II e endotelina-1) ci sono eventi che innescano il pathway di
proteine G nei cardiomiociti.
Sperimentalmente si possono bloccare recettori per l‟angiotensina II.
Fibrosi interstiziale miocardica: sono coinvolti due fattori: IGF1 e TGF . C‟è mutazione di un gene che
codifica per una proteina del sarcomero contrattile alterata.
Dato che il cuore non si contrae bene (a causa della proteina mutata) sono rilasciati IGF-1 e TGF che
determinano ipertrofia dei cardiomiociti e inducono i fibroblasti a secernere collagene questo porta a
fibrosi interstiziale del miocardio. Sono coinvolti anche angiotensina II e endotelina-1 oltre a IGF-1 e
TGF .
Nella fase di induzione c‟è stimolazione con endotelina-1 e angiotensina II vengono upregolati fos,
myc, jun.
Fase di mantenimento: entrano in gioco fattori che agiscono su geni per proteine del sarcomero: TEF-1
e MEF-2, fattori di crescita (IL-1, IL-6, IGF-1, TGF ).
Mutazioni delle proteine strutturali sono alla base delle cardiomiopatie ipertrofiche; tra queste abbiamo:
- mutazioni nei geni che codificano per la catena pesante della -miosina (35% dei casi);
- “ “ “ “ “ “ “ “ “ “ “ “ “ troponina T (15% dei casi);
- “ “ “ “ “ “ “ “ “ “ “ “ “ proteina C legante la miosina (15% dei casi);
- “ “ “ “ “ “ “ “ “ “ “ “ “ tropomiosina (0,5% dei casi).
Non in tutte le ipertrofie del miocardio sono alterate queste proteine; queste sono comunque le più
frequenti. Vi sono altre mutazioni di senso di -miosina correlate con un alto grado di ipertrofia che
può portare a malattia.
I meccanismi responsabili dell‟alterazione dei geni sono diversi tra ipertrofia eccentrica e ipertrofia
concentrica.
ASPETTI COMUNI ALLE VARIE FORME DI IPERTROFIA:
- Aumento del numero e del volume dei mitocondri;
- Maggiore sviluppo delle creste mitocondriali;
- Iperplasia del RE.
Nell‟ipertrofia patologica è stata evidenziata anche la presenza di necrosi-apoptosi di alcuni
cardiomiociti, con down-regolazione di alcuni geni e up-regolazione di altri.
Nell‟ipertrofia fisiologica invece c‟è sofferenza dei cardiomiociti, che è reversibile, per cui le cellule
non muoiono.
QUINDI: L‟ipertrofia è dovuta a: ipertensione (sovraccarico pressorio), malattie valvolari, infarto del
miocardio.
MALATTIE DEL MIOCARDIO:
1) CARDIOMIOPATIE:
- Dilatative: gravi patologie del miocardio caratterizzate dalla progressiva dilatazione cardiaca con
disfunzione sistolica che evolve rapidamente verso insufficienza cardiaca congestizia. La dilatazione
della cavità favorisce l‟insorgenza di fenomeni trombotici. Rappresentano una delle principali
indicazioni al trapianto di cuore; si distinguono in primarie (idiopatiche o genetiche) e secondarie
(alcoliche o infettive). La forma secondaria fa seguito a miocarditi infettive tossico-allergiche,
dismetaboliche.
Ci sono fattori genetici coinvolti, ma il quadro idiopatico (a eziologia sconosciuta) è prevalente. La
diagnosi è possibile anche prima che si sviluppi l‟insufficienza cardiaca, grazie a: dilatazione
ventricolare, riduzione della funzione contrattile, evoluzione verso insufficienza cardiaca.
- Ipertrofiche: patologie miocardiche caratterizzate da ipertrofia miocardica con disfunzione diastolica;
il ridotto volume telediastolico, determina stasi venosa polmonare e dispnea. Esiste solo in forma
primaria, dovuta ad alterazione dei geni per le proteine sarcomeriche (beta-miosina, troponina T e
troponina C) trasmesse con eredità autosomica dominante. Le proteine ipocontrattili determinano
disfunzione dei cardiomiociti che così liberano GF inducendo ipertrofia compensatoria e fibrosi
interstiziale.
- Restrittive: patologie miocardiche caratterizzate dalla ridotta distensibilità ventricolare con
conseguente disfunzione diastolica che evolve verso insufficienza cardiaca congestizia. Può essere
idiopatica, o dovuta a fibrosi radioterapica, amiloidosi cardiaca, metastasi tumorali.
2) MALATTIE SPECIFICHE DEL MIOCARDIO (Miocarditi e miocardiopatie):
- Infettive: da batteri (Streptococco, Corynebacterium Diphteriae), protozoi e virus;
- Dismetaboliche: da disordini nutrizionali e amiloidosi miocardiche;
- Sistemiche: reumatismo articolare autoimmune, LES.
MALATTIE CHE COINVOLGONO IL MIOCARDIO (CARDIOPATIE), MA SOLO COME ESITO
FINALE DI PROCESSI MORBOSI RICONDUCIBILI AD ALTRI DISTRETTI DELL‟APPARATO
CARDIOVASCOLARE:
1) ANORMALITA‟ EMODINAMICHE:
- Malformazioni congenite del cuore e dei grossi vasi;
- Vizi valvolari acquisiti (endocarditi);
- Cuore polmonare cronico;
- Cardiopatia ipertensiva.
2) ANORMALITA‟ DEL FLUSSO PER OSTRUZIONE DELLE CORONARIE:
- Cardiopatia ischemica.
3) ANORMALITA‟ PERIVISCERALI NON MIOCARDICHE:
- Malattie del pericardio.
MALFORMAZIONI CONGENITE
Si traducono in vizi valvolari oppure in comunicazioni anomale fra le cavità cardiache e i vasi.
Si ha un sovraccarico pressorio, cui segue un aumento di volume a carico di una o più camere
cardiache.
VIZI VALVOLARI ACQUISITI
Vizi valvolari acquisiti, come le stenosi o le insufficienze valvolari, determinano alterazioni strutturali
del miocardio (come ipertrofia etc.), dalle quali deriva tutta la successiva evoluzione della cardiopatia.
- L‟insufficienza valvolare determinando un “rigurgito”, causa un sovraccarico di volume delle cavità a
monte, e un aumento del lavoro cardiaco a valle.
- Le stenosi valvolari ostacolando la fuoriuscita del sangue della camera a monte, causa un aumento del
lavoro cardiaco per sovraccarico di pressione.
PRECARICO: Carico che distende il muscolo cardiaco alla lunghezza di lavoro. L‟aumento di
precarico determina un aumento della lunghezza delle fibre muscolari .
N.B. Un aumento della pressione arteriosa, può aumentare il precarico, aumentando la forza di
contrazione e permettendo così al cuore di pompare contro una pressione aumentata.
POSTCARICO: Carico contro il quale il muscolo cardiaco si trova ad operare. Un aumento del
postcarico riduce la velocità e l‟intensità di accorciamento muscolare durante la contrazione.
CUORE POLMONARE
Cardiopatia derivante da un aumento permanente del postcarico del ventricolo destro conseguente a
ipertensione arteriosa polmonare secondaria o broncopneumopatia cronica ostruttiva o embolia dei vasi
polmonari. La forma acuta è spesso associata ad embolizzazione dei rami dell‟arteria polmonare; la
forma cronica consegue ad aterosclerosi del circolo polmonare, o più spesso a riduzione del letto
vascolare polmonare (per enfisema, TBC, BPCO). Il ventricolo destro è dilatato ed ipertrofico; si ha
ipossiemia cronica (che si manifesta con cirrosi ed ipercapnia) che induce la produzione di
eritropoietina con conseguente poliglobulia che contribuisce ad incrementare ulteriormente il
postcarico.
CARDIOPATIA IPERTENSIVA
Cardiopatia derivante da esistenza di ipertensione arteriosa sistemica che aumenta la resistenza
periferica e quindi il postcarico del ventricolo sinistro.
Il miocardio risponde all‟aumento del postcarico che corrisponde all‟ipertensione sistemica cronica con
rimodellamento ipertrofico: l‟aumento dello spessore della parete (SP) e la riduzione del volume della
cavità (diminuisce il raggio), tipici dell‟ipertrofia concentrica, consentono la riduzione della tensione di
parete (T) secondo la legge di La Place: T = P x r / 2(SP). Durante lo sviluppo della ipertrofia si assiste:
- alla sintesi di isoforme immature delle proteine contrattili che aggravano la disfunzione miocardica;
- al deterioramento della perfusione coronarica a causa dell‟aumento della massa cardiaca e dello
schiacciamento delle arterie intramurali, con successivo danno ischemico;
- alla fibrosi interstiziale che peggiora la disfunzione diastolica.
Quindi il quadro clinico può evolvere verso lo scompenso durante il quale il cuore può dilatarsi.
Criteri minimi per la diagnosi di cardiopatia ipertensiva:
1) Ipertrofia del ventricolo sinistro, in assenza di concomitanti malattie cardiovascolari;
2) Evidenza di ipertensione arteriosa anche lieve (>140/90 mmHg).
L‟ipertensione primaria è associata a predisposizione genetica, mentre in una minoranza di casi ci sono
patologie associate.
L‟ipertensione in sé non è una malattia, ma predispone all‟insorgenza di altre malattie.
CARDIOPATIA ISCHEMICA o INSUFFICIENZA CORONARICA
Cardiopatia derivante da ischemia di uno o più distretti (nella maggior parte dei casi ostruzione
coronarica) i cui effetti sul miocardio possono essere caratterizzati da una necrosi circoscritta con
eventuale sostituzione fibrosa.
Gli effetti della necrosi fanno sì che la massa muscolare capace di produrre lavoro è fortemente
diminuita.
C‟è una predisposizione a infarto del miocardio, se le condizioni di ostruzione si manifestano allo
stesso modo in due individui, però non è detto che in entrambi si avrà infarto.
MALATTIE DEL PERICARDIO
Ostacolano la dilatazione delle cavità cardiache con diminuzione del ritorno venoso e successivamente
del precarico.
Sono dovute principalmente a:
1) Emorragie intrapericardiche (con riempimento di sangue nella cavità pericardica);
2) Pericarditi acute che insorgono in seguito a infezioni da streptococchi e da micobatteri tubercolari (la
causa è soprattutto la risposta immunitaria).
3) Pericarditi croniche: esiti di processi fibrotici indotti da alcune forme acute che evolvono in
insufficienza circolatoria.
4) Invasioni neoplastiche per metastasi pleuriche (esito di carcinomi polmonari).
EMORRAGIE INTRAPERICARDICHE:
In alcune situazioni patologiche il sacco pericardico che di norma contiene 30-50 ml di liquido limpido
e trasparente può riempirsi di sangue o di pus (pericardite purulenta). Se il riempimento è rapido e
consistente si potrà avere “tamponamento cardiaco” che si manifesta con diminuzione del volume
telediastolico, diminuzione della gittata, tachicardia compensatoria.
Non rare. Causate da:
- traumi penetranti o processi patologici che evadono le pareti dei vasi arteriosi;
- rottura del cuore per aneurismi del ventricolo sinistro o aneurisma dell‟aorta;
- infiltrazioni neoplastiche da tumori pleurici o linfomi;
- iatrogene: massaggi cardiaci, lacerazioni per introduzione del catetere.
PERICARDITE
Dovuta ad agenti infettivi (virus e TBC), agenti fisici (traumi e radiazioni) o reazioni immunitarie
(cardite reumatica o LES).
PERICARDITE ACUTA
Può avere diversi caratteri:
- essudativo sieroso;
- essudativo fibrinoso;
- essudativo siero-fibrinoso;
- essudativo purulento-emorragico più raramente.
PERICARDITE CRONICA
L‟alterazione tipica è la fibrosi. C‟è evoluzione sclerotica (fibrosi) che causa ostacolo al ritorno venoso;
aumenta la frequenza per mantenere la portata cardiaca; la costrizione pericardica impedisce ipertrofia
compensatoria.
Evoluzione pericardite costrittiva:
- insufficienza cronica congestizia con diminuzione GC;
- si richiede chirurgia che rimuove pericardio e aderenze.
MALFORMAZIONI CONGENITE DEL CUORE E DEI GROSSI VASI
Sono malformazioni presenti fin dalla nascita; la maggior parte deriva da difetti nell‟embriogenesi,
indotti probabilmente da influenze genetiche o ambientali. Le anomalie più gravi possono essere
incompatibili con la vita.
Si dividono in:
1) Comunicazioni anormali (difetti del setto interatriale, difetti del setto interventricolare, pervietà del
Botallo);
2) Malformazioni di tipo ostruttivo (coartazione aortica, stenosi polmonare, atresia tricuspide);
3) Comunicazione anomale per difetti di tipo ostruttivo (tri e tetra Fallot);
4) Trasposizione dei grossi vasi (trasposizione dell‟aorta e della polmonare).
Se sono in comunicazione due camere con livelli pressori diversi il sangue scorrerà dalla camera a
pressione maggiore alla camera a pressione minore.
Le comunicazioni si dividono in cianotiche e non cianotiche.
Se ci sono vizi valvolari i valori di pressione possono modificarsi e c‟è inversione del flusso (cianosi).
Cianosi con inversione dello shunt tetralogia di fallot.
SHUNT DESTRO-SINISTRO esistenza di una comunicazione anomala tra camere cardiache o
grossi vasi. Permette il flusso di sangue venoso direttamente dalle sezioni destre del cuore alle sinistre;
il sangue scarsamente ossigenato è immerso nel circolo sistemico determinando cianosi.
L‟ipossiemia cronica comporta iperproduzione di eritropoietina con conseguente poliglobulia, aumento
della viscosità del sangue e tendenza alla trombosi.
1) Tetralogia di Fallot (morbo blu): caratterizzata da stenosi dell‟arteria polmonare, ipertrofia del
ventricolo destro, comunicazione interventricolare, aorta “a cavaliere”(a cavallo) del setto
interventricolare.
2) Trilogia di Fallot: caratterizzata da stenosi dell‟arteria polmonare, ipertrofia del ventricolo destro,
comunicazione interatriale. Se la stenosi è modesta, lo shunt è sinistro-destro; se è serrata, che è il caso
più frequente, e il sovraccarico di pressione nel ventricolo destro è elevato, la pressione intraatriale
destra supera quella dell‟atrio sinistro e lo shunt è destro-sinistro con cospicua cianosi.
3) Atresia della tricuspide: occlusione dell‟orifizio atrio-ventricolare destro, difetto del setto interatriale
più persistenza del dotto di Botallo, o difetto del setto interventricolare.
4) Trasposizione di grandi vasi.
SHUNT SINISTRO-DESTRO esistenza di una comunicazione anomala tra camere cardiache o
grossi vasi. Aumenta il flusso ematico polmonare, permettendo il passaggio di sangue dalle sezioni
sinistre del cuore alle destre; inizialmente non si ha cianosi, ma il sovraccarico cronico di pressione e
volume del circolo polmonare comporta ipertrofia ventricolare destra, con potenziale insufficienza
cardiaca congestizia.
- Difetto del setto interatriale;
- Difetto del setto interventricolare;
- Difetto del dotto di Botallo.
COARTAZIONE AORTICA restringimento dell„aorta, in genere distalmente all„origine della
succlavia sinistra, al di sopra o al di sotto dell„origine del dotto di Botallo, che spesso rimane pervio
nelle forme pre-duttali. Nelle forme serrate, la pressione arteriosa è molto aumentata nel territorio delle
carotidi e delle succlavie, mentre è abnormemente bassa nelle arterie della metà inferiore del corpo.
DIFETTI VALVOLARI
I difetti valvolari sono alterazioni morfofunzionali delle valvole cardiache, si manifestano con:
- insufficienza valvolare (la retrazione cicatriziale interessa i lembi valvolari, causando dopo il
passaggio del sangue una chiusura incompleta dell‟ostio valvolare);
- stenosi valvolare (se la retrazione cicatriziale colpisce l‟anello valvolare, si determina una riduzione
del lume ed una ipofunzionalità dei lembi valvolari).
- steno-insufficienza valvolare (se la retrazione cicatriziale colpisce sia il connettivo dell‟anello che
quello dei lembi valvolari).
I difetti valvolari si dividono in: congeniti e acquisiti.
Quelli acquisiti sono alterazioni valvolari che insorgono dopo la nascita e sono conseguenza di un
processo cicatriziale. Sono dovuti a:
- Infezioni dell‟endotelio da parte di microrganismi (endocarditi infettive);
- Reazioni auto-immunitarie dirette contro antigeni dell‟endocardio (endocarditi reumatiche);
- Eventi patogenetici non noti (endocarditi non infettive).
Alcuni esempi:
1) Stenosi della tricuspide: determina un aumento della pressione nell‟atrio destro con conseguente
congestione delle vene cave; l‟ipertensione venosa sistemica si evidenzia a livello epatico con edema
cronico ed evoluzione fibrotica dell‟organo (fegato da stasi e cirrosi cardiaca).
2) Insufficienza della tricuspide: si genera un reflusso di sangue dal ventricolo all‟atrio destro durante
la sistole; per mantenere la gittata cardiaca il ventricolo deve dilatarsi per contenere al termine della
diastole il normale volume telediastolico più il sangue destinato a defluire ipertrofia eccentrica.
3) Stenosi della polmonare: generalmente congenita, determina un aumento del post-carico del
ventricolo destro che incorre nell‟ipertrofia concentrica.
4) Stenosi della mitrale: generalmente dovuta a endocardite reumatica, si caratterizza per il
restringimento dell‟ostio atrioventricolare sinistro, determina un aumento della pressione dell‟atrio
sinistro che si dilata: tale dilatazione favorisce l‟ingenerarsi di fenomeni trombotici. Il ventricolo destro
per mantenere il gradiente pressorio tra circolo polmonare e atrio sinistro, è sottoposto a un maggior
lavoro e quindi si ipertrofizza.
5) Insufficienza della mitrale: consente il reflusso di sangue del ventricolo sinistro all‟atrio. Il
ventricolo per mantenere costante la gittata cardiaca, deve dilatarsi ed incorre nell‟ipertrofia eccentrica.
È generalmente dovuta agli esiti dell‟endocardite reumatica con retrazione dei lembi valvolari o a
infarto del miocardio con lesione dei muscoli papillari; può anche essere una complicanza del prolasso
della mitrale congenito.
6) Stenosi aortica: generalmente dovuta ad endocardite reumatica, determina aumento del postcarico
del ventricolo sinistro, che incorre nell‟ipertrofia concentrica. Questa è alla base della genesi dei
fenomeni anginosi dovuti sia allo sbilanciamento tra perfusione e richiesta metabolica, sia allo
schiacciamento del plesso coronarico intramurale.
7) Insufficienza aortica: raramente congenita, comporta il reflusso di sangue dall‟aorta al ventricolo
sinistro per aumento del precarico va incontro ad ipertrofia eccentrica.
ENDOCARDITI:
Malattie acquisite dell‟endocardio che possono interessare:
- l‟endocardio parietale: espressione della compartecipazione endocardica alla flogosi del miocardio.
- l‟endocardio valvolare: principale causa dei vizi valvolari acquisiti.
N.B. Alcune endocarditi possono interessare sia l‟endocardio parietale che l‟endocardio valvolare.
1) Endocardite reumatica;
2) Endocardite infettiva:
- a evoluzione acuta germi virulenti che hanno azione su una valvola ancora sana;
- a evoluzione subacuta germi poco virulenti che hanno azione su una valvola già attaccata.
3) Endocardite non infettiva.
ENDOCARDITE REUMATICA
Rappresenta la localizzazione endocardica della cardite reumatica, manifestazione preminente della
febbre reumatico.
L‟eziologia è batterica: la malattia insorge in genere dopo 2-3 settimane da un‟infezione acuta faringea,
talora di altre sedi, sostenuta più spesso da streptococchi -emolitici di gruppo A.
L‟infezione si contrae attraverso le alte vie respiratorie e si manifesta con una banale faringite. I
sintomi come febbre e mal di gola vengono facilmente eliminati.
Se l‟agente infettivo non è stato eliminato comunque la faringite è destinata a ripetersi.
In una ridotta percentuale di casi, e in soggetti predisposti, l‟agente eziologico invece di essere
eliminato, continua ad albergare nell‟organismo senza dare sintomatologia.
C‟è alterazione di linfociti B e T con riconoscimento di antigeni streptococcici. In particolare si
conoscono due tipi di antigeni:
- Proteina M presente sulla superficie del batterio;
- Streptolisina.
Sono antigeni estremamente diversi tra loro.
Le streptolisine sono veleni rilasciati in circolo che determinano formazione di immunocomplessi che
si depositano in varie sedi determinando una reazione flogistica con danno.
La proteina M stimola l‟innesco di meccanismi autoimmunitari.
Linfociti T e anticorpi riconoscono la proteina M, ma per mimetismo molecolare attaccano autoantigeni
presenti sulle fibrocellule miocardiche (miocardite) e sulle valvole (endocardite con verruche di fibrina)
causando danno.
A livello del pericardio c‟è pericardite (deposito di fibrina sulla superficie del pericardio). I danni al
miocardio, all‟endocardio e al pericardio possono essere dovuti sia a immunocomplessi sia a
meccanismi autoimmuni.
Quando si scatena la reazione flogistica non è autoimmune perché l‟antigene (streptomicina) è estraneo
all‟organismo.
L‟endocardite reumatica non colpisce solo il cuore, ma gli immunocomplessi determinano danni a
livello articolare, manifestandosi come reumatismo articolare acuto (RRA).
La causa e il meccanismo sono identici in entrambe le forme (cuore e articolazioni).
L‟endocardite reumatica comunque colpisce selettivamente l‟endocardio valvolare e rispettivamente
(per frequenza): mitrale, aortiche, tricuspidi e polmonare.
1) La flogosi inizia con un edema mucoso della valvola (glicosaminoglicani);
2) Infiammazione del connettivo valvolare con infiltrato leucocitario;
3) Degenerazione fibrinoide del connettivo e formazione di rilievi endoteliali (verruche: endocardite
verrucosa);
4) Degenerazione dell‟endotelio e comparsa di deposizioni robotiche;
5) Proliferazione di capillari e fibroblasti con deposizione di collagene.
Tutto ciò è manifestazione della malattia reumatica che coinvolge vari distretti oltre al cuore (dove
comunque c‟è il danno maggiore). L‟incidenza dell‟interessamento cardiaco è proporzionale all‟attività
dell‟infezione e della febbre reumatica (che riflette l‟attività del batterio).
Esiste un genotipo maggiormente predisposto a sviluppare la malattia reumatica in quanto ospita più
facilmente il batterio.
Esistono diversi ceppi di batteri:
1) Batterio trovato nella gola: associato a manifestazioni prevalentemente cardiache.
2) Batterio trovato nella pelle: glomerulonefrite.
ENDOCARDITE INFETTIVA
Dovuta alla colonizzazione dell‟endocardio parietale e valvolare da parte dei microbi (streptococco
vividans e stafilocco aureus) con formazione di “vegetazioni” composte da detriti trombotici, cellulari e
microrganismi. Le forme acute sono dovute ad infezioni da microrganismi virulenti che portano alla
rapida distruzione del cuore. Originariamente sono con esito fatale. Le forma subacute sono causate
invece da microbi scarsamente virulenti che compromettono ulteriormente le condizioni di un cuore già
affetto da vizi valvolari: in genere hanno un decorso prolungato e guariscono con terapia antibiotica.
CARDIOPATIA ISCHEMICA
Gruppo di sindromi correlate caratterizzate da ischemia miocardica dovuta ad insufficienza coronarica.
Ischemia che non coinvolge solo il miocardio; I principali target oltre al cuore sono il cervello (attacchi
ischemici transitori o ictus), colon (enterocolite ischemica), arti inferiori (gangrena).
Il flusso coronarico può essere modificato per aiutare il cuore a soddisfare maggiori richieste
metaboliche: riserva coronarica.
Esistono condizioni che limitano la capacità delle coronarie (coronaropatie) di aiutare il cuore; la più
importante coronaropatia a riguardo è la malattia aterosclerotica.
Questa ha due principali conseguenze:
1) Formazione di placche che causano il restringimento del lume in zone circoscritte delle coronarie.
2) Riduzione diffusa della capacità della parete arteriosa dell‟intero albero coronarico di rispondere a
stimoli vasodilatatori.
Le sindromi croniche hanno un esordio tardivo, generalmente preceduto da una lunga fase di
aterosclerosi silente ingravescente, e sono dovute all‟ostruzione meccanica operata dalle placche
ateromatosa stabili che agiscono da stenosi fisse.
Le sindromi acute, hanno un esordio improvviso e sono causate da vasospasmo, o dalla rottura di
placche ateromatosa instabili con sovrapposta trombosi (stenosi dinamiche). Il vasospasmi è un evento
transitorio che in genere non è sufficiente da solo a determinare ischemia miocardica: può tuttavia
contribuire a ridurre il lume vascolare e facilitare la rottura delle placche ateromatose instabili.
Fattori di rischio nello sviluppo di cardiopatia ischemica sono: ipertensione, iperlipidemia, disfunzione
endoteliale, stress psicofisico, particolari recettori per il fibrinogeno, sesso, età e stile di vita.
La suscettibilità alla cardiopatia ischemica ha anche basi genetiche in quanto ad esempio alcuni
soggetti producono maggiori quantità di fattori fibrinolitica che prevengono i fenomeni trombotici.
Altri soggetti possono formare facilmente circoli paralleli che minimizzano l‟affetto emodinamico di
una stenosi coronarica fissa.
INSUFFICIENZA CORONARICA:
Condizione fisiopatologica determinata da alterato afflusso di sangue al cuore attraverso le coronarie
con induzione di ossigenazione del tessuto cardiaco.
Le principali complicanze sono:
1) Angina Pectoris;
2) Infarto del miocardio;
3) Morte cardiaca improvvisa.
Si può monitorare l‟evoluzione della malattia in base all‟evolversi della placca; se la placca è solo
parzialmente occlusiva, la sintomatologia è debole; se è aumentata l‟ostruzione, aumenta anche la
sintomatologia.
FATTORI DI RISCHIO NELLO SVILUPPO DELL‟INSUFFICIENZA CORONARICA:
Accertati:
1) Elevati livelli plasmatici di colesterolo LDL e bassi livelli di HDL.
2) Diete ricche di grassi e calorie e povere di fattori nutritivi di origine vegetale (presente in frutta e
verdura) e povera di fibre.
3) Fumo di sigaretta, che riduce l‟elasticità vasale e riduce la capacità di rispondere all‟occlusione.
4) Bassi livelli di vitamina E e C e scarsa forma fisica;
5) Ridotta capacità di controllare lo stress;
6) Diverse malattie sistemiche (ipertensione che causa danno endoteliale favorendo la formazione
dell‟ateroma, diabete, ipotiroidismo);
7) Elevati livelli ematici di trigliceridi e insulina che riflettono una condizione di insulino-resistenza.
Sia lo stress fisico che lo stress ematico sembrano essere correlati a ostruzione di tipo dinamico:
spasmo coronarico.
E‟ più probabile che la placca ateromatosa vada a depositarsi in zone dell‟endotelio danneggiate.
Il diabete determina danno endoteliale e aterosclerosi.
Probabili:
1) Associazione fra malattia coronarica e una variabile comune di recettore piastrinico per il
fibrinogeno (gpIIb/IIIa PIA 1/AB);
2) Elevati livelli di omocisteina plasmatica;
3) Dieta con livelli relativamente bassi di acidi grassi poliinsaturi omega-3;
4) In pazienti sottoposti a isterectomia, sono stati trovati marker biologici che suggeriscono una
localizzazione coronarica dell‟infezione da Chlamydia.
In una percentuale elevata di pazienti (20% della popolazione americana) c‟è questa variante di
recettore per il fibrinogeno. Non tutti vanno incontro a malattia aterosclerotica, ma sono maggiormente
suscettibili.
E‟ un fattore di rischio alla pari di fumo o ipertensione.
Resta da stabilire se si può prevenire la malattia coronarica alle persone portatrici di questa variante con
terapia antipiastrinica.
Questi pazienti con questo recettore non hanno problemi coagulativi però è stato visto che può dare
trombi di fibrina con maggiore frequenza nelle coronarie.
In presenza di livelli di omocisteina 10-20 volte maggiori rispetto al normale si sviluppa una
vasculopatia prematura e a rapida evoluzione, perché l‟omocisteina ha effetto tossico diretto
sull‟endotelio e promuove trombosi e ossidazione delle LDL.
Un modesto aumento di omocisteina, può avere cause multiple:
- Bassi livelli di acido folico, vitamina B6 e vitamina B12;
- Insufficienza renale;
- Alcuni farmaci e varianti genetiche degli enzimi coinvolti nel metabolismo dell‟omocisteina.
Il metodo più semplice ed efficace per ridurre l‟omocisteina è la somministrazione di 1-2 mg/die di
acido folico.
Pazienti con coronaropatie devono essere sottoposti a testi di screening per valutare gli eventuali
aumenti dell‟omocisteina plasmatica.
EZIOPATOGENESI:
1) Fattori meccanici: Malattie organiche delle coronarie (soprattutto malattia aterosclerotica, ma anche
LES); causano restringimento del lume coronarico.
2) Fattori dinamici: Fattori funzionali neurogeni, scatenati da fattori di stress, causano uno spasmo
arterioso a cui si associano:
- Iperattività delle piastrine presso le lesioni dell‟intima;
- Formazione transitoria di microtrombi piastrinici;
- Attivazione di fenomeni coagulativi a livello dell‟intima;
- Azione vasocostrittrice di fattori piastrinici.
Lo spasmo arterioso raramente potrebbe essere sufficiente a causare ischemia (è un evento transitorio
troppo breve!). Può essere dato però da alterazioni funzionali del SNA (ortosimpatico) stress
psichico.
Lo spasmo arterioso è dovuto ad un‟iperreattività localizzata del muscolo liscio che determina
occlusione totale o subtotale in risposta a stimoli che determinano vasocostrizione coronarica.
Le cause di questa iperreattività non sono note, ma essa è aspecifica e forse può essere causata da
un‟alterazione dei meccanismi di trasduzione del segnale di membrana.
Spesso si può avere su coronarie sane o aterosclerotiche.
Ancora non è chiaro il perché si sviluppa lo spasmo coronarico, ma è certo che si manifesta
generalmente con ipercontrazione della muscolatura liscia delle coronarie.
Il 60% dei vasospasmi si ha in zone già lesionate.
TARGET DIVERSI FRA SPASMO ARTERIOLARE E MALATTIA CORONARICA
- Nello spasmo arteriolare (SA) rispetto (vs) alla malattia coronarica (MC) sono esposti pazienti
giovani privi di fattori di rischio cardiovascolare;
- Nello SA l‟unico rischio è il tabagismo;
- Nello SA vs MC lo sforzo fisico è raramente scatenante (è un fattore di rischio per malattie coronarie
perché se c„è già danno, l„iniziale costrizione può incrementare l„ostruzione, mentre non è un fattore di
rischio per lo spasmo arteriolare perché se non c„è una precedente ostruzione, l„iniziale costrizione
dovuta allo sforzo fisico non è sufficiente da sola a causare il danno);
N.B. Nello sforzo fisico c‟è prima vasocostrizione, poi vasodilatazione.
- Nello SA vs MC in ECG sopraslivellamento ST;
- Nello SA vs MC prevalenza maggiore nei Giapponesi.
POSSIBILI FATTORI SCATENANTI LO SPASMO:
1) Disfunzione endoteliale: l‟endotelio regola il tono vasale con vasodilatazione (NO e prostaciclina) e
vasocostrizione (endotelina-1).
Danni a carico dell‟endotelio portano a deficit nel rilascio di NO e aumento del rilascio di ET-1:
meccanismo questo alla base dello spasmo arteriolare.
2) Ipersensibilità della muscolatura liscia: la contrazione della muscolatura liscia delle coronarie
dipende dalla sensibilità di queste al calcio, e quindi dalla concentrazione intracellulare di calcio.
La contrazione inizia con la fosforilazione della catena leggera della miosina (mediata dalla chinasi
Rho); in caso di SA è stata documentata un‟up-regolazione di Rho.
3) Stress Ossidativo: Il ruolo dello stresso ossidativo è stato dimostrato in diverse patologie
cardiovascolari. Il fumo di sigaretta è una fonte di ROS che danneggiano l‟endotelio diminuendo la
capacità vasodilatatoria mediata da NO (e inducendo vasocostrizione spastica).
4) Suscettibilità genetica: Numerosi fattori genetici (soprattutto nei Giapponesi) sono stati associati a
predisposizione nell‟insorgenza dello spasmo arteriolare.
- gene che codifica per l‟enzima NOS implicato nella vasocostrizione;
- gene per l‟enzima paraossanasi associato con la predisposizione a stress ossidativo;
- aplotipi a rischio per spasmo arteriolare: HLA-DR2.
5) Iperattività dell‟ortosimpatico: indotta da stress psichico e fisico.
PRINCIPALI TIPI DI STENOSI
Si tratta per lo più di stenosi coronariche.
1) Stenosi fisse: di natura aterosclerotica;
2) Stenosi transitorie dinamiche dovute a varie situazioni:
- spasmo cardiaco;
- formazione di aggregati piastrinici;
- embolie.
CARDIOPATIA ISCHEMICA:
Squilibrio fra apporto e richiesta di ossigeno al miocardio dipendente principalmente da coronaropatie.
Angina Pectoris: Dolore (il più delle volte transitorio) sternale irradiato al braccio sinistro e provocato
da insufficienza nel flusso coronarico con insufficienza dell‟apporto di ossigeno al miocardio.
Infarto del miocardio: Rispetto all‟angina si ha l‟occlusione brusca (parziale e non) di una delle
coronarie che causa formazione di un‟area necrotica.
Morte improvvisa: improvviso arresto dell‟attività cardiaca e colpisce soprattutto pazienti con
cardiopatia pregressa. È sovente dovuto a cause ischemiche: se risulta colpito il sistema di conduzione
si potrà avere arresto cardiaco primitivo; se la lesione colpisce altre zone del miocardio sarà possibile
osservare fibrillazione ventricolare.
ANGINA PECTORIS
Sindrome provocata da un‟insufficiente apporto di ossigeno al cuore a causa di una transitoria
deficienza del flusso attraverso le coronarie.
E‟ la causa più frequente di aterosclerosi.
Esistono dei meccanismi per compensare l‟insufficienza coronarica:
- sviluppo di circoli collaterali;
- produzione di sostanze fibrinolitiche.
Detto questo sorge una domanda:”Cosa determina l‟evoluzione verso la guarigione o verso l‟infarto?”
la predisposizione genetica.
Esistono tre tipi di angina:
1) Da sforzo (o secondaria): stabile (almeno due mesi); cronica; prevedibile nella sua frequenza e
intensità (in occasione di un aumento del carico di lavoro sul cuore) e nelle misure da adottare per
prevenire o far cessare l„attacco. In corso di crisi ci può essere un sottoslivellamento del tratto ST;
placca stabile (riduzione della riserva coronarica stabile); elemento tipico è il dolore (retrosternale,
trafittivo).
N.B. il dolore dell‟angina è di minor durata rispetto a quello dell‟infarto.
2) Spontanea (o primaria), di Prinzmetal: più rara; i pazienti manifestano episodi anginosi a riposo;
Sopraslivellamento del tratto ST; spasmo arteriolare più trombosi piastrinica.
3) Mista (o instabile): condizione grave; si riferisce ad un‟angina di recente insorgenza; placca stabile;
spasmo arteriolare più trombosi.
N.B. Alcune volte l‟angina non compare nell‟ECG, ci può essere una danno occlusivo; cosa faccio)
test provocativi.
DOLORE NELL‟ANGINA PERCTORIS:
Scatenato dall‟accumulo di metaboliti tossici causato dall‟ischemia transitoria. Costrittivo,
retrosternale, lancinante, con diverse possibili irradiazioni e della durata di pochi minuti.
INFARTO DEL MIOCARDIO
Necrosi circoscritta del miocardio dovuto a ischemia da occlusione coronarica provocata da cause
meccaniche e dinamiche. (ostruzione coronaria sx infarto anteriore). Può interessare l‟intero spessore
dell‟organo (transmurale o a tutta parete) o solo il terzo interno (infarto subendocardico).
Affinchè si abbia necrosi di una parte cospicua di cardiomiociti è necessario che l‟ischemia sia
prolungata (20-40 minuti). L‟evento scatenante spesso è causato dalla rottura di una placca ateromatosa
con conseguente aggegazione piastrinica e vasospasmi.
A volte può essere causato contemporaneamente da trombosi e spasmo arteriolare.
Il quadro istologico è di necrosi coagulativa con cellule rigonfie, assottigliate ed allungate per effetto
della distensione passiva dell‟area necrotica; si osserva inoltre scomparsa dei nuclei e
disorganizzazione miofibrillare.
Alla periferia della lesione si osservano “miociti ipercontratti”, andati in necrosi per eccessiva
increzione di ioni calcio. Frequente la presenza di edema emorragico ed infiltrato leucocitario: tipici
segni di flogosi.
Il processo di guarigione porta alla sostituzione del tessuto leso con connettivo fibroso non contrattile e
conseguente riduzione irreversibile della funzionalità d‟organo.
FATTORI DI RISCHIO PER IMA:
- Fumo;
- Diabete;
- Età (50-60 anni);
- Sesso (maschile);
- Fattori genetici;
- Ipercolesterolemia;
- Ipertensione arteriosa;
- inattività fisica.
FATTORI PRECIPITANTI o SCATENANTI:
- Sforzo fisico violento;
- Emozione intensa;
- Stress;
- Shock;
- Emorragia grave.
ASPETTI TIPOLOGICI:
- Familiarità;
- Obesità;
- Inattività fisica.
ALTERAZIONI CELLULARI INDICATIVE DI AUMENTO DEL PROCESSO DI NECROSI DEL
MIOCARDIO
Sono:
1) rigonfiamento, assottigliamento, allungamento delle fibrocellule miocardiche;
2) scomparsa dei nuclei, dell‟organizzazione miofibrillare e del reticolo sarcoplasmatico;
3) ipercontrazione e progressiva frammentazione delle miofibrille, con conseguenti turbe del ritmo
cardiaco.
* nell‟IMA:
- l‟insorgenza della deplezione dell‟ATP avviene in pochi secondi;
- la perdita della contrattilità avviene in meno di due minuti;
- il danno irreversibile in 20-40 minuti.
C‟è rigonfiamento dei mitocondri, perdita di glicogeno, scompagnamento delle miofibrille. Nel nucleo
c‟è ridistribuzione della cromatina e disfacimento della membrana mitocondriale.
La necrosi avanza come un fronte d‟onda che coinvolge progressivamente uno spessore più ampio della
zona ischemica. Di solito la zona endoteliale viene inzialmente risparmiata perché si nutre per
diffusione.
Localizzazione, dimensione, morfologia dell‟area infartata dipendono da:
- sede, severità e grado di ostruzione coronarico;
- estensione del territorio di distribuzione dei vasi ostruiti;
- durata dell‟occlusione;
- esigenze metaboliche del miocardio;
- entità del circolo collaterale;
- presenza, sede e gravità dello spasmo;
- pressione arteriosa, gittata cardiaca, ritmo cardiaco.
FENOMENI INFIAMMATORI IN CORSO DI IMA:
1) l‟infiltrato polimorfonucleato nella zona di necrosi è dovuto alla liberazione in circolo di citochine
infiammatorie (IL-1, IL-6 e TNF- );
2) aumentano i livelli sierici delle proteine della fase acuta; soprattutto proteina C reattiva che si può
dosare.
3) c‟è riparazione del tessuto con formazione di tessuto cicatriziale fibrotico.
DIAGNOSI ECG
Fase acuta: sopraslivellamento ST con scomparsa dell‟onda T.
Fase subasta: sottoslivellamento ST con onda T negativa.
MARCATORI DI IMA
Caratteristiche del marcatore ideale:
- sensibilità;
- specificità.
I marcatori di infarto devono consentire di fare diagnosi appropriate in tempi giusti.
- sono presenti in concentrazioni elevate nel muscolo cardiaco; in particolare sono presenti solo nella
cellula miocardica (specificità assoluta);
- devono essere assenti dal circolo in condizioni normali;
- devono essere rilasciati dal muscolo cardiaco rapidamente.
Esempi di marcatori più utilizzati:
1) creatin fosfochinasi (CK-MB) nelle 12-24 ore;
2) troponina (specifico del cardiomiociti);
3) mioglobina (è il marcatore più precoce (1-2 ore);
4) transaminasi (non specifico) 24-48 ore;
5) lattico deidrogenasi 1 e 2(non specifico).
Se la troponina è il più specifico perché si misurano le altre?
Per capire in che fase della malattia ci troviamo è importante saperlo per la terapia.
ARITMIE
Si indicano con questo termine tutte le condizioni in cui sia alterata la frequenza o la regolarità della
successione di battiti, ovvero la propagazione dell‟eccitamento nelle varie parti del cuore.
DIAGNOSI DI ARITMIE:
1) metodiche elettrofisiolgiche quali: semplice elettrocardiografia o l‟elettrocardiografia dinamica che
consiste nella registrazione continua dell‟elettrocardiogramma per 24 ore.
2) registrazioni endocavitarie;
3) registrazioni dei potenziali del fascio di His dopo stimolazione endocavitaria.
ARITMIA FUNZIONALE
Situazione in cui nulla di patologico è rilevabile a carico dell‟apparato cardiovascolare.
Un primo criterio per distinguere le aritmie è suddividerle in:
1) IPERCINETICHE: caratterizzate da un aumento del numero degli impulsi sia nomotopici che
ectopici che governano il ritmo cardiaco (indipendentemente dal fatto che essi inducano o meno un
maggior numero di battiti per unità di tempo).
L‟insorgenza di anemie ipercinetiche può essere ricondotta ad uno dei tre meccanismi fondamentali:
- aumento della frequenza di scarica del pacemaker fisiologico (nodo seno-atriale);
- entrata in funzione di un centro ectopico, cioè di un pacemaker extra-sinusale che, per avere una
frequenza di scarica superiore a quella del nodo del seno, prende il sopravvento su questo (ritmo
ectopico attivo);
- il meccanismo di “rientro”, molto importante perché è alla base delle aritmie ipercinetiche più gravi e
deriva dalla presenza o dalla comparsa di un circuito ad anello, anatomico o funzionale, che possa
essere percorso dall‟eccitamento nei due sensi e che sia inserito in una via comune prossimale e distale
al circuito. Condizione perché si realizzi il fenomeno del rientro è che in una delle due vie che formano
il circuito vi sia un blocco unidirezionale e che nella via non bloccata, la conduzione sia rallentata. Il
risultato di questa situazione è l‟insorgenza di un‟onda circolare di eccitazione, che invia impulsi al
cuore con una frequenza che dipende dalle dimensioni del circuito: si distingue infatti un
“microrientro” che comprende poche unità cellulari anche solo due cellule del Purkinje ed una
fibrocellula del lavoro e di un “macrorientro” che implica l‟esistenza di entità anatomiche anomale
(sindrome di Wolf-Parkinson-White), oppure situazioni funzionali particolari che si instaurano
facilmente nelle aree ischemiche nelle quali il circuito di rientro può formarsi alla periferia dell‟area
necrotica dove possono coesistere branche bloccate unidirezionalmente ed altre con ritardo di
conduzione.
2) IPOCINETICHE: caratterizzate da una diminuzione del numero degli impulsi (indipendentemente
dal fatto che essi inducano o meno un maggior numero di battiti per unità di tempo). L‟insorgenza di
aritmie ipocinetiche possono essere ricondotte ai seguenti meccanismi:
- diminuzione della frequenza di scarica del pacemaker fisiologico (nodo senatoriale);
- fenomeni di “scappamento” quando la frequenza degli impulsi generati e trasmessi dal nodo
seno-atriale scende al di sotto di un valore critico entrano in funzione centri automatici sottostanti
rappresentati dal nodo di Tavara (ritmi giunzionali da scappamento) o dal fascio di His;
- disturbi di conduzione: la ritardata o mancata conduzione dell‟eccitamento dagli atri ai ventricoli crea
le varie forme di blocco atrio-ventricolare. Se questo è parziale alcuni impulsi saranno trasmessi e altri
No. Se è totale entra in genere in azione un centro sottostante a frequenza bassa situato nelle
ramificazioni distali della rete del Purkinje (ritmo idio-ventricolare).
ARITMIE SINUSALI
La tachicardia sinusale può essere fisiologica (sforzi, emozioni, gravidanza) o patologica ovvero
espressione di una patologia cardiaca (insufficienza circolatoria, pericardite costruttiva) o extracardiaca
(febbre, anemia, tireotossicosi, farmaci simpatico-mimetici).
BRADICARDIA SINUSALE: può essere fisiologica (nei soggetti vagotonici, negli sportivi allenati) o
patologica (ipertensione endocranica, iperstimolazione vagale oppure con farmaci come i
-bloccanti).
Le aritmie sinusali comprendono:
- aritmia respiratoria fisiologica (frequente nei giovani);
- “wandering” pacemaker (pacemaker vagabondo) caratterizzato da uno spostamento irregolare del
pacemaker sinusale dal nodo del seno ad una regione situata attorno allo sbocco del seno coronario
(l‟onda P varia la sua morfologia e varia l‟intervallo P-Q);
- malattia del nodo del seno, caratterizzata da saltuari arresti sinusali (impulso non viene prodotto) o da
blocchi senatoriali (l‟impulso non viene trasmesso agli atri o ai ventricoli) con conseguenti bradicardie
irregolari;
EXTRASISTOLIA
Si tratta di un‟aritmia estremamente frequente, che in un terzo dei casi si verifica in cuori del tutto
normali (stimoli emozionali, sindromi ansiose, abuso di caffè o tè, disordini elettrolitici).
Le extrasistoli sono battiti prematuri, che partono da un centro ectopico; possono essere:
- isolate in caso di bigeminismo o trigeminismo;
- raggruppate in “salve”.
A seconda della sede del centro ectopico, le extrasistoli si dividono in:
- sopraventricolari: mostrano un‟ onda P di morfologia diversa dalle P sinusali, talora invertita
(l‟eccitamento degli atri avviene dal basso in alto); un intervallo P-Q accorciato (l‟eccitamento si
propaga contemporaneamente verso gli atri e verso i ventricoli); un Q-R-S di morfologia in genere
normale (la conduzione verso i ventricoli come di norma lungo il fascio di His e le sue branche).
-ventricolari: si originano in qualsiasi punto del sistema specifico; l‟impulso può propagarsi agli atri
(comparsa di un‟onda P invertita dopo il Q-R-S extrasistolico) ma, a differenza di quanto avviene nelle
extrasistoli sopraventricolari, non arriva a depolarizzare il nodo del seno, il cui ritmo di base non viene
turbato (l‟intervallo tra il Q-R-S e quello successivo all‟extrasistole è il doppio dell‟intervallo normale).
Di regola l‟impulso sinusale successivo all‟extrasistole trova atri e ventricoli in fase refrattaria e quindi
non li eccita; raramente, soprattutto in presenza di bradicardia, se atri e ventricoli sono già usciti dalla
fase refrattaria, l‟extrasistole si intercala tra due sistoli normali (extrasistoli intercalate).
La morfologia del Q-R-S è in genere aberrante in quanto l‟eccitamento, nel propagarsi ai ventricoli,
non segue vie preformate. Se coesistono più centri ectopici, come può avvenire in caso di grave
sofferenza del miocardio, si succedono extrasistoli con Q-R-S polimorfo (extrasistoli politope).
TACHICARDIE ECTOPICHE
Si distinguono in:
1) Sopraventricolari:
- TACHICARDIA PAROSSISTICA SOPRAVENTRICOLARE: è caratterizzata da: eccessi della
durata, da pochi secondi a giorni, di un ritmo regolare a frequenza elevata (160-200/min). questo può
dipendere da un punto di vista elettrofisiologico, da un centro ectopico atriale ad alta frequenza, che
sopprime l‟attività sinusale, ovvero, da un circuito di rientro a livello del nodo atrio-ventricolare.
Gli impulsi sono in genere condotti tutti ai ventricoli, con conduzione normale (Q-R-S di normale
morfologia) o con conduzione aberrante (Q-R-S slargato).
- FLUTTER ATRIALE: è in genere dovuto all‟attivazione di un centro ectopico atriale caratterizzato
da una frequenza compresa tra 200-300/min. Tutti gli impulsi sono condotti al miocardio atriale (il
tracciato elettrocardiografico mostra successione di onde “a dente di sega”), ma a causa della
refrattarietà, solo uno su due o tre o quattro si propaga ai ventricoli. Si parlerà quindi di flutter con
blocco 2:1, 3:1, 4:1. Caratteristica è la frequenza del polso assolutamente regolare (anche troppo!)
dovuta alla costanza del blocco almeno in periodi brevi.
Il flutter atriale ha in genere una eziologia organica.
- FIBRILLAZIONE ATRIALE: dipende dall‟attività di uno o più centri ectopici a frequenza ancora più
elevata che nel flutter (tra 350-600/min).
Gli stimoli si propagano irregolarmente innescando molte onde circolari di eccitazione che variano
continuamente e che percorrono vie non predefinite, ma puramente funzionali.
L‟elevata frequenza degli impulsi impedisce un‟attivazione coordinata del miocardio atriale e quindi
una sua contrazione efficace, per cui la linea di base del tracciato mostra una successione di
dentellature fini ed irregolari.
L‟impulso viene trasmesso ai ventricoli in modo irregolare per cui i complessi ventricolari si succedono
in modo caotico (“delirium cordis” o aritmia totale), con una frequenza ventricolare da valori bassi
(bradiaritmia) a valori fino a 140-150/min (tachiaritmia).
Dal punto di vista emodinamico la fibrillazione atriale comporta solo la perdita del contributo della
presistole al riempimento ventricolare, ma questo è poco incidente sulla portata circolatoria.
Può diventare irreversibile, può durare decenni in soggetti che svolgono una vita del tutto normale.
Peraltro un‟importante conseguenza di questa aritmia, a causa dell‟assenza di una contrazione
efficiente degli atri, è la maggior causa di trombosi intraatriale, soprattutto a livello delle auricole, con
conseguente rischio di embolia, motivo per il quale è necessaria una terapia anticoagulante permanente.
2) ventricolari:
Caratteristica delle tachicardie ventricolari è eziologia organica e la potenziale letalità. Le cause più
frequenti sono rappresentate dalla cardiopatia ischemica, dalle valvulopatie e dalle cardiomiopatie.
- TACHICARDIA PAROSSISTICA VENTRICOLARE: caratterizzata elettrocardiograficamente dalla
successione di complessi Q-R-S aberranti e slargati con frequenza compresa tra 150-250/min.
- FLUTTER VENTRICOLARE: frequenza superiore a 200/min; morfologia del tracciato ad onda
sinusoidale senza più distinzione tra Q-R-S e onde T.
- FIBRILLAZIONE VENTRICOLARE: simile a quella della fibrillazione atriale,
elettrofisiologicamente parlando; emodinamicamente corrisponde ad un arresto cardiaco.
La fibrillazione ventricolare ha sempre una base organica, spesso è espressione di una cardiopatia
ischemica e rappresenta la causa più frequente di morte improvvisa cardiaca.
Strettamente connessa con le problematiche delle tachicardie ventricolari è la SINDROME DEL Q-T
LUNGO, condizione caratterizzata da un allungamento dell‟intervallo Q-T, espressione di un
prolungamento della fase di depolarizzazione e/o di ritardo della ripolarizzazione ventricolare.
Questa sindrome può essere acquisita e causata da traumi cerebrali oppure anomalie elettrolitiche, in
particolare ipomagniesemia e ipocaliemia.
ANEMIE
Ridotta capacità di trasporto di ossigeno ai tessuti da parte del sangue; si osserva anche una riduzione
della massa dei globuli rossi circolanti (non è sempre vero; per esempio nell‟anemia mediterranea il
numero dei globuli rossi è superiore alla norma) e una riduzione della concentrazione di emoglobina
nel sangue (nell‟uomo inferiore a 13,5 gr/dl, nella donna inferiore a 11,5 gr/dl).
Classificazioni:
1) dimensione dei globuli rossi (MCV: volume corpuscolare medio):
- microcitiche (diminuzione dell‟MCV);
- normocitiche (valori di MCV simili alla norma);
- macrocitiche (aumento dell‟MCV).
2) contenuto di emoglobina (MCH), e in base alla colorazione quindi si dividono in:
- normocromiche;
- ipocromiche.
Classificazione patogenetica:
1) Anemia da ridotta produzione di globuli rossi: difetti di proliferazione e differenziazione delle
cellule staminali:
- anemia aplastica;
- aplasia pura eritrocitaria.
2) Difetti di maturazione dell‟eritrocita:
- difettosa sintesi dell‟eme;
- difettosa sintesi di globine;
- difettosa sintesi di DNA.
3) Aumentata distruzione dei globuli rossi (anemie emolitiche); possono essere dovute a:
- anomalie intrinseche dei globuli rossi (intracorpuscolari): come anemie da difetti di membrana, da
difetti enzimatici, o da difettosa sintesi di emoglobina.
- anomalie estrinseche dei globuli rossi (extracorpuscolari): come anemie da traumi meccanici, o da
cause infettive.
Caratteristiche cliniche e fisiopatologie:
1) correlate con l‟ipossia e peggiorate dallo sforzo fisico e dall„ambiente (es. altitudine in montagna):
- generali: pallore, debolezza, malessere, facile affaticamento, astenia, dispnea;
- cuore: sindromi ischemiche (angina o IMA);
- cervello: cefalea, riduzione del visus, TIA (attacco ischemico transitorio), stroke (ictus);
- rene e fegato: ipofunzione da degenerazione grassa (steatosi) per danno alla sintesi proteica (in quanto
nel momento in cui la cellula si gonfia, dal RE si staccano i ribosomi e quindi non avviene la sintesi
proteica).
2) meccanismi fisiologici di compenso:
- pallore da ridistribuzione del flusso ematico agli organi vitali;
- aumento della gittata cardiaca per aumento della frequenza cardiaca (tachicardia);
- aumento della ventilazione/minuto (tachipnea, dispnea);
- diminuzione dell‟affinità dell‟emoglobina per l‟ossigeno (aumento di 2,3-difodfoglicerato);
- stimolo dell‟emopoiesi da aumentata produzione di eritropoietina (EPO) prodotta dalle cellule
peritubulari del rene.
L‟eritropoietina agisce sui progenitori CFU e BFU stimolando l‟incorporazione del ferro a livello del
precursore eritroide.
STRUTTURA DI MEMBRANA DELL‟ERITROCITA
La deformabilità della membrana plasmatica dell„eritrocita, è una condizione essenziale per garantire la
sopravvivenza della cellula.
È costituita da:
- lipidi (50%);
- carboidrati (10%);
- proteine (40%) che si distinguono in transmembranarie (banda 3 e glicoforina, che porta l‟antigene) e
associate alla membrana interna (spectrina, proteina 4.1).
Vie metaboliche del globulo rosso:
- glicolisi (con produzione di lattato);
- via dei pentoso fosfati (con produzione di NADPH);
- shunt di Rapaport-Luebering (con produzione di 2,3 DPG).
La glicolisi costituisce il 90% delle reazioni metaboliche, e in condizioni anaerobie interviene nella
produzione di ATP.
1) La produzione di ATP serve per:
- mantenimento dell‟ambiente ionico;
- mantenimento dell‟integrità di membrana;
- per la riduzione di Fe3+ a Fe2+.
2) La via dei pentoso-fosfati serve per la produzione di glutatione ridotto utile per:
- protezione dei gruppi sulfidrilici dell‟emoglobina (fe3+);
- protezione della membrana dalla perossidazione.
Enzima responsabile: Glucosio-6-fosfato-deidrogenasi, il cui deficit porta al favismo.
3) Shunt di Rapaport -Luebering: produzione di 2,3 DPG che serve per:
- modificazione della curva di affinità dell‟emoglobina per l‟ossigeno (mantiene l‟emoglobina nella
configurazione deossi-Hb che ha bassa affinità per l‟ossigeno).
Si ha anemia per aumento di 2,3 DPG.
La curva di saturazione dell‟emoglobina è sigmoide; c‟è allosterismo positivo. A una pressione parziale
di ossigeno pari a 75 mmHg c‟è già saturazione al 100% grazie ad allosterismo positivo.
La curva è più spostata verso destra da: diminuzione del pH, aumento di 2,3 DPG, aumento della
temperatura.
Nell‟alcalosi c‟è solo il 15% di cessione di ossigeno ai tessuti; in condizioni normali ne viene ceduto il
30%.
In acidosi, per effetto Bohr, viene ceduto il 45% di ossigeno.
Se la curva si sposta a destra, aumenta la quantità di ossigeno ai tessuti.
Quando c‟è cessione di ossigeno i ponti fra le catene e dell‟emoglobina si allargano e vi si inserisce
il 2,3 DPG che mantiene l‟emoglobina in una configurazione che ha bassa affinità per l‟ossigeno.
ANEMIE DA RIDOTTA PRODUZIONE DI ERITROCITI (da
ridotta eritropoiesi)
- Difetti di proliferazione e differenziazione delle cellule staminali;
Anemia aplastica acquisita: anemia conseguente ad alterazione della cellula staminale multipotente
mieloide, e caratterizzata da insufficiente produzione e rilascio di elementi differenziati con
conseguente:
1) anemia: nel caso di perdita di globuli rossi;
2) neutropenìa: nel caso di perdita di granulociti neutrofili;
3) piastrinopenìa: nel caso di perdita di piastrine.
Il midollo è ipocellulare (privo di cellule emopoietiche).
Nel sangue periferico c‟è PANCITOPENIA (anemia, neutropenia, trombocitopenia).
Eziologia (cause):
- idiopatica (65%);
- specifica (35%):
1) agenti mielotossici (reversibile con l‟eliminazione della noxa sostanze chimiche come benzene,
chemioterapici, radiazioni ionizzanti);
2) agenti induttori di danno su base immunologica, dose-indipendente, potenzialmente grave e spesso
fatale (dovuta a:-farmaci: FANS, anticonvulsivanti, antibiotici o ad -infezioni virali: HCV, EBV, HIV,
B19).
La staminale subisce un insulto che può indurre espressione di nuovi antigeni (risposta T e danno) o
selezionare cloni con ridotta capacità proliferativa e differenziativa.
In entrambi i casi c‟è aplasia midollare.
N.B. i due meccanismi possono coesistere.
Clinica:
- età/sesso indipendente;
- sintomi correlati ad anemia che porta a debolezza e astenia;
- sintomi correlati a neutropenia con infezioni che recidivano e persistono;
- piastrinopenìa (ecchimosi, petecchie, sanguinamenti anormali);
MIELOTOSSICITA‟ DOSE-DIPENDENTE
- Esordio graduale;
- Prognosi favorevole;
- Terapia: eliminazione della causa.
MIELOTOSSICITA‟ IMMUNOLOGICA (FORME IDIOPATICHE)
- Esordio brusco;
- Prognosi infausta senza terapia;
- Terapia immunosoppressiva;
- Ig anti linfociti timici;
- Trapianto di midollo.
Anemia di Fanconi (o anemia aplastica congenita):
- è una forma di anemia aplastica ereditaria dovuta a insufficienza del midollo osseo;
- molto rara;
- autosomica recessiva con alterazioni a carico dei geni FAC (alterazione dei meccanismi di riparazione
del DNA, con conseguente instabilità cromosomica sotto esposizione a sostanze alchilanti e radiazioni
ionizzanti; difetto della proliferazione cellulare);
- ipofunzione midollare evidente dalla prima decade di vita;
- oltre che a pancitopenia e aplasia midollare è caratterizzata da anomalie congenite multiple (ipoplasia
ossea, ipoplasia renale e splenica, difetto della pigmentazione).
Anemia eritrocitaria pura:
- Anemia caratterizzata dalla distruzione o dalla ipoproliferazione dei solo precursori midollari
eritroidi;
- Determina esclusivamente anemia, i granulociti e le piastrine sono nella norma.
Eziopatogenesi (cause):
- idiopatica;
- secondaria a forme virali (B19), neoplasie timiche, malattie autoimmuni;
- sindrome di Blackfan-Diamond, ereditaria, associata a precursori difettivi con ridotta capacità di
risposta all‟eritropoietina.
Morfologia:
Nel midollo c‟è assenza selettiva dei precursori eritroidi, con precursori mieloidi e megacariociti
normali.
In periferia: anemia senza neutropenìa e piastrinopenìa;
Clinica:
- Forme acute spesso autolimitanti (infezioni);
- Forme croniche con ricadute (neoplasie timiche).
Terapia:
- asportazione del timo;
- terapia immunosoppressiva corticosteroidea;
- terapia trasfusionale (emazie concentrate).
Anemia da nefropatia cronica (anemia uremica):
Anemia conseguente a insufficienza renale cronica.
Patogenesi:
- Secondaria a ridotta produzione di EPO;
- Tossina “uremica” con azione di soppressione sui precursori eritroidi;
- La gravità di anemia è proporzionale al grado di insufficienza renale cronica.
Terapia:
- somministrazione di EPO.
Morfologia:
- In periferia: anemia con emazie “a smeriglio” (echimociti), con bordi dentellati; in presenza di
ipertensione arteriosa emazie frammentate (o “schistociti”).
ANEMIE DA DIFETTI DI MATURAZIONE
DELL’ERITROCITA
METABOLISMO DEL FERRO:
L‟escrezione di ferro è di 1-2 mg/die, dovuto alla perdita delle cellule mucosali ed epiteliali: il
ferro-eme, dei globuli rossi, andati incontro a emocateresi o emolisi intravascolare, viene recuperato.
Le diete occidentali contengono 10-20 mg di ferro: il 20% del ferro eminico (carne), viene assorbito
tale e quale dagli enterociti per mezzo di un trasportatore specifico; solo il 5% di ferro ingerito
non-eme (vegetali) è assorbito previa riduzione da Fe3+ a Fe2+operata da un citocromo B duodenale.
I depositi intracellulari di ferro sono costituiti da ferritina (15-20 g/l) ed emosiderina; il trasportatore
plasmatico è la transferrina (300-350 g/dl che rappresenta la capacità totale ferro-legante; e 120 g/dl
= sideremia).
Transferrina
È una -globulina sintetizzata dal fegato; trasporta due atomi di Fe3+ e li cede a cellule e tessuti.
La concentrazione totale plasmatica di transferrina è 300-350 g/dl (TIBC rappresenta la capacità
ferro-legante della transferrina).
La concentrazione plasmatica, saturata da Fe3+ è di 100-120 g/dl (30% ferro sierico o sideremia).
In condizioni di aumentato fabbisogno di ferro si assiste ad un aumento della velocità di trasporto e
desaturazione della transferrina e aumento di sintesi epatica della transferrina stessa.
Ferritina
Costituita da 24 subunità proteiche; lega fino a 4300 atomi di Fe3+. E‟ il deposito intracellulare più
accessibile e strutturato di ferro. Nel plasma circolano solo basse quantità di ferritina (15-200 mg/ml)
che riflettono comunque il ferro di deposito.
Emosiderina
Composta da grassi aggregati granulari e disordinati di ferro che derivano dalla degradazione
lisosomiale della ferritina.
La mobilizzazione del ferro dall‟emosiderina è molto lenta.
È la forma di ferro del sovraccarico marziale (organi bersaglio: fegato, milza, cuore, SRE etc.).
I recettori per transferrina sono in tutte le cellule e la transferrina entra per endocitosi mediata da
recettore. Si ha overespressione del recettore quando il ferro è basso.
ASSORBIMENTO DEL FERRO:
- Ferro eminico: da emoglobina, emoglobina e altre proteine; entra bene in mucosa in quanto assorbito
come tale dopo separazione dalla globina.
- Ferro non eminico: nello stomaco le mucine legano Fe2+ a pH acido e lo mantengono in soluzione a
pH più alcalini.
Il ferro legato a mucine viene trasportato tramite DMT1; la mobilferritina fa da tramite e passa il ferro
alla transferrina plasmatica.
In condizioni in cui si ha carenza di ferro, si osserva un aumento della produzione di transferrina, e un
aumento del trasferimento di ferro alla transferrina (grazie a EPO).
Anemia sideropenica:
- Anemia correlata a ridotta sintesi di eme ed eritropoiesi difettiva dovuta a carenza di ferro.
Eziologia:
Un deficit di ferro può essere causato da: carenza alimentare (condizione rara nei paesi Occidentali, più
frequente in quelli in via di sviluppo, con dieta prevalentemente vegetariana), aumentata richiesta
(come accade nel periodo dell‟accrescimento e nelle donne in gravidanza), perdita ematica cronica
(spesso dovuta ad emorragia gastro-intestinale o genito-urinaria), ridotto assorbimento (come avviene
in caso di gravi sindromi da malassorbimento, diarrea profusa, resezione gastrica e duodenale)
Evoluzione clinica:
1) bilancio negativo del ferro:
- diminuzione della ferritina (< 12 g/dl) e dell„emosiderina;
- mobilizzazione dai depositi.
2) ferro carente:
- diminuzione ulteriore di ferritina;
- diminuzione del ferro sierico;
- diminuzione della saturazione della transferrina (dal 30% al 15%).
3) anemia sideropenica:
- Prima fase: anemia normocitica-normocromica con valori di emoglobina maggiori di 10 mg/dl;
- Seconda fase: anemia microcitica-ipocromica con anisopoichilocitosi e si manifesta quando le scorte
di ferro sono totalmente esaurite.
* tutte le anemie da carenza di ferro si associano a piastrine alte; se si effettua terapia marziale (con
ferro) i reticolociti aumentano.
Sintomatologia:
- aspecifica correlata ad anemia;
- associata alla patologia di base (in particolare, forme da aumentata perdita);
Segni clinici:
- diminuzione dei globuli rossi;
- diminuzione dell‟emoglobina;
- diminuzione dell‟MCV (volume corpuscolare medio).
Fabbisogno di ferro:
- correlato a perdite giornaliere che nell‟uomo sono intorno a 1 mg/die e nella donna in età fertile
intorno a 2-3 mg/die. L‟introito medio in paesi avanzati è 10-20 mg/die, ma solo il 10/15% viene
assorbito e reso biodisponibile.
Biodisponibilità:
- Il ferro eminico è facilmente assorbibile; ha massima biodisponibilità.
- Il ferro inorganico è meno biodisponibile perché influenzato da altri fattori della dieta.
la biodisponibilità è aumentata da sostanze riducenti: vitamina C, aminoacidi, zuccheri, alimenti;
la biodisponibilità è diminuita da sostanze chelanti: carboidrati, ossalati, fosfati.
Anemie da insufficiente apporto:
Dovute a:
1) carenze nutrizionali:
- popolazioni in paesi in via di sviluppo;
- anziani con dieta variata a causa di particolari condizioni fisiche-patologiche (depressione);
- giovani con turbe del comportamento alimentare.
2) aumentata richiesta:
- per necessità di espandere il volume ematico;
- gravidanza e allattamento.
3) ridotto assorbimento:
- sindromi da malassorbimento (malattia di Crohn);
- gastrectomia.
Anemie da aumentata perdita:
- malattia peptica, gastriti, neoplasie gastriche;
- emorroidi, carcinomi del colon retto, malattie croniche, intestinali, infezioni parassitarie, diverticoli.
- a livello urinario, neoplasie del rene e della vescica.
- a livello del tratto genitale, carcinoma dell‟utero ed emorragie.
Sono tutte patologie da sanguinamento, generalmente neoplastiche.
ANEMIE MEGALOBLASTICHE
Correlate con ridotta sintesi di DNA, caratterizzate da precursori eritroidi ed eritrociti “megalo” per
difetto di maturazione e divisione cellulare.
Eziologia:
- carenza di vitamina B12 (anemia perniciosa);
- carenza di acido folico.
* Vitamina B-12 e acido folico sono coenzimi di vie metaboliche che portano alla sintesi di DNA, e
alla normale sintesi di RNA e proteine ( asincronismo), e alla maturazione del nucleo e del
citoplasma ( macrocitosi).
Metabolismo della vitamina B-12:
- fabbisogno: 1 g al giorno;
- depositi normali dell‟organismo pari a 1000-5000 g;
- disponibilità: da fonti alimentari; da sintesi della flora batterica intestinale.
È assorbita solo in presenza di fattore intrinseco, secreto dalle cellule parietali della mucosa gastrica
insieme ad HCl.
Assorbimento di vitamina B-12 ( = cobalamina):
- l‟uomo dipende totalmente dai prodotti alimentari di origine animale per il suo fabbisogno giornaliero
(2-3 mg di vitamina B-12): una dieta bilanciata ne mantiene quantità notevoli tali da consentire un
accumulo sufficiente per anni.
- nello stomaco la pepsina scinde il legame tra la vitamina B-12 e le proteine alimentari (così la B-12 si
libera);
- la vitamina B-12 si lega a CABALOFILINE (R-legante), proteine salivari e in questa forma viene
condotta nel duodeno (insieme al fattore intrinseco);
- il complesso vitamina B-12-R-legante è scisso nel duodeno da proteasi pancreatiche permettendo così
il legame con il fattore intrinseco (secreto dalle cellule parietali gastriche);
- la vitamina B-12 si lega a fattore intrinseco;
- il complesso vitamina B-12-fattore intrinseco raggiunge l‟ileo dove si lega a recettori specifici per il
fattore intrinseco per poi essere internalizzato da cellule epiteliali e scisso (meccanismo endocitico);
- la vitamina B-12 viene legata ad una proteina di trasporto (trans-cobalamina II) ed entra in questa
forma nel flusso portale;
- la transcobalamina distribuisce la vitamina B-12 alle cellule epatiche e alle cellule in rapida
proliferazione.
Metabolismo dell’acido folico
L‟uomo dipende totalmente dai vegetali verdi crudi, come fonte alimentare per il fabbisogno
giornaliero di folato (50-200 mg al giorno).
* Assorbimento del folil-poliglutammato:
- Nel lume del digiuno prossimale, le coniugasi scindono il folil poli-glutammato in mono-glutammati
e di-glutammati;
- Nel tenue, mono e di-glutammati vengono assorbiti, quindi ridotti (DHFR) e metilati. La forma di
trasporto è data da una proteina legante FH4 più folati.
L’anemia da carenza di vitamina B-12 è dovuta a:
Patologia ad esordio subdolo caratterizzata da:
- anemia megaloblastici: la deficienza di vitamina B-12 impedisce la produzione di timidina; ne deriva
una ritardata sintesi del DNA nucleare, mentre la sintesi dell‟RNA e proteine citoplasmatiche è
normale asincronia nucleo-citoplasmatica;
- leucopenia con granulociti ipersegmentati; a causa del ridotto turnover cellulare i leucociti circolanti
sono più vecchi;
- trombocitopenia;
- lieve ittero da eritropoiesi inefficace ed emolisi intravasale (i globuli rossi lisati liberano
l‟emoglobina);
- alterazioni neurologiche: la vitamina B-12 è coinvolta nel metabolismo dell‟acido metilmalonico: un
accumulo di questo acido grasso tra i lipidi neuronali predispone alla distruzione della mielina;
- alti livelli sierici di omocisteina: la vitamina B-12 è implicata nella conversione dell‟omocisteina in
metionina l‟omocisteina è un fattore di rischio per aterosclerosi.
Eziologia:
1) Carenze nutrizionali:
- carenze da particolari abitudini alimentari (vegetariani);
- turbe del comportamento alimentare.
2) aumentata richiesta:
- gravidanza e allattamento;
- ipertiroidismo;
- neoplasie maligne.
3) ridotto assorbimento:
- ridotta disponibilità di fattore intrinseco (anemia perniciosa, gastrectomia);
- sindromi da malassorbimento;
- competizione con flora batterica intestinale.
Eziopatogenesi (4 livelli):
1) Acloridria e ridotta secrezione di pepsina (come accade sovente negli anziani), con conseguente
ridotta scissione di vitamina B-12 da parte di proteine.
2) Gastrectomia/anemia perniciosa: riduzione di fattore intrinseco, con conseguente riduzione del
trasporto e dell‟assorbimento di vitamina B-12.
3) Insufficienza pancreatica esocrina: riduzione di proteasi, e riduzione della scissione di R-B12.
4) resezione ileale/competizione batterica: riduzione dell‟assorbimento di fattore intrinseco e B-12.
5) Infestazione da tenie.
Anemia perniciosa:
Anemia megaloblastica associata a distruzione della mucosa gastrica per meccanismi autoimmuni
(gastrite cronica atrofica con infiltrato infiammatorio mononucleato) e a ridotta produzione di fattore
intrinseco. La patogenesi è probabilmente autoimmune, dovuta ad una risposta T-mediata contro le
cellule parietali gastriche.
I pazienti presentano sovente autoanticorpi nel plasma e nei succhi gastrici. Sulla mucosa gastrica
contribuiscono ad aggravare il danno cellulare, non sono essi stessi la causa del danno.
Si distinguono:
- di tipo I: anti-fattore intrinseco bloccano il legame tra vitamina B-12 e fattore intrinseco.
- di tipo II: anti-recettore ileale.
- di tipo III: anticorpi anti-pompa protonica.
Anemia da carenza di acido folico
Anemia megaloblastica avente le stesse caratteristiche di quella caratterizzata dalla carenza di vitamina
B-12, ad eccezione dei disturbi neurologici.
Eziologia:
- Insufficiente apporto;
- Diete scorrette: carenti di folati (etilisti cronici, anziani e indigeni);
- Aumentata richiesta: gravidanza; infanzia; incremento dell‟emopoiesi (anemie emolitiche); neoplasie
maligne disseminate.
- Ridotta biodisponibilità: antagonisti metabolici degli acidi folici;
- Sindrome da malassorbimento: ridotto assorbimento di folati;
- Assunzione di inibitori della diidro-folato-reduttasi (chemioterapici).
ANTIMETABOLITI DELL‟ACIDO FOLICO:
1) inibitori del DHFR (diidro-folato-reduttasi).
- metotrexate, 6-mercaptopurina, ciclofosfamide: colpiscono la sintesi del DNA in tutte le cellule a
rapida crescita (ruolo come farmaci antiblastici).
- antidoto dell‟acido folico.
QUADRO DELL‟ANEMIA MEGALOBLASTICA (SIA DA DEFICIT DI B-12 CHE DI FOLATI)
- Diminuzione globuli rossi;
- Diminuzione emoglobina;
- Diminuzione ematocrito;
- Aumento MCV (volume corpuscolare medio);
- Aumento dei reticolociti dopo terapia.
In periferia: ci sono neutrofili ipersegmentati (5-7) vecchi il midollo funziona poco. Emazie ovali
prive di pallore centrale.
A livello del midollo: precursori eritroidi megaloblastici.
Caratteristiche:
- anemia macrocitica, neutropenìa con neutrofili ipersegmentati, piastrinopenìa;
- ridotti livelli plasmatici di B-12 e/o acido folico;
- iperomocisteinemia;
- autoanticorpi sierici;
- reticolocitosi dopo terapia;
- alterazioni istocitopatologiche gastriche (gastroscopia e biopsia) - gastrite atrofica.
- alterazioni neurologiche per difetto di vitamina B-12;
- alterazioni nell‟assorbimento di vitamina B-12 (test di Shilling).
ANEMIE EMOLITICHE
Anemia da aumentata distruzione delle emazie.
Emolisi:
- aumentata e prematura distruzione dei globuli rossi che ne accorcia il ciclo vitale;
- in condizioni normali (emocateresi) e nella maggior parte delle anemie emolitiche, l‟emolisi avviene
all‟interno del sistema reticolo-endoteliale della milza, e in minor misura nel fegato (emolisi
extravascolare).
- in alcuni casi avviene nel torrente circolatorio (emolisi intravascolare).
Fisiopatologia dell‟emolisi:
L‟emoglobina libera nel sangue si lega all‟aptoglobina: una diminuzione di aptoglobina in circolo è
indice di aumentata emolisi.
L‟emoglobina si lega ad emopessina, quando non è disponibile si lega all‟albumina.
Il rene riassorbe, ma quando è troppa si ha emoglobinuria (>13 mg/dl). Un meccanismo compensatorio
è l‟aumento di EPO con conseguente cambiamento del rapporto mieloide/eritroide; se l‟emolisi non è
eccessiva, questo meccanismo può bastare, mentre se la vita dei globuli rossi è inferiore ai 15 giorni si
ha anemia emolitica.
Classificazione eziopatogenetica:
- Anemie emolitiche da anomalie intrinseche-intracorpuscolari, generalmente ereditarie;
- Anemie emolitiche da anomalie estrinseche.
ANEMIE EMOLITICHE DA CAUSE INTRINSECHE
(congenite)
SINDROMI TALASSEMICHE
Patologie ereditarie conseguenti a difetti dei geni che codificano per le catene o dell„emoglobina
con conseguente ridotta sintesi dell„emoglobina adulta ( 2 2) e sintesi compensatoria di tetrameri o
.
Si distinguono in:
- -talassemie (quattro quadri);
- -talassemie (mutazione puntiforme a carico della globina ).
Le emazie appaiono ipocromiche e microcitiche, con una ridotta capacità di trasportare ossigeno;
inoltre gli omotetrameri che precipitano nei globuli rossi causano danno diretto alla membrana
determinando eritropoiesi inefficace ed emolisi intravascolare e predispongono le cellule
all‟emocateresi. Tra le manifestazioni cliniche (proporzionali alla gravità della mutazione) si ha anemia
emolitica e microcitica.
EMOGLOBINOPATIE
- ANEMIA FALCIFORME: patologia autosomica recessiva causata da mutazione puntiforme
glutammato-valina in posizione 6 sul gene per le catene dell‟emoglobina. Ne deriva l‟ HbS, alterata,
che in condizioni di bassa pO2 polimerizza formando fibre tattoidi che deformano gli eritrociti. Le
emazie falcizzate in modo irreversibile hanno membrane rigide e fragili che difficilmente consentono il
transito attraverso i sinusoidi splenici determinando l„incrementata emocateresi; si può avere anche
emolisi intravasale. L„evoluzione clinica è caratterizzata da grave anemia, crisi vaso-occlusive
dolorose, iperbilirubinemia cronica
DIFETTI ENZIMATICI INTRACOSPUSCOLARI
- CARENZA DI GLUCOSIO-6-FOSFATO-DEIDROGENASI: patologia recessiva X-linked, dovuta
alla presenza di alleli codificanti per glucosio-6-fosfato-deidrogenasi mutati, suscettibili a
ubiquitinazione precoce.
Varianti patologiche classiche:
1) Glucosio-6-fosfato-deidrogenasi di tipo A: degli afro-americani (attività dell‟enzima variabile tra il
10 e il 60% del normale);
2) Glucosio-6-fosfato-deidrogenasi di tipo B: mediterranea; ne esistono circa 50 varianti, attività
inferiore al 10%. I globuli rossi più vecchi, avendo un minor numero di enzimi disponibili, manifestano
alterazioni nella via dei pentoso fosfati con conseguente incrementata suscettibilità allo stress
ossidativo (potenzialmente indotto da farmaci, alimenti, ROS leucocitari). L‟Hb si può ossidare,
precipitando come corpi di Heinz, i quali possono:
- ledere la membrana causando emolisi intravascolare con emoglobinemia e emoglobinuria;
- accorciare l‟emivita dei globuli rossi poiché i macrofagi splenici riconoscono le cellule contenenti
precipitati patologici, le fagocitano parzialmente (“cellule morsicate”) e le predispongono
all‟emocateresi.
Cause scatenanti:
- infezioni (epatite virale, polmonite);
- farmaci ossidanti;
- ingestione di fave (favismo).
- ANEMIA DA CARENZA DI PIRUVATO CHINASI (PK): patologia autosomica recessiva dovuta
alla deficienza dell‟enzima glicolitico piruvato chinasi; ne deriva una ridotta produzione di ATP da
parte degli eritrociti che, così incorrono nello squilibrio elettrolitico, conseguente all„alterata funzione
della pompa Na+/K+.
Caratteristiche:
- l‟emolisi dipenda da una ridotta funzione della pompa Na+/K+ ATPasi di membrana, per carente
sintesi di ATP lungo la via glicolitica.
- la perdita di potassio supera l‟ingresso di sodio, con raggrinzimento e deformazione della membrana
del globulo rosso che viene prematuramente rimosso dal sistema reticolo-endoteliale.
DIFETTI DI MEMBRANA
SFEROCITOSI EREDITARIA: patologia autosomica dominante dovuta a mutazioni a carico dei geni
per le proteine costituenti il citoscheletro della membrana plasmatica eritrocitaria (proteina della
banda-3; proteina della banda 4.2; anchirina; spectrina).
L‟eritrocita è abnormemente sensibile allo stress da taglio e può perdere frammenti di membrana
andando così ad assumere forma sferica: gli sferociti sono scarsamente deformabili e vengono
intrappolati nei sinusoidi splenici per essere rimossi.
Manifestazioni cliniche tipiche sono anemia e splenomegalia (da incrementata emocateresi) ed ittero
(per conversione, operata dai fagociti, dell‟eme emoglobinico in bilirubina non coniugata).
ELLIPTOCITOSI: patologia autosomica dominante dovuta a deficit della proteina della banda 4.1 con
conseguente alterato assemblaggio della spectrina alla membrana; gli eritrociti appaiono ellittici.
Raramente causa anemia e splenomegalia.
ACONISOCITOSI: anemia dovuta ad eccesso di colesterolo.
ANEMIE EMOLITICHE DA CAUSE ESTRINSECHE
(acquisite)
DIFETTI DI MEMBRANA ACQUISITI
EMOGLOBINURIA PAROSSISTICA NOTTURNA: patologia X-linked dovuta all‟alterazione del
gene codificante per PIG-A, componente essenziale del glicosilfosfatidilinositolo (GPI), un fosfolipidi
di membrana che consente l‟ancoraggio alla membrana di numerose proteine.
In questa patologia gli eritrociti risultano sprovvisti di diversi inibitori del complemento tra cui il più
importante è CD59 (inibitore della C3 convertasi). L‟attivazione spontanea della via alternativa del
complemento determina emolisi cronica con modesta emoglobinuria; a dispetto della denominazione,
l‟emolisi intravasale è raramente parossistica e notturna. È stato osservato che molti soggetti normali
presentano piccole quantità di staminali midollari con mutazioni di PIG-A: si ritiene che queste
proliferino producendo un quadro clinico evidente solo in rare condizioni ove esse hanno un vantaggio
selettivo (es. aplasia midollare per distruzione immuno-mediata delle normali HSC).
Perché di notte? Perché si abbassa il pH che stimola il complemento.
Caratteristiche:
- crisi emolitiche intravascolare intermittenti, talora in condizioni di diminuzione del pH;
- emoglobinuria: per diminuzione di aptoglobina;
- reticolocitosi (fino a quando supportati da riserva di ferro e folati);
- diagnosi con citometria a flusso (test di Ham).
DIFETTI EXTRAVASCOLARI
ANEMIE IMMUNOEMOLITICHE: secondarie ad anticorpi (allo- e auto-anticorpi) diretti contro
antigeni presenti sulla superficie dei globuli rossi.
Si classificano in base all‟anticorpo interessato (caldi o freddi).
Si distinguono dalle anemie emolitiche non immunologiche per la positività al test di Coombs (diretto e
indiretto).
* TEST DI COOMBS: si utilizza per evidenziare l‟eventuale presenza nel sangue di un paziente di
autoanticorpi anti-eritrocitari. Può essere:
- Diretto determinazione della presenza di autoanticorpi:
1) si preleva sangue intero del paziente e se ne estraggono le sole emazie;
2) si cimentano le emazie lavate con siero di coniglio (contenente anticorpi contro le IgG umane);
3) se le emazie del paziente ricoperte da auto-anticorpi, verranno agglutinate dall‟anticorpo di coniglio.
- Indiretto determinazione dell‟antigene bersaglio degli anticorpi:
1) si preleva il siero del paziente in cui si ipotizza la presenza di autoanticorpi;
2) si cimenta il siero del paziente con globuli rossi normali o di gruppo 0;
3) si esegue il test diretto: se le emazie vengono agglutinate è evidente che nel siero del paziente sono
presenti autoanticorpi diretti contro antigeni presenti sui globuli rossi usati per il test.
Nelle anemie immunoemolitiche gli anticorpi possono essere:
- Anticorpi caldi (80% dei casi): IgG con generica specificità per antigeni eritrocitari del sistema Rh.
Hanno massima affinità a 37°C. I globuli rossi rivestiti da IgG vengono riconosciuti dai macrofagi
splenici (Fc -R) e rimossi (emolisi extravascolare). L‟eziologia è per lo più idiopatica.
* Sono note alcune forme indotte da farmaci:
MECCANISMI PATOGENETICI DI FORME INDOTTE DA FARMACI
1) modello aptene: indotto da dosi massive di penicillina e cefalosporine; il farmaco si comporta da
aptene legato alla membrana del globulo rosso IgG rivolte contro il complesso farmaco-globulo
rosso.
2) modello dell‟immunocomplesso: il farmaco stimola la risposta anticorpale a cui segue formazione di
immunocomplessi circolanti che si depositano sulla membrana dei globuli rossi.
3) modello autoanticorpale: -metil-dopa; il farmaco induce produzione di IgG rivolte verso antigeni
Rh. Le IgG legano emazie ma non agglutinano, né attivano il complemento; arrivano alla milza dove ci
sono macrofagi dotati di recettore per Fc emolisi intravascolare.
- Anticorpi freddi: è una forma poco comune di anemia immunoemolitica caratterizzata dalla presenza
di IgM con massima attività a 30°C, rivolti principalmente contro gli antigeni eritrocitari del sistema
I/i.
Nei distretti periferici, a bassa temperatura, questi anticorpi agglutinano le emazie (determinando
microocclusioni vascolari) e attivano il complemento (causando emolisi intravascolare
complemento-mediata) vedi dopo meccanismo di emolisi.
Eziologia:
- idiopatica;
- agente infettivo (mononucleosi; citoplasma);
- cronica associata a malattie linfoproliferative.
Meccanismo di emolisi:
- Emolisi intravascolare mediata dal complemento se rimangono attaccati a C3b.
- Se si staccano rimane C3b che causa emolisi nel fegato e nella milza (emolisi extravascolare).
- Periferico: agglutinazione eritrocitaria a temperature inferiori a 30°C;
- Emocromo: risultati spuri con diminuzione delle RBC e diminuzione dell‟ematocrito correggibili
riscaldando il campione a 37°C.
EMOGLOBINURIA PAROSSISTICA DA FRIGORE: si osserva la presenza di emolisine fredde,
ovvero, auto-anticorpi di classe IgG specifici per antigeni P dei globuli rossi; tali anticorpi sono attivi a
basse temperature e sono capaci di attivare una massiva emolisi intravasale complemento-mediata
acuta dopo esposizione al freddoEziologia:
- ignota per la maggior parte dei casi;
- sifilide; citoplasmi;
- malattie simil-influenzali.
ANEMIE EMOLITICHE NON IMMUNOLOGICHE DA FRAMMENTAZIONE MECCANICA
I globuli rossi normali sono distrutti da forza meccaniche in ambiente intravascolare.
- ANEMIE MACROANGIOPATICHE: trauma diretto suo globuli rossi esercitato da una anomala
superficie vascolare (protesi valvolari artificiali; flussi turbolenti; shear stress).
- ANEMIE MICROANGIOPATICHE: anomalie del microcircolo che generano turbolenza del flusso
dovuta a microtrombi piastrinici causati da danno endoteliale e/o anomala aggregazione piastrinica.
(CID; porpora trombotica trombocitopenica; sindrome emolitica uremica)
Periferia: globuli rossi frammentati ad “elmetto” (schistociti); reticolocitosi; nella CID presenza di
piastrinopenìa ed alterazione della coagulazione (diminuzione aPTT; PT; FIB).
PATOLOGIA DELL’EMOSTASI
CENNI DI FISIOLOGIA
Emostasi primaria
1) Fase vascolare: vasocostrizione riflessa + azione locale dei vasocostrittori (ET e 5HT);
2) Fase piastrinica: le piastrine aderiscono all‟ECM esposta attraverso il legame gpIb/vWF;
successivamente vengono attivate, cambiano forma, esponendo gpIIb/IIIa e fosfolipidi essenziali per
l‟attivazione della via intrinseca della coagulazione.
Degranulando liberano calcio (indispensabile per la cascata coagulativa) e ADP (potente induttore
dell‟aggregazione piastrinica).
Iniziano a sintetizzare trombossanoA2 (vasocostrittore e induttore dell‟aggregazione); molte piastrine si
aggregano a formare il trombo bianco stabilizzate dal legame fibrinogeno-gpIIb/IIIa.
Emostasi secondaria (coagulazione)
Il fattore 12, attiva il fattore 11, che attiva il fattore 9 (via intrinseca); dall‟altra parte il fattore
7+fosfolipidi+calcio (via estrinseca); tali due vie, convergono entrambe nell‟attivazione del fattore 10
(fattore comune) da cui parte la via comune, che inizia con l‟attivazione del fattore 2 che attiva il
fattore 1 con conseguente formazione del trombo rosso.
Fibrinolisi
Liberazione da parte delle piastrine attivata dalla fibrina del tPA.
EMOSTASI
Risultato di una serie di processi integrati volti ad arrestare l‟emorragia a seguito di danno vascolare.
Malattie emorragiche:
1) Congenite:
- Malattia di Von Willerbrand: deficit qualitativi o quantitativi del vWF.
- Sindrome di Bernard-Soulier: deficit di gp/Ib.
- Malattia di Glenzmann: assenza o aberrazione di gpIIb/IIIa.
- Sindrome di Pudlok: assenza di granuli densi contenenti ADP, ATP, calcio, HIST, 5-HT, A.
Importante è il deficit di calcio (essenziale nella cascata coagulativa e nei processi legati all‟attivazione
piastrinica, al cambiamento di forma, alla degranulazione e all‟attivazione della sintesi di trombossano
A2) e di ADP (potente induttore dell‟aggregazione piastrinica).
- Malattia delle piastrine grigie: assenza congenita dei granuli , contenenti principalmente
fibrinogeno, fattore piastrinico-4, PAF, e GF.
2) Acquisite:
- Ig monoclonali anti-gp/Ib: malattia autoimmune con anticorpi anti-vWF, metaboliti del ciclo dell‟urea
che competono con il vWF.
- Inibitori delle COX (trombossano A2).
3) Da ridotta produzione e maturazione: possono essere congenite (sindrome di Wiskott-Aldricht) o
acquisite (neoplasie infiltranti il midollo). In entrambi i casi si osserva una trombocitopoiesi
inefficiente con pochi megacariociti midollari.
4) Da aumenta distruzione/perdita: le piastrine possono essere riconosciute da anticorpi anti-piastrine
(trombocitopenia autoimmune), possono essere distrutte dal complemento, avendo legato un
immunocomplesso contenente un farmaco (eparina).
5) Da aumentato consumo.
6) Deficienze congenite dei geni per i fattori della coagulazione.
Esempi:
- emofilia A (deficit del fattore 8) malattia X-linked recessiva;
- emofilia B (deficit del fattore 9) malattia X-linked recessiva;
- deficienza di fattori vitamina-K dipendenti (2-7-9-10) a causa di carenze alimentari o
malassorbimento;
- deficienza di fattori della coagulazione di origine epatica per danno strutturale o funzionale degli
epatociti.
TROMBOSI
Inappropriata attivazione dei normali meccanismi emostatici con la formazione di un trombo
responsabile dell‟occlusione parziale o totale del lume vasale.
Disfunzione endoteliale da stress emodinamico per aumento di fattori protrombotici (FT) o
diminuzione di fattori antitrombotici (NO, PGI2, tPA).
Destino del trombo:
1) DISSOLVIMENTO: il trombo può essere rimosso dall‟attività fibrinolitica;
2) EMBOLIZZAZIONE: il trombo si frammenta in emboli che viaggiano nel torrente ematico fino ad
arrestarsi in vasi di piccolo calibro determinandone l‟ostruzione parziale o totale.
3) PROPAGAZIONE: una maggior quantità di piastrine e di fibrina si accumula incrementando le
dimensioni del trombo.
4) ORGANIZZAZIONE: il trombo vecchio può essere incluso nella parete del vaso circondato da
tessuto fibroso.
TRIADE DI VIRCHOW
1) Danno endoteliale;
2) Alterazione del flusso: turbolenza (stress endoteliale) o stasi (diminuzione della diluizione dei fattori
procoagulanti).
3) Ipercoagulabilità: mutazione del fattore 5; eccessiva sintesi di protrombina; deficit di
antitrombina-III; proteina C e proteina S; o per trombocitopenia eparina-indotta.
TROMBOSI VENOSA
Si divide in:
- superficiale: interessa frequentemente il sistema della safena. Ha generalmente carattere ostruttivo
determinando congestione locale, edema, tumefazione e dolore. Raramente embolizza.
- profonda: interessa generalmente le vene poplitee, femorali e iliaca. A carattere ostruttivo; ma nel
50% dei casi è clinicamente asintomatica; può causare embolia polmonare.
TROMBOSI ARTERIOSA
Ha spesso carattere ostruttivo; si localizza generalmente in prossimità di una placca ateromatosa, in
quanto è responsabile dell‟alterazione del flusso emodinamico e, se complicata, espone il
sottoendotelio. Determina ischemie nei tessuti a valle; può frammentarsi in emboli che vanno ad
ostruire arteriole terminali.
FISIOPATOLOGIA DELL’APPARATO
GASTRO-INTESTINALE
- Esofago, stomaco (gastrite, ulcera);
- Sindromi da malassorbimento (morbo celiaco e morbo di Whipple);
- Malattie infiammatorie (morbo di Crohn e colite ulcerosa);
- Fegato (epatiti virali).
STRUTTURA DEL TRATTO GASTRO-INTESTINALE:
Mucosa: costituita da cellule epiteliali (c‟è aumento del turnover nei tumori con prognosi sfavorevole);
Sottomucosa: connettivo lasso, vasi sanguigni, fibre nervose di Meissner;
Sierosa: connettivo e cellule mesoteliali (anche detto peritoneo viscerale);
CELLULE EPITELIALI DELLA MUCOSA GASTRICA
Cellule parietali: producono HCL e fattore intrinseco;
Cellule principali: producono enzimi;
Cellule mucose: producono muco.
ESOFAGO
Le patologie dell‟esofago sono sempre da ritenersi correlate ad uno dei seguenti fenomeni:
1) Incapacità di sospingere il bolo;
2) Infiammazioni della mucosa esofagea.
La mancata progressione del cibo nel tratto esofageo è detta DISFAGIA, ed è associata a malattie
sistemiche, nervose, o neuromuscolari (distrofia muscolare, morbo di Graves).
Anche le neoplasie di tipo ostruttivo possono ostacolare la progressione del cibo.
Il reflusso del chimo acido dello stomaco all‟esofago dà esofagiti.
Nell‟esofago il turnover è molto elevato: se c‟è trasformazione neoplastica è un evento sfavorevole.
ESOFAGO DI BARRET
In seguito al perpetrarsi di stimoli infiammatori l‟epitelio squamoso distale diventa colonnare
metaplasia, che può progredire fino a displasia.
L‟esofago di Barret può essere una conseguenza del reflusso gastrico. Si ricercano marcatori (p53,
marker di proliferazione, aneuploidia di DNA).
Quindi si cercano marcatori che diano indicazione su come e quando evolve la situazione patologica.
Patogenesi: un reflusso gastro-esofageo prolungato determina infiammazione e alla fine ulcerazione
dell‟epitelio squamoso. La guarigione si verifica mediante riepitilizzazione da parte delle cellule
staminali pluripotenti, che proliferando nel microambiente a basso pH nell‟esofago distale, si
differenziano a costituire un epitelio di tipo colonnare.
STOMACO
Le patologie gastriche sono divise in:
1) OSTRUTTIVE: sono associate a ipertrofia e restringimento dello sfintere pilorico, detta stenosi
pilorica (è congenita, e colpisce maggiormente i maschi), il segno clinico è il vomito a getto.
2) NEOPLASTICHE:
- benigne: adenomi e leiomiomi (muscolatura liscia);
- maligne: carcinomi.
3) INFIAMMATORIE:
- Gastriti:
Acuta, è un processo flogistico acuto della mucosa, in genere transitorio, con infiltrazione di
neutrofili; l‟infiammazione può essere accompagnata da emorragie intramucose, nei casi più gravi
dall‟erosione della mucosa superficiale. La gastrite è associata all‟assunzione di sostanze irritanti
(alcool, caffè, acidi biliari, FANS, coca cola, stress), all‟aumento della secrezione acida con diffusione
retograda, alla ridotta sintesi di tampone bicarbonato, decremento dell‟apporto ematico.
Cronica, definita dalla presenza di alterazioni infiammatorie croniche, caratterizzate da infiltrato di
linfociti e plasmacellule, della tonaca propria che portano infine all‟atrofia della mucosa e alla
metaplasia dell‟epitelio, generalmente in assenza di erosioni. Le alterazioni epiteliali possono diventare
displastiche e costituire lesione precancerosa. E‟ dovuta soprattutto a Helicobacter Pylori, che si
contrae per via oro-fecale e può portare a ulcera o neoplasie.
Le gastriti croniche possono portare a assenza di produzione di HCL o di fattore intrinseco e
compromettere così la digestione o generare anemia perniciosa. Anemia perniciosa e acloridria si
hanno principalmente nelle malattie autoimmuni perché ci sono autoanticorpi contro le cellule parietali.
Nelle gastriti dovute a Helicobacter Pylori si ha un danno alle cellule parietali, ma non la distruzione di
esse, quindi non si hanno acloridria e anemia perniciosa elevate.
Le ulcere peptiche sono soluzioni di continuo che si approfondiscono nella mucosa digerente, ma
possono coinvolgere anche la sottomucosa, la muscolaris mucosae.
Colpiscono:
- Stomaco: l‟85% la porzione inferiore della piccola curvatura, più di rado quella superiore; 10/20% la
parete posteriore; 2/5% cardias; 2% grande curvatura e parete anteriore.
- Duodeno: bulbo duodenale 60%, regione anteriore e posteriore 30%, seconda porzione del duodeno
10%.
- Digiuno e Esofago.
Possono essere associate a:
1) Ipo-resistenza della barriera mucosa (soprattutto gastrica);
2) Iper-secrezione acida (soprattutto negli altri distretti);
Possono avvenire anche insieme.
Le ulcere gastriche si associano spesso a distruzione della barriera mucosa, mentre in altri distretti sono
di solito dovute a iper-secrezione acida.
Il sito dipende dalla morfologia delle cellule, dalla capacità di rinnovamento, da dove si localizza il
bolo nella sua progressione.
CLASSIFICAZIONE DELLE ULCERE PEPTICHE
1) Ulcere correlate a Helicobacter Pylori;
2) Ulcere correlate ai FANS;
3) Ulcere di Zollinger-Ellison (iper-secrezione acida da tumori endocrini).
In condizioni normali, l‟attività della mucosa gastrica e duodenale, è mantenuta grazie a un bilancio
equilibrato tra:
- fattori aggressivi (HCL, pepsina, sali biliari, alcool, Helicobacter Pylori, fumo);
- fattori difensivi (secrezione di muco e bicarbonato, rigenerazione di nuove cellule epiteliali, normale
apporto di flusso ematico che costituisce una garanzia di protezione una zona ischemica è più
sottoposta a rischio).
Perché insorga il problema c‟è alla base uno squilibrio fra fattori difensivi e fattori aggressivi.
IPERSECREZIONE ACIDA
E‟ dovuta a:
1) Aumento di stimoli per le cellule parietali;
2) Aumento della sensibilità delle cellule parietali;
3) Aumento del numero delle cellule parietali.
Nell‟aria lesionata gli strati più superficiali vanno incontro a necrosi; sotto abbiamo un‟infiammazione
acuta non specifica; più sotto ancora abbiamo un aumento del tessuto di granulazione (l‟organismo
tenta di riparare il danno); infine abbiamo fibrosi che di solito si ha in tessuti con nulla o scarsa
capacità replicativa. La presenza di fibrosi indica che il danno è stato così grande che la capacità di
rinnovamento non è stata sufficiente.
Il fumo aumenta il rischio di sviluppo di ulcera duodenale, il rischio di fallimento della terapia
anti-acida, il rischio di recidiva.
Tutto ciò è direttamente proporzionale al numero di sigarette fumate.
CLINICA DELL‟ULCERA PEPTICA
1) Dolore:
- epigastrico di tipo crampiforme;
- ciclico a carattere stagionale (primavera e autunno);
- accentuato dalla palpazione.
2) Dispepsia (difficoltà nella digestione) con nausea e vomito post-prandiali;
3) Segno della piega naso-labiale.
Sintomi non specifici con tendenza a recidivare.
COMPLICANZE DELL‟ULCERA PEPTICA
1) Degenerazione carcinomatosa (3-9% dei casi);
2) Emorragia;
3) Anemia sideropenica;
4) Peritonite (ulcera perforata).
ULCERA DA HELICOBACTER PYLORI
Helicobacter Pylori, bacillo gram negativo non sporigeno comporta un‟infezione cronica durante la
quale il batterio si lega alle cellule epiteliali gastriche, rilascia enzimi come ureasi, che producendo
ammonio dell‟urea permettono di tamponare l‟acidità gastrica nelle immediate vicinanze del
microrganismo.Questo comporta una rottura dello strato mucoso della parete gastrica (provocando
quindi un abbassamento dei meccanismi di difesa).
C‟è quasi sempre gastrite antrale.
C‟è forte associazione di Helicobacter Pylori come cofattore di ulcera peptica, ma non è l‟unico; crea i
presupposti perché la malattia si inneschi, ma serve qualcos‟altro.
Helicobacter Pylori sembra infatti colonizzare zone già neoplastiche. Laddove Helicobacter Pylori è
eradicato i livelli di gastrite tornano normali.
Uno studio fatto in Asia ha dimostrato che pazienti con Helicobacter Pylori soprattutto con età inferiore
ai 30 anni presentano un rischio di cancerizzazione più elevato. Si è visto che nella parte distale dello
stomaco c‟è una maggiore associazione tra Helicobacter Pylori e cancro rispetto alle altre sedi.
Non si sa se la terapia antibiotica per eradicare Helicobacter Pylori prevenga lo sviluppo di cancro
servono i follow-up!
ULCERA PEPTICA CORRELATA A FANS
E‟ causata da inibizione della sintesi di prostaglandina (che hanno effetto protettivo) da parte dei FANS
e dà effetto tossico diretto.
SINDROME DI ZOLLINGER-ELLISON
Tumori endocrini prevalentemente a carico delle cellule G del pancreas generano un‟ipersecrezione
cloridopeptica per aumentati livelli di gastrina. Per la terapia si ricorre alla resezione chirurgica del
tumore.
DIAGNOSI DI ULCERA PEPTICA
1) Endoscopia;
2) Ricerca di infezioni da Helicobacter Pylori;
3) Radiografia con bario a doppio contrasto alternativa a endoscopia che però è preferita perché è più
accurata nel rilevare ulcere, consente la biopsia delle ulcere per escludere neoplasie maligne, consente
di verificare la presenza di infezioni da Helicobacter Pylori.
MALASSORBIMENTO
Il malassorbimento è dovuto a difetti della mucosa intestinale.
Può anche essere dovuto a ostruzione linfatica, affezioni cardiovascolari, deficit di sali biliari, farmaci.
Dal punto di vista clinico la sintomatologia varia a seconda che ci sia carenza di un singolo fattore (per
esempio una vitamina) o si più fattori con diarrea, steatorrea, gonfiore addominale, flatulenza, anemia,
emorragie, ipoprotidemia, edema, astenia, calo ponderale, eruzioni cutanee.
DIAGNOSI
Sintomi: grassi fecali, livelli ematici di elettroliti, grassi, zuccheri, vitamine e proteine. La procedura
diagnostica va completata con indagini per individuare la causa che ha determinato il malassorbimento.
La biopsia può consentire la diagnosi.
INTESTINO TENUE
Possiamo avere a questo livello, disordini digestivi e disordini di assorbimento.
DISORDINI DIGESTIVI: Deficit pancreatici e biliari, aumento della velocità di transito come nei
gastro-resecati.
DISORDINI DI ASSORBIMENTO: riduzione della capacità di assorbimento di alcune o della maggior
parte delle sostanze. Può essere dovuto a entità costitutiva di vere e proprie sindromi da
malassorbimento croniche o ad effetti collaterali di alcune condizioni cliniche o terapeutiche.
Tra le cause più importanti ci sono i difetti della mucosa intestinale.
Clinica: maggiore sintomatologia per carenza di un singolo fattore o pluricarenziale con diarrea,
steatorrea, gonfiore addominale, calo ponderale, anemia e astenia.
Diagnosi: livelli ematici di elettroliti, grassi, zuccheri, vitamine e proteine; oppure con capacità di
assorbimento intestinale che si misura valutando i grassi fecali.
MORBO CELIACO
Sindrome da malassorbimento scatenata dall‟assunzione di cibi che contengono glutine, proteina
presente nei cereali (grano, orzo, avena, segale). Si suppone che il glutine abbia azione tossica in
soggetti che mancano di un enzima digestivo (peptidasi). Altra ipotesi, è che il glutine, o meglio un suo
componente, cioè la gliadina, localizzandosi in prossimità dei villi, in alcuni pazienti scatena una
risposta immunitaria che distrugge le strutture deputate all‟assorbimento mediante anticorpi che
cross-reagiscono. Importanti sono i fattori genetici: ci sono aplotipi a rischio: HLA-DW3 e B8. Ci sono
anche fattori non genetici perché fra gemelli omozigoti spesso non c‟è concordanza.
L‟intolleranza al glutine può comparire a qualsiasi età, ma di solito compare allo svezzamento quando
già si iniziano ad ingerire cibi con glutine. Nei pazienti che non seguono una dieta priva di glutine i
sintomi sono diarrea, steatorrea, anemia, calo ponderale.
N.B. In alcuni pazienti può non esserci diarrea.
PATOGENESI:
Prima si pensava che fossero coinvolti anticorpi anti-gliadina. In realtà sono coinvolte IgA
anti-endomisio (membrana interposta fra le fibre muscolari responsabili di una reazione
antigene-anticorpo in grado di attivare il complemento.
Questi anticorpi potrebbero anche essere anticorpi anti-gliadina che cross-reagiscono con l‟endomisio
in quanto la gliadina ha omologia di sequenza con strutture self. Ancora non si è arrivati a una certezza,
ad ogni modo si assiste ad un‟attivazione del complemento che determina la liberazione di fattori
chemotattici in grado di richiamare CTL che aggrediscono gli enterociti: quando viene esposto al
glutine epitelio della mucosa viene invaso da linfociti T citotossici, mentre nella lamina propria si
accumulano linfociti T helper sensibilizzati alla gliadina; si ritiene che le citochine rilasciate dai
linfociti danneggino gli enterociti intestinali.
Alla distruzione degli enterociti si associano, invasione di linfociti e macrofagi nella lamina propria,
progressivo appiattimento dei villi, approfondimento delle cripte, attività iperproliferativa delle cripte,
che diventano iperplastiche e tortuose, cosicché lo spessore complessivo della mucosa rimane invariato.
DIAGNOSI:
Biopsia dell‟intestino tenue che dimostri l‟appiattimento dei villi e l‟infiltrazione linfocitaria nella
mucosa; misurazione di IgA anti-endomisio; miglioramento dei sintomi dopo dieta priva di glutine.
TERAPIA:
Dieta priva di glutine da seguire per tutta la vita altrimenti si corre il rischio di sviluppo di tumori
intestinali (linfomi e adenocarcinomi).
Nei casi più ostinati si usano cortisonici. Bastano sei mesi senza glutine e si riformano i villi, data la
grande capacità proliferativa della mucosa intestinale.
MORBO DI WHIPPLE
Malattia sistemica rara, causata dal batterio Tropherima Whipplei che è un‟Actinomiceto Gram
positivo il quale prolifera all‟interno dei macrofagi senza evocare significative reazioni immunitarie. La
caratteristica di questa malattia è l‟infarcimento della lamina propria della mucosa del tenue da parte di
macrofagi rigonfi, PAS positivi, in quanto contenenti lisosomi aventi mucopolisaccaridi di origine
batterica. Tali macrofagi alterano l‟attività della mucosa, ostacolando così la circolazione linfatica e
favorendo il deposito di lipidi nella parete intestinale (Whipple lipo-distrofico). I villi sono rigonfi.
I sintomi sono legati al malassorbimento intestinale pertanto si ha diarrea, steatorrea, ma anche sintomi
extra-intestinali; infatti i macrofagi PAS positivi possono stare anche nelle membrane sinoviali delle
articolazioni, nel cervello, nelle valvole cardiache, nella pelle, nei centri germinativi dei linfonodi.
Pertanto avremo, artropatia, disturbi psichiatrici, anomalie cardiache, linfoadenopatie,
iperpigmentazione. Si è visto che questi macrofagi hanno una ridotta espressione di CD11B, esprimono
IL-10 e mediano il rilascio di IL-16; inoltre pare che nei pazienti con morbo di Whipple vi sia una
carente produzione di IL-12, che porterà a un deficit funzionale dei macrofagi e dei T-helper 1 (quindi
ridotta risposta Th1 dipendente) che porterà allo sviluppo della malattia. I villi sono rigonfi.
A causa di questo interessamento dei macrofagi, quindi, la capacità del sistema immunitario cala; per
cui sono i macrofagi a dare danno!
C‟è una predisposizione genetica perché solo in individui predisposti si ha questa risposta immunitaria.
Per la diagnosi la PCR consente l‟amplificazione dell‟RNA ribosomiale per cercare il batterio, oppure
per la diagnosi si può fare una biopsia della mucosa o effettuare la colorazione con PAS.
INFLAMMATORY BOWEL DISEASE (IBD)
Malattie croniche accomunate dall‟infiammazione con cause e tipo di lesioni diverse. Non prevede una
remissione completa; è necessaria una terapia medica ad oltranza. Sono possibili fasi di quiescienza
alternate a fasi di riacutizzazione. Spesso si ha remissione in seguito a chirurgia.
Rettocolite ulcerosa: interessa solo lo stato superficiale; riguarda prevalentemente retto e colon.
Morbo di Crohn: c‟è una lesione trans-murale ovvero di tutta la parete che si può verificare a carico di
tutto l‟apparato digerente, ma soprattutto dell‟ileo.
MORBO DI CROHN
Flogosi cronica della mucosa, con granulomi e ulcerazioni a tutta la parete, i cui processi cicatriziali
portano a fibrosi, ipoelasticità e lesioni segmentarie a tratti.
Nel morbo di Crohn aumenta la suscettibilità a virus e batteri perché il sistema immunitario è
impegnato.
Il malassorbimento riguarda soprattutto i grassi per la perdita di sali biliari. Se il Crohn interessa il
colon le manifestazioni sistemiche sono più frequenti.
Complicanze del morbo di Crohn possono essere: fistole mesenteriche, enteroenteriche, enterovescicali
e retroperitoneali. Le manifestazioni extraintestinali riguardano le articolazioni, la pelle, gli occhi, la
bocca, nonché febbre.
RETTOCOLITE ULCEROSA
Formazione di ascessi in tutti gli strati, ma lesioni solo nella mucosa con comparsa di ulcere
superficiali. La lesione è continua, non ci sono tratti sani in mezzo.
Coinvolgimento colico continuo che inizia dal retto.
COSA HANNO DI DIVERSO IL MORBO DI CROHN E LA RETTOCOLITE ULCEROSA?
1) LOCALIZZAZIONE: Il morbo di Crohn è localizzato prevalentemente all‟ileo, ma anche ad altre
sedi; la rettocolite ulcerosa, nel colon retto in maniera continua (non ci sono SKIP AREAS);
2) TIPO DI LESIONE;
3) INCIDENZA: è in aumento progressivo per quanto riguarda il morbo di Crohn, mentre è stabile per
quanto riguarda la rettocolite ulcerosa.
4) PRESENZA DI MASSE ADDOMINALI PALPABILI: tipica del morbo di Crohn e non della
rettocolite ulcerosa.
5) COMPLICANZE COME FISTOLE E RESTRINGIMENTI: più tipiche del morbo di Crohn che
della rettocolite ulcerosa.
COSA HANNO IN COMUNE IL MORBO DI CROHN E LA RETTOCOLITE ULCEROSA?
1) EZIOLOGIA INCERTA: sicuramente dipendente da fattori ereditari;
2) PATOGENESI DI NATURA INFIAMMATORIA;
3) SINTOMI: il sintomo principale della rettocolite ulcerosa è il sanguinamento;
4) ETA‟ D‟INSORGENZA: prima dei 30 anni;
5) DIAGNOSI CON PRELIEVO BIOPTICO;
6) TERAPIE ANTINFIAMMATORIE: con aminosalicilati e corticosteroidi;
7) COMPLICANZE: evoluzione in patologie neoplastiche.
Crohn a livello dell‟intestino tenue: la parete appare ispessita;
Crohn a livello del colon e rettocolite ulcerosa: la parete appare sottile.
8) RISPOSTA ALLA CHIRURGIA: scarsa nel morbo di Crohn a livello dell‟intestino tenue, discreta
nel morbo di Crohn a livello del colon e buona nella rettocolite ulcerosa.
9) TIPO DI FLOGOSI: nel morbo di Crohn, granulomatosa e produttiva, mentre nella rettocolite,
essudativa/emorragica (nella rettocolite ulcerosa è possibile una risoluzione della flogosi);
10) MARKER UMORALI: Ig vs citoplasma neutrofilo (ANCA) si trovano nel 70% dei pazienti con
rettocolite ulcerosa; Ig vs saccaromiceti (in particolare verso antigeni della parete) si trovano in più del
50% dei pazienti affetti da morbo di Crohn.
Tuttavia questi marker non possono rappresentare da soli un criterio per formulare una diagnosi
differenziale.
11) DIAGNOSI: analisi anamnestica, segni e sintomi (esame clinico), esame radiologico; esame
endoscopico con prelievo bioptico; esame istologico; analisi di laboratorio.
La diagnosi differenziale è complessa specialmente nella localizzazione al colon e nelle fasi iniziali
della malattia.
12) SUSCETTIBILITA‟ GENETICA:
- In pazienti con morbo di Crohn si ha concordanza nei gemelli omozigoti del 30-50%; gli HLA a
rischio sono: HLA-B27 e HLA-DR1/DQW5, associato a una mutazione loss of function del gene
NOD2 (Nucleotide Binding Oligomerization Domain) espresso sui leucociti e varie cellule epiteliali e
funziona da recettore intracellulare per alcuni agenti. Potrebbe innescare l‟NF-KB Pathway implicato
nella produzione di citochine coinvolte nell‟immunità innata contro agenti patogeni.
- In pazienti con rettocolite ulcerosa invece, gli aplotipi a rischio sono: HLA-DR2.
RUOLO DELLA FLORA BATTERICA INTESTINALE
Non è ancora stato individuato un agente specifico per le IBD. Agenti infettivi potrebbero esacerbare
reazioni immuni contribuendo all‟attivazione dei linfociti T. Difetti della barriera intestinale
faciliterebbero l‟accesso della flora alla mucosa scatenando una risposta immune.
Sembra che l‟eccessiva risposta immune locale sia conseguente ad un‟esagerata attivazione delle
cellule T accompagnata da un deficit funzionale delle cellule T regolatorie.
In entrambe le malattie sarebbero implicate specificatamente le cellule T CD4+. Nonostante la presenza
di alcuni autoanticorpi non ne è stato mai dimostrato il ruolo patogenetico.
La malattia di Crohn sarebbe data da un meccanismo di Ipersensibilità ritardata (di tipo IV) indotta da
T Helper 1 producenti IFN .
Nella rettocolite ulcerosa sembra esserci un‟iperattivazione dei Thelper2, tuttavia nelle lesioni manca la
presenza di IL-4, pertanto si suppone che le lesioni siano conseguenti ad una atipica risposta T helper 2.
La flora batterica normalmente si localizza nel lume e non attraversa la barriera epiteliale. Se c‟è un
difetto nella barriera i batteri sono in grado di oltrepassarla a vanno in contatto con un APC.
Questo innesca una risposta immunitaria T (Th1 o Th2) in cui sono coinvolti i macrofagi che secernono
IL-12 e IL-18.
Alla fine è prodotto TNF che è tossico per gli enterociti. Il TNF sembra essere importante nella
patogenesi di entrambe le malattie.
Si è provato ad usare un anticorpo anti-TNF come farmaco.
MORBO DI CROHN
Th1
IFN
Attivazione dei macrofagi che producono IL-12 e IL-18 che stimolano i Th1 e IL-1, IL-6 e TNF che
sono citochine proinfiammatorie.
RETTOCOLITE ULCEROSA
Th2
TGF e IL-5
Nella rettocolite ulcerosa forse sono coinvolti sia Th1 che Th2 per questo risponde alla terapia
anti-TNF .
COFATTORI AMBIENTALI
1) ABUSO DI FANS E PREGRESSA APPENDICECTOMIA IN GIOVANE ETA‟: causerebbero
suscettibilità alle alterazioni della barriera intestinale.
2) TABAGISMO: Incrementa il rischio per morbo di Crohn, ma non si comporta allo stesso modo per
la rettocolite ulcerosa (forse ne diminuisce il rischio, per cui è protettivo).
3) FLORA BATTERICA INTESTINALE: modelli animali sperimentali hanno confermato il ruolo
centrale della flora batterica intestinale di IBD.
4) PAZIENTI CON IBD HANNO INCREMENTO DEL NUMERO DI BATTERI ADERENTI ALLA
SUPERFICIE DELL‟EPITELIO INTESTINALE: ciò suggerisce possibili anomali nell‟interazione tra
mucosa intestinale e flora batterica.
IPOTESI FISIO-PATOLOGICA PIU’ ACCREDITATA
Inappropriata e continua inattivazione del sistema immunitario indotta dalla normale flora batterica e
facilitata da deficit funzionali della barriera intestinale.
- Complicanze del morbo di Crohn: “segno della stringa”(ostruzione), fistole.
- Manifestazioni extraintestinali: nel morbo di Crohn sono: articolazioni, bocca, occhi, pelle e febbri
ricorrenti; nella rettocolite ulcerosa sono: articolazioni, pelle, occhi, ulcere buccali.
- Prognosi: Entrambe le patologie non prevedono una remissione completa, ma necessitano di terapia
ad oltranza.
In alcuni casi si ha remissione completa dopo resezione chirurgica; è possibile l‟alternarsi di fasi di
quiescienza.
- Farmaci: INFLIXIMAB funge da soppressore per la produzione di citochine, nonché agisce
riducendo l‟angiogenesi e l‟attivazione dei linfociti. E‟ più efficace nella rettocolite ulcerosa.
Oppure si usano altri anticorpi monoclonali contro le integrine, che sono però, ancora in fase di studio.
FISIOPATOLOGIA DEL FEGATO
Il fegato è l‟organo in cui si svolgono la maggior parte delle funzioni metaboliche dell‟organismo, dalla
sintesi delle proteine presenti nel sangue, alla sintesi di costituenti fosfolipoproteici delle membrane
cellulari, ed inoltre ha importanti funzioni di emuntorio.
Un‟alterazione epatica può, quindi, coinvolgere tutto l‟organismo e comportare altre patologie.
Nell‟ambito della patologia del fegato, si distinguono, pertanto, forme primarie, caratterizzate da
alterazioni iniziali a livello epatico, e forme secondarie caratterizzate da una patologia epatica, che
segue ad una patologia di un altro apparato (rene, cuore).
Le cause responsabili della patologia epatica possono essere di natura genetica, malformativa,
infiammatoria, immunologica, degenerativa, traumatica, vascolare e tumorale.
FUNZIONI DEL FEGATO:
1) PRODUZIONE DELLA BILE: La bile è un liquido viscoso secreto dagli epatociti, che lo versano
nei canalicoli biliari. La bile è costituita essenzialmente da:
- Colesterolo, che viene utilizzato per la maggior parte per la sintesi degli acidi biliari, di cui i principali
sono: acido colico, chenodeossicolico e desossicolico, i quali vengono coniugati con la glicina e con la
taurina, prima di essere escreti come sali biliari;
- Pigmenti biliari, rappresentanti dalla biliverdina e dalla bilirubina, derivati dal catabolismo dell‟anello
porfirinico dell‟emoglobina in seguito al distacco del ferro e della componente proteica. Per azione
dell‟eme-ossigenasi del sistema reticolo-endoteliale, l‟eme si trasforma in biliverdina, dalla quale per
opera della biliverdina-reduttasi, si forma la bilirubina.
La bilirubina liberata, è liposolubile, e viene veicolata in circolo coniugata all‟albumina; giunta nei
sinusoidi epatici, si stacca dall‟albumina e si lega ad una proteina specifica della membrana
dell‟epatocita, penetra nel citoplasma e si lega a proteine specifiche del citosol, definite ligandine.
Viene quindi coniugata ad opera dell‟enzima glucoronil-transferasi che la rendono idrosolubile e ne
permettono l‟escrezione nei canalicoli biliari.
Giunta nell‟intestino, la bilirubina, privata dell‟acido glicuronico, viene convertita in urobilinogeno
dalla flora batterica intestinale (tramite proteasi batteriche). Il 20% viene riassorbito dall‟ileo e dal
colon, e ritorna al fegato tramite la vena porta, e di qui di nuovo alla bile; il restante 80% viene escreto
con le feci (stercobilina), che assumono un colore biancastro quando è interrotto l‟afflusso di questo
pigmento (feci acoliche).
- Sali biliari: sono sali sodici degli acidi biliari, che derivano dagli acidi taurocolico, glicocolico, e
glicodeossicolico.
Ogni giorno la quantità di sali biliari che raggiunge l‟intestino, 2-5 grammi, viene riassorbita e ritorna
al fegato (circolo entero-epatico), a parte circa 300 mg che vengono eliminati con le feci.
Il riassorbimento si verifica in piccola parte per diffusione passiva nel digiuno e nel colon, e in gran
parte per trasporto attivo nella parte inferiore dell‟ileo. Esso riguarda gli acidi biliari descritti sopra
parzialmente coniugati, e una piccola parte di acido litocolico prodotto dalla flora batterica intestinale.
Attraverso la vena porta, veicolati dall‟albumina, questi tornano al fegato, si legano ai recettori degli
epatociti e penetrano nel citoplasma ove vengono nuovamente coniugati.
La quantità di acidi biliari escreta, è quindi molto piccola e, poiché da tale quantità dipende la sintesi di
nuovi acidi biliari, ne deriva che essa svolge un controllo sui livelli di colesterolo.
- Elettroliti: nella bile sono contenuti sodio, potassio, calcio, cloro e bicarbonato.
2) METABOLISMO PROTEICO: il fegato biosintetizza diverse proteine strutturali ed enzimatiche
proprie, ed esercita numerosi effetti sul catabolismo delle proteine, comprese quelle ormonali.
3) METABOLISMO GLICIDICO: gli epatociti trasformano, nella glicogenosintesi, i carboidrati che
non vengono immediatamente utilizzati in glicogeno, che è un polimero di glucosio.
Questo, per azione di fosfatasi, viene depolimerizzato a glucosio-6-fosfato idrogenasi e da qui si forma
glucosio.
Questo viene versato nel sangue, per tamponare il calo della glicemia, che si verifica a digiuno.
4) METABOLISMO DEI LIPIDI: il fegato riceve acidi grassi sotto forma di NEFA sia dall‟intestino,
dove vengono assorbiti, sia dai depositi adiposi da cui sono mobilizzati. Inoltre provvede alla
conversione in grassi, di proteine, carboidrati ed alla sintesi di colesterolo che è utilizzato per la
formazione degli acidi biliari.
Gli acidi grassi pervenuti al fegato, vengono esterificati con glicerolo, ed incorporati nelle lipoproteine
che sono adibite al trasporto degli acidi grassi.
Infine il fegato, attraverso la -ossidazione degli acidi grassi, forma anche i corpi chetonici.
Quindi, il fegato riceve i grassi e provvede al riciclaggio di essi.
5) FUNZIONI DI RISERVA: il fegato è un organo di riserva, di glicogeno, di vitamine (B12 e K) e di
metalli, quali ferro e rame.
6) FUNZIONE DETOSSIFICANTE: il fegato ha la capacità, come il rene, di eliminare sostanze non
utilizzabili dall‟organismo o tossiche sia di natura endogena, che di natura esogena; inoltre grazie alle
cellule di Kuppfer, rimuove elementi corpuscolati di varia natura.
La neutralizzazione dei composti tossici avviene con varie modalità, di cui le principali sono le reazioni
di metilazione, di demetilazione, di idrossilazione, di ossidazione, di riduzione, di coniugazione con
aminoacidi o con acidi.
Grazie alle reazioni di coniugazione, molti composti liposolubili vengono trasformati in idrosolubili
con conseguente passaggio di essi nel sangue, attraverso il quale raggiungono il rene, che provvede alla
loro escrezione.
PATOLOGIE PRIMITIVE DEL FEGATO
1) PATOLOGIA EREDITARIA:
Esistono diverse patologie ereditarie; si dividono in patologie che si manifestano fenotipicamente con
sintomi extraepatici, perché sono provocate dal deficit o dalla alterata sintesi di un prodotto epatico, e
versato in circolo, oppure in patologie che coinvolgono il fegato stesso.
Alla prima classe appartengono ad esempio: la analbuminemia o il deficit di -1 antitripsina.
Alla seconda classe appartengono i deficit enzimatici responsabili della sintesi o degradazione del
glicogeno (glicogenosi), della formazione dell‟urea, o deficit di proteine necessarie per il metabolismo
dei lipidi, delle proteine, o deficit di componenti essenziali per la coniugazione o escrezione della
bilirubina.
A proposito di quest‟ultimo esempio, in cui la proteina colpita è una glicuroniltransferasi, la bilirubina
non viene coniugata e quindi si ha un accumulo di bilirubina non coniugata nel sangue (ittero
preepatico). Si tratta degli ITTERI EREDITARI di cui si conoscono varie forme.
- SINDROME DI GLIBERT: trasmessa con modalità autosomica dominante; caratterizzata da una
lieve diminuzione dell‟enzima glucoroniltransferasi che comporta un aumento in circolo di bilirubina
non coniugata. I soggetti affetti, conducono una vita del tutto normale, a parte la lieve
iperbilirubinemia. Riguarda il 5-10% degli individui.
- SINDROME DI CRIGLER-NAJJAR: esiste in due forme (I e II): nella sua forma più grave è
caratterizzata da totale assenza dell‟enzima, con livelli elevatissimi di bilirubina non coniugata nel
sangue (>20 mg/dl), che causano la morte durante l‟infanzia, dopo aver dato luogo ad una sindrome
neurologica, provocata dall‟infiltrazione dei nuclei della base da parte della bilirubina libera che
oltrepassa la barriera emato-encefalica.
La forma meno grave (II) è maggiormente compatibile con la vita, essendo questa, dovuta a un deficit
non totale dell‟enzima glucoroniltransferasi.
Per la terapia, sia per la sindrome di Gilbert, che per Crigglet Najjar di tipo I i livelli di
bilirubinemia possono essere ridotti attraverso la somministrazione di barbiturici (fenobarbital), che
però è inefficace nella sindrome di Criggler Najjar di tipo II.
- SINDROME DI DUBIN-JOHNSON E SINDROME DI ROTOR: aumento di bilirubina coniugata,
che dall‟epatocita passa nel sangue; sindromi, entrambe, dovute ad un deficit nel trasporto della
bilirubina coniugata dall‟epatocita alla bile. Entrambe sono forme autosomiche recessive e si
distinguono perché nella prima si ha accumulo negli epatociti di pigmento scuro, correlato alla
melanina, che invece manca nella sindrome di Rotor.
E‟ ben conservata in entrambe la funzionalità del fegato.
2) PATOLOGIA MALFORMATIVA:
Si possono avere varie anomalie principalmente legate ai dotti biliari e ai vasi; ma anche un‟atresia
delle vie biliari intra ed extra-epatiche che impedisce l‟eliminazione della bile nell‟intestino con
conseguente alterazione degli epatociti e aumento della bilirubina coniugata nel plasma.
3) PATOLOGIA IMMUNITARIA:
I fenomeni auto-aggressivi che colpiscono il fegato possono essere sia anticorpo-mediati che
cellulo-mediati, e avere quindi per bersaglio costituenti propri degli epatociti, oppure antigeni virali
espressi dagli epatociti.
Poiché in ogni caso il fegato va incontro ad una reazione flogistica, le patologie sono rispettivamente
indicate come epatiti autoimmuni ed epatiti virali.
EPATITI AUTOIMMUNI:
Costituiscono una sindrome caratterizzata da un processo infiammatorio persistente del fegato con
frequente evoluzione cirrotica, associato alla presenza di autoanticorpi e ipergammaglobulinemia.
Varianti della sindrome sono considerati processi autoimmuni tari a carico delle vie biliari.
L‟eziologia resta sconosciuta, ma importanti fattori di rischio per l‟insorgenza della sindrome
sarebbero: uso prolungato di alcuni farmaci, pregresse infezioni da virus (epatotropi o non), un
particolare assetto genetico.
Sulla base della presenza di determinati autoanticorpi sono stati identificati quattro tipi di epatite
autoimmune:
1) Anticorpi anti-muscolo liscio e anti-nucleo;
2) Anticorpi anti-microsomi del fegato e anticorpi anti-microsomi del pancreas;
3) Anticorpi anti-antigeni solubili del fegato e del pancreas;
4) Criptogenetica o anche anticorpo-negativo perché i pazienti sono privi di anticorpi specifici pur
presentando sintomi tipici delle epatiti autoimmuni.
Un‟ipotesi patogenetica, ritiene che la sintesi di autoanticorpi è dovuta ad una disregolazione di
linfociti T soppressori a seguito della quale le plasmacellule, derivate da linfociti B sensibilizzati verso
antigeni epatici, sintetizzerebbero un eccesso di IgG specifiche per essi.
Queste immunoglobuline, interagendo con i rispettivi antigeni, formerebbero immunocomplessi su cui,
tramite i loro recettori per Fc, si fisserebbero le cellule NK determinando la citolisi.
EPATITI VIRALI:
Quasi tutti i virus sono potenzialmente in grado di dare danno a livello epatico, ma le epatiti virali di
più frequente riscontro sono quelle che riconoscono come agenti eziologici i virus epatotropi.
Se ne conoscono 6 tipi:
1) HAV E‟ un picornavurus, caratterizzato da un singolo filamento di RNA e capside isocaedrico.
E‟il virus più comune, ed è responsabile di circa il 25% di tutte le epatiti acute.
Viene trasmesso per via oro-fecale in seguito ad ingestione di acqua o cibi contaminati con feci (per
questo è endemico in paesi in via di sviluppo); In Italia la contaminazione avviene attraverso i frutti di
mare, principalmente molluschi che filtrano l„acqua, e possono così catturare particelle fecali, mentre
invece nel nord Europa la trasmissione avviene tramite ingestione di verdure crude lavate male.
La contaminazione per via ematica è molto rara; è per questo che il sangue di un donatore non viene
sottoposto a controlli per questo virus.
Ha un periodo di incubazione di 2-6 settimane.
Non cronicizza, e non c‟è “stato di portatore sano”.
Raramente è fulminante, anzi in genere il recupero è completo in breve tempo, ma restano solo IgG
specifiche che sono indice di una pregressa infezione.
ANALISI: si fanno analisi su sangue e feci; nelle feci si cerca con PCR la presenza del virus (a RNA),
nel sangue un elevato livello di transaminasi epatiche è un marcatore di sofferenza epatica. Si ricercano
anticorpi di classe IgG e IgM (prima si formano IgM, poi IgG che restano per sempre) perché le
transaminasi sono generiche, e quindi non possono essere impiegate come indice diagnostico di epatite
virale.
La maggior parte delle infezioni pediatriche (90%) sono asintomatiche, mentre le infezioni nell‟adulto
(25-50%) sono caratterizzate da febbre e ittero.
HAV non è eliminato nei liquidi biologici e non è citotossico per gli epatociti.
Sono disponibili vaccini, di cui i più utilizzati sono quelli in forma “inattiva”, ma esistono anche i
vaccini in forma “attenuata” (meno usati).
Nei vaccini inattivati sono inoculati antigeni che non possono provocare la malattia, mentre nei vaccini
attenuati si mima la situazione patologica di una forma blanda.
2) HBV E‟ un virus a doppia elica incompleta di DNA. Si trasmette per via parenterale (ematica,
sessuale o trans-placentare), ma anche tramite siringhe infette. Il virus si isola nel sangue, nella saliva e
nello sperma.
Ha un periodo di incubazione lungo, pari a 45-120 giorni.
Il virus non si sviluppa nelle colture tissutali e ciò ha limitato i progressi delle ricerche.
La sintomatologia è aspecifica. Non ha effetto citopatico diretto sugli epatociti, che vengono però
danneggiati dalla risposta immune dell‟ospite diretta verso peptidi virali presenti negli epatociti infetti.
I CD8+ sono attivati dagli antigeni virali e sono tossici per gli epatociti che albergano il virus. Alcuni
epatociti sfuggono ai CD8+ e integrano il DNA virale nel proprio genoma. L‟integrazione del DNA di
HBV può portare ad epatocarcinoma, senza passare per cirrosi.
ANTIGENI ASSOCIATI AD HBV:
- HbcAg (core);
- HbeAg (envelope);
- HbsAg (superficie).
ANTICORPI VERSO ANTIGENI ASSOCIATI AD HBV:
1) Anticorpi non neutralizzanti: anti-HbcAg e anti-HbeAg;
2) Anticorpi neutralizzanti: anti-HbsAg.
QUADRI CLINICI:
a) Manifestazione subclinica che guarisce rapidamente,
b) Forma acuta con risoluzione;
c) Forma acuta fulminante con necrosi epatica;
d) Portatore sano;
e) Forma cronica potenzialmente in grado di evolvere in cirrosi.
ASPETTI MORFOLOGICI DELLA FORMA ACUTA:
a) Fegato ingrandito, rossastro, verde se c‟è colestasi;
b) Danno epatocitario con rigonfiamento;
c) Necrosi epatocitaria;
d) Infiammazione prevalentemente mononucleare.
ASPETTI MORFOLOGICI DELLA FORMA CRONICA:
a) Infiammazione;
b) Necrosi;
c) Fibrosi.
3) HCV Costituisce la maggior parte delle epatiti non-A e non-B. Appartiene alla famiglia
flavivirus; Il genoma è costituito da un singolo filamento di RNA che codifica per una poliproteina da
cui originano per scissione le proteine virali che si dividono in:
STRUTTURALI:
- Core (C );
- E1, E2 (proteine di envelope);
Contengono epitopi di anticorpi; E2 è altamente variabile.
NON STRUTTURALI:
- NS1;
- NS3;
- NS4A;
- NS4B;
- NS5A;
- NS5B (RNA polimerasi RNA dipendente).
E‟ molto diffuso; Ha un periodo di incubazione di circa 2/26 settimane; Esistono diversi sottotipi di
HCV con sequenze aminoacidiche variabili (genotipi); questi sottotipi variano per distribuzione
geografica e hanno diversa virulenza.
Vengono diagnosticati circa 3-4 milioni di nuovi casi di HCV all‟anno; circa il 3% della popolazione è
cronicamente infetto ed è a rischio di sviluppare cirrosi e/o cancro (non per forza passando per cirrosi).
HCV può modificare il suo corredo antigenico all‟interno della persona infetta (in particolare è E2 a
mutare), per questo non esiste un vaccino.
Si cercano anticorpi anti-HCV nel sangue per la diagnosi.
La maggior parte dei casi di epatite C è subclinica anche in fase acuta (con aumentata tendenza a
cronicizzare), quindi è spesso scoperta dal casuale ritrovamento degli anticorpi anti-HCV in persone
apparentemente sane.
La viremia è molto alta perché ha una grande capacità replicativa. La cronicizzazione dell‟infezione
può essere previsto sulla base dell‟elevata viremia del paziente.
L‟intervallo fra la fase acuta e la cirrosi è di diversi anni; la cronicizzazione può essere prevista sulla
base dell‟elevata viremia del paziente.
Colpisce epatociti (oltre il 50%) e linfociti (tropismo linfocitario non produttivo che espone al linfoma
non-Hodgkin).
L‟infezione da HCV è responsabile del 50-76% di tutti i casi di tumore al fegato.
L‟RNA virale dell‟HCV è dosabile nel sangue in una finestra di tempo che va da 1 a 3 settimane (in
concomitanza con l‟aumento delle transaminasi).
La quantità di RNA libero nel plasma è minima.
L‟RNA può essere trovato anche con PCR, però solo nelle prime settimane, dopo No, dopo cominciano
a essere dosati gli anticorpi anti-HCV. Nella forma cronica persiste l‟RNA circolante e si elevano le
transaminasi.
- Esistono sei diversi genotipi HCV:
Tipo 1: Nord America ed Europa;
Tipo 2-3: Estremo Oriente;
Tipo 4: Africa e Medio Oriente,
Tipo 5: Sud Africa;
Tipo 6: Sud Est Asiatico.
Sono le caratteristiche genetiche delle popolazioni che rendono una popolazione più suscettibile a un
virus.
TERAPIA:
Ribavirina e IFN .
EPATOCARCINOMA
Raro tumore dei paesi Occidentali (<2% a esito fatale), il più delle volte correlato ad alcoolismo.
Non è chiara la correlazione fra HBV ed epatocarcinoma.
- La cirrosi può determinare danno epatico cronico, in grado di causare trasformazione neoplastica; vi
sono cofattori come: aflatossine e nitrosamine.
L‟IFN generalmente non è ben tollerato.
CIRROSI
La degenerazione grassa comporta accumulo di lipidi prima sotto forma di piccole goccioline, poi di
vacuoli sempre più grandi fino alla morte della cellula.
Questo processo si verifica in lento e progressivo tempo, quindi le cellule perdute non vanno sostituite
da nuove cellule, e quindi il connettivo infiltra e la struttura del lobulo scompare con gravi
modificazioni architettoniche quali: spostamento della vena centro-lobulare alla periferia o la sua
scomparsa; si formano cioè pseudolobi. Questo processo porta inevitabilmente alla perdita della
funzione epatica. Le cause di questa alterazione sono ipossiche, tossiche e infettive.
Tra le tossiche il più frequente è l‟alcool etilico.
Le alterazioni epatiche che portano a cirrosi alcolica sono rappresentate da degenerazione grassa degli
epatociti fino a rottura dei medesimi, formazione di cisti di grasso e sviluppo di tessuto fibroso in
vicinanza dei sinusoidi. La degenerazione grassa sarebbe di per sè reversibile, ma sono le alterazioni
seguenti a comportare l‟evoluzione verso la cirrosi.
PATOLOGIE SECONDARIE AD ALTRE MALATTIE
MALATTIA DI WILSON (sindrome epatodenticolare) :
Patologia ereditaria autosomica recessiva,che si manifesta con un difetto dell‟incorporazione del rame
nel apoceruloplasmina,dalla quale deriva la ceruloplasmina, proteina adibita al trasporto del rame.
Assorbito nel tenue, il rame si lega nel sangue all‟albumina, che lo trasporta al fegato dove viene
captato.
Il fegato incorpora il rame in proteine come la ceruloplasmina e l‟epatocupreina.
Queste due grandi proteine eliminano il rame dal fegato attraverso due vie:
1. trasportandone il 25% nel sangue
2. convogliando il restante 75% nella bile
La malattia di Wilson è dovuta alla mutazione di un gene mappato nel cromosoma 6; caratterizzata da
scarsa o assente capacità di legame del rame con l‟apoceruloplasmina e con l‟epatocupreina.
La conseguenza è che nel fegato si verifica un accumulo di questo metallo destinato ad aumentare
progressivamente in quanto l‟assorbimento intestinale non si riduce; inoltre la sintesi della
ceruloplasmina è costantemente deficitaria.
L‟alterazione del fegato evolve spesso in cirrosi,è caratterizzata dalla presenza di minute goccioline di
grasso, alterazione mitocondriali e vacuolizzazioni nucleari negli epatociti talora associate ad un
processo infiammatorio o addirittura di necrosi.
La malattia può coinvolgere anche il sistema nervoso con accumulo di rame nei nuclei della base che
provoca la comparsa di rigidità, tremori, discinesia.
Il reme elimina un eccesso di amminoacidi.
EMOSIDEROSI E EMOCROMATOSI :
L‟assorbimento del ferro dall‟intestino avviene con un processo di trasporto attivo, che viene bloccato
nel momento in cui la transferrina plasmatici è saturata dal ferro ad essa legato. Questo spiega perché in
condizioni fisiologiche l‟eccesso di ferro assunto con la dieta non passa nel sangue e viene eliminato
con le feci; l‟apporto alimentare medio quotidiano è di 10-20 mg dei quali solo il 10% viene assorbito.
Per quanto riguarda il metabolismo del ferro che :
1. il trasporto del ferro nel sangue è effettuato dalla transferrina
2. che la ferritina è un complesso ferro-proteico solubile intracellulare, in cui il metallo è presente
informa ferrica ( Fe 3+), questo è presente in molte cellule dell‟ organismo come epatociti,
splenociti, cellule del midollo osseo, cellule macrofagiche
3. che l‟emosiderina è una proteina insolubile che contiene circa il 37% di ferro in forma ferrica
(Fe 3+) che deriva dalla parziale digestione lisosomiale di aggregati di ferritina
4. che il ferro per essere mobilizzato dai depositi deve essere ridotto in forma ferrosa (Fe 2+)
Si conoscono due forme di accumulo di ferro nell‟organismo:
Emosiderosi in questo caso l‟accumulo del metallo è provocato da.
1. malattie emolitiche che provocano eccessiva liberazione dell‟emoglobina
2. da eccessiva introduzione del metallo per via parenterale conseguente a ripetute trasfusioni o a
prolungata terapia marziale
3. all‟impiego di farmaci che favoriscono l‟assorbimento ferro nonché all‟abuso di alcool
In queste condizioni, il ferro si accumula sotto forma di depositi di ferritina e di emosiderina a
livello epatico, prima nella cellule del Kuppfer e dopo negli epatociti determinando alterazioni di
bassa o media gravità.
Emocromatosi (patologia a trasmissione autosomica recessiva) il gene HFE è mappato sul
cromosoma 6 in prossimità del locus MHC ed è associato ai geni che codificano per gli antigeni
leucocitari HLA-A3 HLA-B8. Questo gene è fisiologicamente espresso soltanto nelle cellule delle
cripte duodenali nelle quali la proteina HFE, da esso codificata, si localizza sulla faccia basolaterale
(polo vascolare) di queste cellule dove interagisce con i recettori per la transferrina consentendo ad
essi di captare il ferro dalla transferrina plasmatica.
1 individuo su 300 presenta un allele di questo gene con mutazione dissenso che comporta
l‟inserzione di una tiroxina al posto di una cisterna nella proteina da esso codificata, che in
conseguenza di questo errore diventa funzionalmente inefficace. I soggetti omozigoti per questa
mutazione sono affetti dalla forma più grave di emocromatosi per il fatto che nelle loro cellule
duodenali risulta impossibilitata la captazione di ferro dalla transferrina con la conseguenza che la
deficienza di questo metallo nel citosol determina una iperproduzione delle proteine carrier DMT-1
e ferroportina che diventano responsabili rispettivamente di un incontrollato e continuo
assorbimento di ferro dal lume intestinale e di un continuo trasferimento di questo nel sangue
portale. Si verifica inoltre una ridotta disponibilità della proteina di deposito del metallo, la
ferritina.
Gli epatociti dei pazienti affetti da emocromatosi sono infarciti di emosiderina, che viene liberata
quando essi vanno incontro a morte depositandosi nel tessuto connettivo che proliferando prende il
posto da essi occupato.
Si sviluppa in tal modo una cirrosi micronodulare. Vengono coinvolti anche:
Pancreascon conseguente sviluppo di diabete mellito
Miocardio
Ghiandole Endocrine
Cuteiperproduzione di melanina che causa peculiare colorito
Articolazionifenomeni artritici
Il meccanismo patogenetico alla base di questa malattia consiste in un esagerato e persistente
assorbimento intestinale del metallo con la conseguenza che la quantità di ferro nell‟organismo può
arrivare da 2-5 g fino a 40g.
ITTERO : presenza di bilirubina in eccesso nel sangue (concentrazione superiore a 2-3 mg/dl ) che
dà una tipica colorazione giallastra delle sclere e della cute.
Gli itteri si suddividono in:
-I. PREEPATICI sono dovuti ad un aumento di bilirubina non coniugata nel sangue, che può essere
dovuto a cause extraepatiche; per esempio un‟eccessiva ed improvvisa distruzione di un elevato
numero di globuli rossi per cause emolitiche di vario tipo, tanto che vengono chiamati itteri emolitici.
La bilirubina non coniugata è liposolubile e quindi ha un‟alta affinità per le strutture lipidiche cellulari
alle quali tende a legarsi.
Le cellule più ricche di lipidi sono le cellule nervose che , quando la barriera ematoencefalica non
funziona o funziona poco (come nel neonato) ne fissano grandi quantità. Poiché la bilirubina è tossica
, le cellule nervose vanno incontro a gravi degenerazioni.
Nell‟ittero del neonato sono colpiti in particolare i nuclei della base (ittero nucleare) .
NB: Morbo di Gilbert causata da difetti ereditari della glucoroniltransferasi epatica che porta ad itteri
da aumentata concentrazione ematica della bilirubina libera che si associa spesso ad una scarsa
presenza di pigmenti nella bile.
-I. EPATICI sono quelli più strettamente legati alla patologia epatica. Essi sono caratterizzati da una
incompleta coniugazione della bilirubina dovuta a degenerazione e morte dell‟epatocita.
Nel sangue si eleva quindi sia la bilirubina non coniugata, sia quella parzialmente coniugata, sia quella
coniugata e liberata dalle cellule morte.
I livelli dipendono dall‟entità del danno cellulare.
-I. POSTEPATICImolte volte la causa non è intraepatica, ma è dovuta ad un ostacolo al deflusso
delle vie biliari, come per esempio un calcolo della cistifellea, che insinuandosi nel coledoco lo
occlude.
Lo stesso accade a causa di tumori della testa del pancreas, che comprimono le vie di deflusso della
bile o di tumori delle vie biliari. Allora la bilirubina coniugata si riversa nel sangue.
Talora l‟ostruzione delle vie biliari è intraepatica , come si osserva nella cirrosi. In questo caso nel
sangue è presente anche una parte di bilirubina non coniugata, liberata dalle cellule che sono andate
incontro a morte.
L‟eccesso di Sali biliari in circolo causa irritazione delle terminazioni nervose cutanee ed è
responsabile del prurito; la loro ridotta eliminazione a livello intestinale provoca steatorrea per
diminuito assorbimento di grassi e aumentato tempo di protrombina per ridotto assorbimento di
vitamina k.
ASCITE raccolta di liquido nella cavità peritoneale ( fino a molti litri) .
Il liquido ha le caratteristiche di un trasudato: contiene poche proteine,rare cellule
mesoteliali e linfociti , glucosio , sodio e altri ioni alla stessa concentrazione del plasma.
Le cause possono essere epatiche o extraepatiche:
-cause extraepatiche . Le più frequenti sono, uno stato di anasarca secondario a scompenso
circolatorio, a sindrome nefrosica ,a ipotiroidismo ; anche altre patologie addominali quali pancreatite
peritoniti e carcinomi diffusi possono causare raccolte di liquido con presenza di cellule caratteristiche
del processo patologico.
-cause epatiche . Sono le più frequenti.
L‟ 80% dei casi è rappresentato da ascite per occlusione delle vene epatiche
(SINDROME DI BUDD E CHIARI) in seguito a epatite cronica e soprattutto in seguito a cirrosi.
Fisiologicamente nella circolazione intraepatica il sangue dei rami dell‟arteria epatica e della vena
porta confluisce nei sinusoidi epatici; il sangue portale circola con un regime a bassa pressione mentre
il sangue dell‟arteria epatica circola ad alta pressione quindi un sistema di sfinteri ne regola la
circolazione con un meccanismo simile alla pompa epatica in quanto il passaggio nei sinusoidi di
sangue ad alta pressione favorisce l‟afflusso di quello a bassa pressione.
Alla base dell„ ascite non c‟è semplicemente un ostacolo alla circolazione intraepatica portale dovuta
ad alterazione dell‟architettura epatica, ma un‟alterazione emodinamica dovuta alla mancata efficienza
degli sfinteri.
L‟aumento della pressione idrostatica venosa favorisce il passaggio di liquido nell‟interstizio e da qui
nella cavità addominale, fenomeno favorito anche dalla diminuzione della pressione colloido-osmotica
causata da diminuita sintesi epatica delle proteine plasmatiche, in particolare l‟albumina.
Il liquido che dal circolo passa nella cavità peritoneale viene escluso dalla circolazione generale e
quindi provoca da una parte diminuzione della perfusione renale con liberazione di renina e secrezione
di aldosterone che favorisce il riassorbimento di sodio e acqua, e dall‟altra per stimolazione dei
volocettori una secrezione di ormone antidiuretico , che favorisce il riassorbimento di acqua.
Ciò comporta un aumento dei livelli pressori e quindi un aumento dell‟ascite.
La difficoltà della circolazione intraepatica provoca sviluppo di circoli collaterali tra sistema portale e
sistema venoso sistemico, i più importanti sono:
1-tra vena porta e vena azygos (parte inferiore dell‟esofago)
2- tra mesenterica inferiore e cava tramite il plesso emorroidario a livello rettale
3-se la vena ombelicale è rimasta pervia si può sviluppare una comunicazione con le vene sistemiche
che porta allo sviluppo di un plesso periombelicale (detto caput medusae)
A causa della pressione elevata in questi circoli collaterali si verificano facilmente emorragie
soprattutto a livello periesofageo.
INSUFFICENZA EPATICA
Quadro che si osserva solo quando il parenchima funzionante è ridotto al 15-20% del totale ( il 50% è
sufficiente ad assicurarne totalmente la funzione) .
L‟insufficenza epatica può essere acuta causata da alterazioni degenerative o da necrosi di molte cellule
epatiche:
a)degenerazione grassa acuta (gravidanza)
b)degenerazione vacuolare in caso di influenza o varicella (sindrome di Reye‟s)
c)alterazioni degenerative causate da somministrazione di farmaci (tetracicline)
d)assunzione di tossici (tetracloruro di carbonio e alcuni anestetici)
e)epatite acuta fulminante nella quale compare una massiva necrosi del fegato causata da precipitazione
intravasale di immunocomplessi che portano a trombizzazione dei sinusoidi.
In tutti questi casi, la comparsa dell‟insufficenza epatica acuta è preceduta da grave anoressia , vomito
, da ittero progressivamente ingranescente,da alterazioni neuropsichiatriche e inversione del ritmo
sonno – veglia.
L‟insufficenza conclamata che culmina con una encefalopatia seguita da coma è caratterizzata da una
grave coagulopatia per ridotta sintesi epatica dei fattori della coagulazione e da ritenzione indrosalina.
Come terapia trapianto di fegato di emergenza
Più spesso l‟insufficenza epatica è dovuta a una patologia cronica del fegato :
cirrosi
epatiti croniche
alterazioni vascolari
L‟insufficenza epatica causa quasi sempre la comparsa di ittero (aumento della bilirubina coniugata e
non coniugata) e di ascite che però è presente solo nei pazienti in cui si verifica un‟alterazione del
circolo portale e ha sintomatologia pleomorfa:
App. Respiratorioalito con odore caratteristico di mele marce dovuto ai mercaptani formati per
azione dei batteri intestinali da aminoacidi contenenti gruppi tiolici .
Quando è presente acidosi si osserva iperventilazione
App. Gastroentericofrequenti anoressia e nausea , possono essere presenti varici esofagee il cui
sanguinamento può causare ematemesi, anche le emorroidi possono ulcerarsi e sanguinare.
App. Cutaneo nevi vascolari simili a ragni, eritema palmare , compare un prurito insistente causato
dall‟alto livello di Sali biliari in circolo, il colorito può essere bronzaceo nell‟emocromatosi, o color
fango negli individui affetti da colestasi cronica
App. Endocrinonell‟uomo atrofia delle gonadi e aumento del livello di estrogeni per ridotto
catabolismo da parte del fegato, ciò causa ginecomastia, nella donna amenorrea. Aumentano i livelli di
insulina per ridotto catabolismo, aumenta anche il glucagone per incrementata produzione.
Sanguefrequente anemia dovuta a :
-aumentata perdita di globuli rossi per frequenti emorragie e per deficit di acido folico
-per diminuita formazione da parte del midollo osseo
-leucopenia
- piastrinopenia
NB:piastrinopenia associata a ridotta sintesi dei fattori della coagulazione causa difficoltà nell‟arresto
delle emorragie
App. Circolatoriofrequente ipotensione, tachicardia e aumento della gittata cardiaca; a causa dei
numerosi circoli collaterali che si formano il sangue può giungere in periferia già privo di ossigeno e
quindi causare ipossia periferica. Inoltre si può verificare ipovolemia in presenza di ascite quando gran
parte di liquido viene sottratta al circolo e si riversa nella cavità peritoneale.
Ricambio idroelettricoIn caso di ascite si ha aumentata secrezione di aldosterone che provoca
riassorbimento di sodio e conseguente escrezione di potassio con aumento della ritenzione idrica.
App. Renaleè frequente che l‟insufficenza epatica si associ ad un quadro di insufficienza renale acuta
che costituisce la SINDROME EPATORENALE:
sindrome di natura funzionale causata da ipoperfusione renale associata ad estesa vasocostrizione dei
piccoli vasi; i pazienti esibiscono grave oliguria con ridotta escrezione di sodio, ipotensione arteriosa,
tachicardia, incremento progressivo della creatinemia, l‟ azotemia generalmente bassa per ridotta
formazione di urea da parte del fegato si innalza.L‟ipertensione venosa nel distretto portale causa
sequestro di un importante quantità di sangue nell‟area splancnica che comporta un ridotto ritorno
venoso nel cuore con conseguente riduzione del volume di sangue circolante.
La ridotta portata innesca un meccanismo omeostatico che tende a ripristinare la condizione ottimale di
circolo attraverso stimolazione simpatica , l‟attivazione del sistema renina angiotensina aldosterone che
provocano vasocostrizione renale e ritenzione idrosalina. A questi meccanismi fisiopatologici si
aggiungono fattori esogeni come ad esempio eccessiva produzione di endotossine causata da
moltiplicazione dei germi della flora batterica intestinale che nei cirrotici eseguono un percorso
ascendente fino a impiantarsi nel duodeno e fattori endogeni (attivazione delle citochine, liberazione di
fattori vasoattivi da parte delle piastrine).
Sist. Nervosoalterazioni di carattere neurologico (tremori ,aprassia costruttiva ,iperriflessia e
positività al segno di Babinsky, talvolta anche convulsioni) e di carattere psichico (disturbi della
coscienza, sonnolenza, stato confusionale che può culminare nel coma).E‟ possibile osservare
iperplasia degli astrociti e necrosi neuronale.
Si pensa che molte sostanze agiscano insieme per produrre queste alterazioni ad esempio tossine
microbiche che causano alterazione della permeabilità della barriera ematoencefalica con conseguente
accesso nell‟encefalo di sostanze tossiche che in condizioni fisiologiche non oltrepasserebbero la
barriera (ES;amine fenoliche prodotte dall‟intestino e normalmente metabolizzate dal fegato ma che in
seguito a danno epatico non vengono metabolizzate raggiungendo il sist. nervoso centrale e funzionano
da falsi trasmettitori, poi octopamina sintetizzata da germi della flora intestinale che non viene
eliminata dal fegato, e ancora i mercaptani )
Anche il GABA , prodotto in eccesso dai germi della flora intestinale ,sembra coinvolto perché
capace di inibire neurotrasmissione.
APPARATO RESPIRATORIO
Lo scambio di gas fra l‟atmosfera e il sangue è diviso in due fasi:
1-Ventilazione: ricambio di aria dall‟atmosfera agli alveoli
2-Diffusione: dagli alveoli ai capillari.
L‟insieme di queste due fasi è definito VENTILAZIONE POLMONARE PROPRIAMENTE DETTA.
Alterazioni della ventilazione polmonare
Iperventilazione: consiste in un aumento degli scambi fra aria atmosferica ed aria alveolare, e può
dipendere da un aumento della frequenza e/o dell‟ampiezza degli atti respiratori. Può essere
conseguenza di un atto volontario (prima di un‟immersione in apnea) o involontario (ipossiemia o
altitudine).
La conseguenza più immediata dell‟iperventilazione è l‟aumento della pressione parziale di ossigeno e
il calo della pressione parziale di anidride carbonica, in seguito al quale aumenta il gradiente pressorio
dell‟anidride carbonica attraverso la membrana alveolo-capillare e quindi aumenta la velocità di
eliminazione di anidride carbonica. (Aumento del pH sanguigno cioè alcalosi respiratoria!!!)
Ipoventilazione: consiste nella diminuzione degli scambi gassosi fra atmosfera ed aria alveolare.Può
essere conseguente a un impedimento dei movimenti della gabbia toracica, a lesioni di muscoli, nervi o
ossa impegnate nella respirazione, oppure ad ostruzione del flusso di aria attraverso le vie
respiratorie.Comporta l‟aumento della pressione parziale di anidride carbonica e la diminuzione della
pressione parziale di ossigeno con conseguente riduzione dei rispettivi gradienti di diffusione attraverso
la membrana alveolare e degli scambi gassosi nell‟alveolo.
Avremo quindi Ipossiemia e Ipercapnia (in seguito a quest‟ultima si abbassa il pH sanguigno!!!)
Alterazioni della membrana alveolo-capillare
Aumento dello spessore
La velocità di diffusione dei gas attraverso la membrana alveolocapillare è funzione del suo spessore.
Ogni aumento di quest‟ultimo determina quindi alterazioni della diffusione dei gas.
Gli effetti dell‟aumento di spessore (anche minimi)si ripercuotono però soprattutto sulla PO2, che cala
in maniera drammatica, in quanto l‟O2 ha una diffusibilità di circa 20 volte inferiore rispetto a CO2.
L‟ispessimento della membrana alveolocapillare si può verificare in conseguenza dell‟accumulo di
liquido nel suo spessore(edema), della sclerosi del parenchima polmonare dovuta ad esempio a processi
infiammatori cronici,all‟uso di alcuni farmaci antitumorali,all‟esposizione a radiazioni ionizzanti,alla
deposizione di materiali proteici nella malattia delle membrane ialine.
Riduzione della superficie
La maggior parte delle malattie che causano riduzione della superficie della membrana alveolocapillare
comportano anche alterazioni della ventilazione e della perfusione ematica,per cui si ha anche un
aumento dello Spazio Morto(cioè il volume di ventilazione non utilizzato) e dello Shunt Totale(cioè la
quantità di sangue venoso che riesce a passare attraverso il polmone senza essere
ossigenato).Es.enfisema polmonare,Infarto del polmone,Compressione del parenchima da parte di
versamenti pleurici,pericardici o da parte di tumori mediastinici.,Erosione del parenchima da tumori
primitivi o metastatici.
Alterazioni della perfusione alveolare????
N.B.Normalmente questi tre meccanismi patologici si trovano associati,causando insufficienza
respiratoria ipossica(vedi oltre)
Alterazioni del trasporto ematico dei gas respiratori
Ricorda:mentre O2 è trasportato solo da Hb contenuta negli eritrociti,la CO2 è trasportata,sotto forma
di bicarbonato,dalle proteine del sangue(fra cui anche Hb).Per questo motivo la capacità del sangue di
trasportare O2 dal polmone ai tessuti è di gran lunga inferiore alla capacità dello stesso di trasportare
CO2 dai tessuti al polmone!Quindi i deficit della capacità del sangue di trasportare gas respiratori si
traducono esclusivamente nella ridotta capacità di trasportare O2
Deficit del trasporto di O2 da alterazioni della perfusione polmonare
Si verificano in caso di eccessiva velocità della circolazione sanguigna nei capillari,per cui si ha un
difetto di ossigenazione del sangue anche in caso di normale ventilazione degli alveoli,o in caso di
insufficienze circolatorie cioè quando,a causa della diminuita gittata cardiaca c‟è una diminuzione
globale della perfusione polmonare e quindi della quantità di ossigeno assunto e trasportato ai tessuti.
Deficit del trasporto di ossigeno da alterazioni ematologiche
Nelle Anemie la diminuzione del contenuto di Hb nel sangue comporta una proporzionale diminuzione
della capacità di trasportare O2.Inoltre l‟accelerazione della frequenza cardiaca,caratteristica delle
anemie gravi,aumenta la velocità di circolazione del sangue,pertanto accorcia il tempo di permanenza
degli eritrociti nei capillari polmonari,compromettendo il raggiungimento della competa saturazione
dell‟Hb.
Nelle Emoglobinopatie la presenza di HbC o HbF,aventi affinità per l‟O2 maggiore del corrispettivo
normale(HbA),quindi meno desaturabili,determina un minore rilascio di ossigeno ai tessuti.
Anche alterazioni chimiche sono in grado di produrre difetti nel trasporto di O2:
- l‟ossidazione del Fe2+ ,appartenente al gruppo eme, in Fe3+ (metaemoglobina) rende l‟Hb incapace
di trasportare l‟ossigeno.
N.B. La metaemoglobina si forma normalmente nel torrente circolatorio ma la sua concentrazione non
supera l‟1%. In caso di difetti genetici dei sistemi riducenti intraeritrocitari e in caso di ingestione di
sostanze ossidanti(nitriti,sulfamidici) si verifica un eccesso di metaHb con conseguente cianosi e
difetto di trasporto di O2.
-Il legame di CO all‟Hb (carbossiemoglobina), poiché questo composto ha un‟elevatissima affinità per
l‟Hb,legando quest‟ultima non le permette di legare l‟ossigeno.Avvelenamento da CO!
INSUFFICIENZA RESPIRATORIA
Classificazione
Sindrome Ipodiffusoria: in cui l‟insufficienza respiratoria è dovuta prevalentemente a patologie che
alterano lo spessore della membrana alveolocapillare.
Sindrome da squilibrio ventilazione/perfusione,causata da alterazione della perfusione da parte del
sangue capillare.
Sindrome Ostruttiva dovuta a patologie che riducono la ventilazione determinando un‟ostruzione al
flusso aereo nelle vie respiratorie.
Sindrome Restrittiva dovuta a patologie che riducono la ventilazione riducendo la distensibilità del
parenchima polmonare o l‟espansibilità della cassa toracica.
N.B. Si può parlare di Insufficienza Respiratoria solo quando il valore della PO2 scende al di sotto di
50-60 mmHg,determinato a riposo.
L‟insufficienza Respiratoria viene distinta in:
- Acuta il cui quadro clinico è dominatola un brusco calo di PO2 arteriosa ed eventualmente dalla
mancata eliminazione di CO2 (acidosi).
- Cronica
Possono essere presenti tutti gli effetti fisiopatologici dell‟adattamento all‟ipossiemia e all‟acidosi
(emodinamici ed ematologici).
Si distinguono inoltre:
-Insufficienza respiratoria Ipossica,caratterizzata esclusivamente da ipossiemia,dovuta ad alterazioni
degli scambi gassosi a livello della membrana alveolocapillare
N.B. Solitamente sono presenti tutti e tre i tipi di alterazioni della membrana alveolocapillare!
E‟ considerata insufficienza respiratoria ipossica la condizione in cui la PO2 scende sotto i 60
mmHg(quando quindi la saturazione di Hb è inferiore all‟80%);
PCO2 in questo caso è normale o addirittura diminuita!.
-Insufficienza respiratoria Ipercapnico-Ipossica,di tipo ipoventilatorio, nella quale all‟ipossiemia si
associa a significativa ipercapnia (CO2>25-44 mmHg), dovuta a disturbi della ventilazione.
Si tratta di una condizione in cui al polmone non è possibile eliminare in modo adeguato la CO2 per
una riduzione del gradiente di quest‟ultima,cioè da un difetto del ricambio dell‟aria
alveolare(ipoventilazione).
Le cause possono essere esterne ( poliomielite, traumi cranici, tumori cerebrali, miastenia gravis,
lesioni spinali, fratture costali, obesità) oppure interne al polmone(fibrosi diffuse, pneumoconiosi,
patologie bronchiali).
Effetti sistemici dell’insufficienza respiratoria
Oltre alla riduzione della PO2 ed all‟eventuale aumento della PCO2 nel sangue arterioso (EFFETTI
PRIMARI), l‟insufficienza respiratoria può avere anche effetti sul funzionamento di tessuti ed
organi(EFFETTI SECONDARI).
Effetti dell‟ipossia sui tessuti
-Sulle Cellule: L‟ipossia acuta induce la modificazione di proteine preesistenti;L‟ipossia cronica induce
la modificazione dell‟espressione genica.
Se gli adattamenti respiratori all‟ipossia falliscono all‟ipossia grave segue la ridotta sintesi di ATP e
quindi il difetto di tutte le funzioni che utilizzano questo composto(pompe,sintesi eme,metabolismo
aa);inoltre la mancata ossidazione di NADH e FADH2 rallenta tutte le vie metaboliche ,generando
invece metaboliti che si riversano nel sangue provocando acidosi(acido lattico,acetone,acido acetico)
-Sul SNC: l‟ipossia causa inizialmente una depressione dell‟attività mentale,e in seguito una sindrome
simile all‟etilismo acuto con disturbi della coordinazione motoria,confusione mentale,sonnolenza,che
nei casi più gravi possono culminare in coma e morte.
-Sul Sistema Circolatorio:l‟ipossia causa inizialmente una vasodilatazione compensatoria(atta a
migliorare la per fusione dei tessuti).Tutte le volte in cui però l‟iperventilazione compensatoria genera
ipocapnia la vasodilatazione viene annullata,in quanto l‟ipocapnia ha effetto vasocostrittivo.L‟ipossia
inoltre genera una vasocostrizione delle arteriole polmonari che,da una parte aumenta la quota di
sangue ossigenato,ma dall‟altra aggrava il lavoro del ventricolo destro.
-Sulla Crasi Ematica:l‟ipossia tissutale nell‟insufficienza respiratoria stimola la produzione di
eritropoietina che incrementa la produzione di eritrociti.Tuttavia l‟aumento del numero di eritrociti non
è in grado di ridurre l‟ipossia e quindi l‟iperproduzione di eritropoietina continua.Il conseguente
aumento dell‟ematocrito comporta un aumento della viscosità del sangue che rende ancora più oneroso
il lavoro del ventricolo destro.
-Cianosi: è il colorito bluastro della cute e delle mucose visibili,causato adlla eccessiva concentrazione
di Hb non ossigenata nel sangue capillare.
N.B. La cianosi non è un segno esclusivo di insufficienza respiratoria in quanto può essere conseguente
a varie situazioni(sforzo fisico,iperemia passiva,difetti cardiaci con shunt destro-sinistro).
- Sull‟apparato muscolare:L‟apparato muscolare,e quindi la muscolatura respiratoria è indebolita sia a
causa del diminuito apporto di O2 che della depressione del SNC.
L‟indebolimento della muscolatura respiratoria implica un ulteriore aggravamento dell‟insufficienza
respiratoria,per difetto di ventilazione,innescando un circolo vizioso.
L‟apparato respiratorio contribuisce a mantenere l‟omeostasi in quanto fornisce Ossigeno ,espelle
anidride carbonica,consente l‟uso di sostanze nutritive.
Effetti generali dell‟ipercapnia
-Sul SNC l‟ipercapnia si manifesta principalmente in seguito a forme di insufficienza respiratoria da
riduzione della ventilazione(asma,enfisema cronico ostruttivo) e rappresenta quindi uno stimolo alla
ventilazione.Se la ventilazione non può essere accresciuta o se il suo incremento non è sufficiente a
consentire l‟eliminazione di CO2, gli alti livelli di CO2 porteranno DISPNEA cioè sensazione
soggettiva di difficoltà respiratoria.(La morte sopraggiunge quando CO2 >100mmHg)
-Sull‟equilibrio Acido-Base:L‟aumento di PCO2 comporta una maggiore formazione di acido
carbonico che si dissocia in protoni e ioni bicarbonato.I protoni vengono in parte tamponati dai tamponi
plasmatici ed extravascolari;il rene inoltre aumenta il riassorbimento di bicarbonato e l‟eliminazione di
acidi fissi(acido lattico,fosforico..)
Se i meccanismi di compenso non sono capaci di tamponare l‟aumento della concentrazione di H+ ,si
assiste ,insieme all‟ipercapnia,a un calo del pH,accompagnato da un aumento della concentrazione di
HCO3- (acidosi respiratoria).
Effetti generali dell‟ipocapnia sui tessuti
In tutte le condizioni di insufficienza respiratoria di tipo ipossico con iperventilazione
compensatoria,l‟ipocapnia si accompagna ad alcalosi respiratoria.In queste condizioni il calcio
ionizzato plasmatici viene legato con maggior efficienza dalle proteine,ed in conseguenza di questo
l‟eccitabilità neuromuscolare aumenta fino a provocare parestesie e spasmi muscolari.
Durante la vita fetale il polmone è pieno di un liquido che alla nascita ,durante i primi atti respiratori
,viene sostituito progressivamente con aria al combinarsi di due eventi:
-pressione endopleurica negativa
-produzione di “surfactante” cioè una mistura di fosfolipidi e lipoproteine che abbassano la tensione
superficiale dei liquidi che bagnano gli alveoli->in questo modo è facilitata l‟espansione polmonare.
N.B. Se il surfactante non è adeguato il feto può morire.
Il lavoro svolto dalla ventilazione polmonare deve superare:
-la resistenza opposta dalla retrazione toracica e polmonare
-la resistenza di attrito al passaggio dell‟aria
-la resistenza data dalla viscosità del polmone e della gabbia toracica.
La diffusione è invece influenzata da:
-ventilazione alveolare
-perfusione alveolare(cioè il continuo apporto di sangue venoso ai capillari polmonari)
-rapporto fra ventilazione/perfusione
-integrità della membrana respiratoria.
PATOLOGIA DELLA VENTILAZIONE
Lo stato patologico della ventilazione può far seguito a due modalità:
1-alterazione della frequenza o del ritmo ventilatorio;
2-aumento del lavoro della ventilazione che può essere dovuto a:
-DISORDINI RESTRITTIVI,cioè il polmone non riesce ad espandersi in maniera adeguata a causa di
irregolarità di dimensione,forma o espansibilità della gabbia toracica; variazioni della pressione
intratoracica; degenerazione fibrosa del parenchima polmonare (può essere idiopatica o evoluzone di
altre patologie) con conseguente ridotta espansione del parenchima polmonare ,quindi diminuzione
della TLC (Total Ling Capacity).
-DISORDINI OSTRUTTIVI,in cui c‟è una maggiore resistenza al flusso aereo per parziale ostruzione
bronchiolare; è quindi richiesto lavoro maggiore per avere lo stesso passaggio di aria.Il prolungarsi nel
tempo di un flusso aereo non efficace può causare una situazione di Disagio Cronico che può evolvere
in un quadro fibrotico(ridotta elasticità del polmone che ha quindi una diminuita capacità di
espandersi).Possono essere dovuti a bronchite ;enfisema polmonare;asma bronchiale;varie patologie
come fibrosi cistica,bronchioclasie,tumori.
Alterazioni della frequenza e del ritmo respiratorio possono essere dovute a patologie di natura
NEUROLOGICA:
-Edema Cerebrale (post-traumatico)e Tumori Cerebrali che generano compressione sui centri regolatori
bulbo-pontini,andando a disattivare il centro respiratorio
-Poliomelite a carico di neuroni che innervano i muscoli respiratori
-Sovradosaggio di anestetici e narcotici può ridurre,attraverso il bulbo l‟attività respiratoria
-Alcune sostanze al contrario possono iperstimolare l‟attività respiratoria,ad esempio la Caffeina(che
agisce direttamente sui centri di regolazione) o gli ormoni tiroidei e le catecolammine(che agiscono
indirettamente aumentando il metabolismo cellulare).
DISORDINI POLMONARI RESTRITTIVI
1)Alterazioni della GABBIA TORACICA :
-Deformazioni STRUTTURALI(cifosi,scoliosi che possono essere dovute ad osteoporosi)
-Deformazioni TRAUMATICHE(fratture costali:se le fratture scomposte protrudono all‟interno,ad
ogni atto respiratorio si avrà un danno).
Entrambi i tipi di deformazione comportano un aumento di lavoro per assicurare un‟adeguata
ventilazione polmonare.
2)VARIAZIONI DELLA PRESSIONE INTRATORACICA:
A-Accumulo di liquido:Lo spazio virtuale interposto tra pleura parietale e pleura viscerale,contiene un
liquido che permette di ridurre lo sfregamento tra i polmoni e la parete della gabbia toracica.
L‟accumulo di liquido nello spazio pleurico comprime il parenchima polmonare e ne causa una ricorra
distensione.
Questo si può verificare in seguito a :
-fenomeni infiammatori a carico delle pleure con formazione di essudato;
-aumento della pressione sanguigna nel circolo polmonare con formazione di trasudato
B-Passaggio di aria:Il passaggio di aria nella cavità pleurica riduce la distensione del parenchima
polmonare(può comportare il collasso di un intero polmone =ATELETTASIA POLMONARE).Questo
si verifica in caso di pneumotorace
N.B. L‟aria può provenire sia dall‟esterno che dal polmone!.
3)DEGENERAZIONE FIBROSA DEL TESSUTO POLMONARE
Può essere idiopatica o secondaria a malattie infettive,risposte infiammatorie croniche,.disordini
ostruttivi. Causa una minore elasticità del tessuto polmonare obbligando quindi il polmone a lavorare
con minore efficacia e maggior dispendio di energia.
La fibrosi polmonare è anche detta Alveolite Sclerosomite Criptogenetica.
L‟ipotesi patogenetica più accreditata per questa patologia è la seguente:
-Vari stimoli (fumo di sigaretta,tossine,smascheramento di antigeni)concorrono ad accumulare cellule
infiammatorie negli spazi alveolari(ALVEOLITE)
-I linfociti B (tramite la formazione di immunocomplessi) e i linfociti T(tramite la produzione di
citochine)provvedono ad attivare i macrofagi.
-I macrofagi attivati producono ROS e richiamano neutrofili causando danno agli pneumociti di tipo
1; inoltre producono, insieme ai linfociti T citochine fibrogeniche che richiamano i fibroblasti
-Si configura quindi una fibroplasìa.
Terapia: per scongiurare la fibrosi si può agire sulle citochine che attivano i fibroblasti.
Oltre che esser idiopatica la fibrosi può essere dovuta a Malattie Infettive :
microrganismi invadono il tessuto polmonare e possono danneggiare sia la ventilazione alveolare che la
diffusione.Per poter infettare i polmoni i microrganismi devono superare vari meccanismi di difesa(peli
e turbinati nasali,muco e movimento muco-ciliare,macrofagi alveolari,tosse).Le più frequenti sono :
-Polmoniti:possono essere batteriche,virali o fungine;la formazione di essudato nel sito di infezione
comporta riduzione(?)degli scambi gassosi.L‟evoluzione oltre che nella guarigione completa può
evolvere in cicatrizzazione del focolaio infiammatorio o morte del tessuto polmonare.In genere
vengono somministrati antibiotici perché sebbene la polmonite sia virale può esserci concomitanza con
infezioni batteriche
-Tubercolosi
Le risposte infiammatorie che causano la produzione di tessuto fibroso sono .spesso secondarie a
pneumoconiosi ovvero all‟inalazione di agenti irritanti che non possono essere eliminati dai
macrofagi;a seconda dell‟agente irritante avremo asbestosi,silicosi….
DISORDINI POLMONARI OSTRUTTIVI
1)BRONCHITE ACUTA
Condizione in cui alcune alterazioni ventilatorie sono responsabili di modificazioni infiammatorie
essudative della parete bronchiale:
-iperemia passiva ed edema
-PMN infiltrati
-spasmo della muscolatura liscia con eventuale secrezione di muco.
L‟ostruzione in questo caso è probabilmente dovuta più ad eventi di tipo INFETTIVO che al
fumo(tuttavia chi fuma è più soggetto ad infezioni)
2)BRONCHITE CRONICA
Condizione irritativa cronica dell‟albero respiratorio caratterizzata da iperproduzione di
muco,responsabile di tosse produttiva che duri per almeno 3 mesi all‟anno e per 2 anni consecutivi,in
assenza di un‟altra specifica malattia polmonare La tosse si manifesta soprattutto al risveglio quando si
passa da clinostatismo(in cui si l‟accumulo di muco è favorito dalla posizione orizzontale) a
ortostatismo(il passaggio in posizione verticale scatena tosse).La condizione irritativa cronica
dell‟albero respiratorio è indotta dal fumo di sigarette ma può essere peggiorata dall‟inquinamento
atmosferico grave.Lo smog infatti facilita sia l‟iperproduzione di muco ma anche le malattie allergiche
e le infezioni delle vie respiratorie.
Nella bronchite cronica si ha accumulo di muco;rigonfiamento del tessuto di rivestimento
alveolare/bronchiale. Rispetto alla forma acuta ,si aggiungono ai fenomeni infiammatori (modesti):
-iperplasia ed ipertrofia delle ghiandole mucipare
-metaplasia caliciforme delle cellule ciliate
-infiltrazione di mononucleati/PMN
-fibrosi peribronchiale
-aumento delle cellule muscolari lisce
-spasmo della muscolatura liscia bronchiale
Le forme croniche dipendono dal FUMO di sigaretta e dall‟inquinamento atmosferico:circa il 20%dei
fumatori di 15-20 sigarette/die con età >40 anni soffre di bronchite cronica e ha un epitelio bronchiale
che da cubico si trasforma in pavimentoso(creando così le premesse per una trasformazione
neoplastica!!!)
L‟eziopatogenesi della bronchite cronica è comunque multifattoriale(gli agenti infettivi possono
contribuire)con particolare importanza al fumo.Di solito la bronchite colpisce fumatori di mezza età di
sesso maschile.
La bronchite cronica è caratterizzata da propensione a infezioni respiratorie con compromissione
dell‟attività ciliare,ristagno(?) delle secrezioni e ridotta efficacia dei macrofagi alveolari.
Le infezioni a cui predispone la bronchite cronica sono:
-infezioni batteriche da H.Influenzae e da Streptococcus Pneumonite
-infezioni virali da Adenovirus,Virus Respiratorio Sinciziale
Bronchioliti:Infezioni,da virus respiratorio sinciziale,delle basse vie aeree dei bambini di età inferiore
ai 2 anni.Hanno alcune caratteristiche nel meccanismo di ostruzione simili a quelle della bronchite
cronica:
-Spasmo della muscolatura liscia bronchiale
-Ipertrofia e Iperplasia delle ghiandole sottomucose.
La bronchite è caratterizzata da un aumento di VEGF
3)ENFISEMA
E‟associato a un rigonfiamento infiammatorio e a restringimento dei bronchioli, nonché ad aumento del
contenuto aereo dei polmoni con rottura dei setti interalveolari e confluenza di più alveoli in un‟unica
camera con diminuzione del numero totale di alveoli.
Pertanto, essendo diminuito il numero di alveoli diminuirà anche la superficie totale di scambio
respiratorio, quindi pur essendoci l‟aria, gli scambi respiratori non possono avvenire.
Può essere associato ad inalazione di fumo di sigaretta,a fattori irritanti o a meccanismi genetici.
L‟evento scatenante è la digestione (rottura) della parete dei setti alveolari a causa di un‟eccessiva
attività enzimatica da parte di proteasi ed elastasi.Questo avviene se le proteasi non sono inibite come
ad esempio in caso di deficit di α1antitripsina (in tal caso c‟è enfisema senza passare per bronchite).
Nell‟enfisema il contenuto aereo del polmone aumenta perché l‟area non riesce a passare la membrana
(in quanto la superficie di scambio è diminuita) e spinge quindi andando a determinare fenomeni
dilatatori.
Gli enzimi in eccesso (per stimoli irritativi come il fumo di sigaretta e ancor di più in caso di deficit
congenito di α1antitripsina) distruggono i setti degradando elastina,collagene e fibronectina, costituenti
importanti dei setti interalveolari. Dai residui di elastina si formano dei peptidi che di per sé sono
chemiotattici e quindi in grado di attirare altre cellule infiammatorie.
(Lo stimolo per le cellule infiammatorie deriva quindi sia dai peptidi sia dal fumo); se a tutto ciò si
aggiunge carenza di proteasi, il processo sarà molto più rapido.
Nell‟enfisema è ridotto sia VEGF che VEGF-R.
Pare che ciò sia dovuto a danni del promoter del gene di VEGF causati dai ROS,prodotti in seguito agli
stimoli irritativi.
La dieta può proteggere il DNA dallo stress ossidativo (dieta Mediterranea,soprattutto olio di oliva).
Non essendoci più elastina, nell‟enfisema c‟è una diminuzione del ritorno elastico del polmone che
mantiene gli alveoli in uno stato di iperdistensione (riducendo così gli scambi).
L‟Enfisema può essere:
- Acuto:si instaura velocemente e transitoriamente ,ad esempio nell‟attacco asmatico
- Cronico:si instaura lentamente e persistentemente ad esempio nella bronchite cronica.
Può quindi essere un secondo step dopo una bronchite oppure insorgere improvvisamente(più
raramente)
Può interessare uno solo oppure entrambi i polmoni in forma diffusa o localizzata.
Interessa il parenchima polmonare in vario modo :
-centroacinoso
-paracinoso
-parasettale
-parasettale
-irregolare.
Cause dell‟enfisema
-Fumo di sigaretta
-Fattori genetici(deficit di α1antitripsina)
Può esserci un‟inattivazione di α1antitripsina ad opera di agenti ossidanti come il fumo di sigaretta
oppure l‟antiproteasi può essere assente per fattori genetici.
(quindi l‟enfisema può essere dovuto a eccesso di proteasi o a deficit di antiproteasi!!!)
In questa situazione c‟è un aumento della frequenza di infezioni batteriche e virali dell‟apparato
respiratorio con ulteriore accumulo di elementi infiammatori.
Enfisema Centrolobulare
È la variante più comune.Sono colpiti soprattutto i bronchioli ed i dotti alveolari ;riguarda i lobi
superiori;è associato al fumo.
Enfisema Panlobulare
Caratterizzato da ingrandimento generalizzato di tutto l‟acino;riguarda soprattutto le zone basse;spesso
si verifica insieme a enfisema centrolobulare;è fortemente associato a deficit di α1antitripsina
Enfisema Localizzato o Parasettale
Coinvolge prevalentemente la parte distale dell‟acino
Enfisema Bolloso
È di tipo subpleurico,associato ad altri enfisemi;c‟è una dilatazione permanente degli spazi aerei,i quali
fuoriescono sotto la pleura.
Enfisema Cicatriziale Irregolare
Caratterizzato dalla comparsa di tessuto fibrotico.
CONFRONTO BRONCHITE/ENFISEMA
Età di insorgenza
Bronchite: 40-45 anni
Enfisema:50-75 anni
Grado di dispnea
Bronchite:lieve,tardiva
Enfisema:precoce,grave
Infezioni
Bronchite:comuni
Enfisema:occasionali
Resistenza al flusso
Bronchite:aumentata
Enfisema:aumentata.
Espressione di VEGF
Bronchite:aumentata
Enfisema :ridotta.
4)ASMA BRONCHIALE
Costrizione spastica estesa a tutte le vie respiratorie ;c‟è un‟ostruzione parossistica delle vie
respiratorie.Come per le altre patologie,l‟ostruzione è soprattutto a carico dell‟espirazione,in grado di
risolversi spontaneamente o dopo intervento terapeutico.
È scatenata da allergeni ma anche da turbe emotive o sforzi fisici.
È correlata a RIST e RAST.
Sono imprevedibili sia l‟innesco della crisi che la risoluzione.
È potenzialmente mortale.
Colpisce circa il 10% dei bambini(in quanto il sistema immunitario dei bambiniè iperreattivo nei
confronti di alcuni stimoli) e il 5% degli adulti.
Asma Intrinseco(non immune):colpisce gli adulti apparentemente non portatori di patologie allergiche.
Asma Estrinseco(allergico):iperproduzione di IgE ed eosinofilia.
C‟è ipersensibilità nei confronti di allergeni che possono essere malati o ingeriti:Tali allergeni si legano
ad IgE le quali inviano un segnale che determina il rilascio da parte di mastcells di:
-Istamina
-Bradichinina
-Leucotrieni
-Prostaglandine
-TXA2
-PAF
-Fattori chemiotattici.
Gli ALLERGENI possono essere stagionali (es.pollini diversi a seconda del luogo;muffe,funghi) o
perenni(es.polveri domestiche contenenti Dermatofagoides Pteromissimus,acaro della polvere;forfora
animale)
Spesso il paziente è allergico a un pattern di allergeni,a causa della cross-reattività delle IgE:molecole
non correlate,possono avere omologie di sequenza e indurre quindi la stessa reazione(es.una struttura
presente nelle fragole può essere presente anche nei crostacei).
Nelle reazioni allergiche c‟è uno squilibrio fra Th2 e Th1;gli allergeni attivano i linfociti Th2 che
rilasciando IL4 inducono la produzione di IgE,le quali si fissano sui mastociti e sui basofili tramiti i
recettori per Fc.(Una possibile terapia sarebbe quindi quella di mascherare i siti di legame dei
mastociti).La degranulazione dei mastociti avverrebbe in seguito al Cross Linking delle IgE,ovvero un
antigene fa da ponte fra 2 molecole di IgE (sugli allergeni devono quindi esserci epitopi diversi
riconosciuti da IgE o devono esserci epitomi ripetuti) ed è scatenata da meccanismi di trasduzione del
segnale.
Più IgE ci sono,più è probabile che avvenga il cross linking e si sviluppi una crisi allergica;pertanto per
la prognosi sarà necessario valutare le IgE in circolo.
Caratteristiche microscopiche dell‟asma:
-ispessimento della membrana basale
-edema ed infiammazione (infiltrato eosinofilo)
-ipertrofia della muscolatura bronchiale liscia
-tappo mucoso
-desquamazione dell‟epitelio bronchiale
-metaplasia squamosa delle cellule muco-secernenti
N.B. L‟accumulo di muco bronchiale è comunque minore che nella bronchite!
Terapia:
- agonisti β-adrenergici
- antistaminici
- corticosteroidi(rischio di aplasia midollare nei bambini piccoli che ne fanno uso cronico)
- anticolinergici
-TERAPIA DESENSITIVIZZANTE:non è molto comune in pratica clinica perché è una sorta di
vaccinazione(può essere rischiosa).Per verificare se il paziente è allergico si espone il suo siero a 10
allergeni,poi si cambia combinazione,cioè se ne diminuisce il numero progressivamente fino ad
arrivare al pattern giusto.Si costruisce poi un vaccino “personalizzato”,dando così dosi via via crescenti
di peptide allergenico; tutto ciò deve essere fatto con cautela altrimenti si rischia lo shock anafilattico!!
Il sistema immunitario riconosce il peptide non immunogenico e produrrà così prima IgM e poi IgG. Le
IgG sono molto più rapide delle IgE e,al primo contatto con l‟allergene,copriranno gli epitomi di
allergene che pertanto non si potranno legare alle IgE.
-Terapia in studio:si basa sull‟inalazione,mediante aerosol,di anticorpi monoclonali contro l‟allergene.
E‟stato visto che alcuni anticorpi incrementano la presentazione dell‟antigene alle IgE,bloccando così il
rilascio di istamina.
Diagnosi asmatica:si misura il numero di atti respiratori/minuto che normalmente sono 16-20/min;in
condizioni patologiche assumono valori doppi rispetto a quelli normali.
INFIAMMAZIONE
Si svolge nel connettivo vascolarizzato. Si divide in acuta e cronica.
INFIAMMAZIONE ACUTA
Risposta immediata a stimoli lesivi endogeni o esogeni (necrosi, microrganismi etc); lo scopo è riparare
il danno. Tale processo si incentra sull‟attivazione delle cellule dell‟immunità innata (leucociti
circolanti, prevalentemente neutrofili, e presenti nei tessuti) e delle cellule della parete vascolare.
Vasodilatazione a livello del microcircolo arterioso: aumento del flusso ematico (iperemia reattiva)
calore ed eritema.
Aumento della permeabilità dei vasi: che causa fuoriuscita di liquidi e proteine dai vasi del
microcircolo; a questo segue come conseguenza, l‟edema (accumulo di acqua e soluti nei tessuti
interstiziali o nelle cavità sierose). L‟edema infiammatorio prende il nome di essudato, caratterizzato da
un elevato numero di proteine che determinano un alto peso specifico (> 1,020). L‟essudato va quindi
chiaramente distinto dal trasudato, che è invece costituito essenzialmente da plasma con un basso
contenuto di proteine (peso specifico <1,012), che deriva dall‟alterazione dell‟equilibrio pressorio a
livello dell‟endotelio vascolare in assenza di alterazioni della permeabilità vascolare.
ESSUDATO
Composizione:
- Presenza di proteine (albumina), solo talvolta discriminante;
- Presenza di mucopolisaccaridi (dal connettivo sottoendoteliale), discriminante (reazione di Rivalta:
reazione dei mucopolisaccaridi con acido acetico);
- Presenza di cellule (neutrofili, monociti, linfociti, eritrociti), non discriminanti;
- pH generalmente acido (dovuto ai mucopolisaccaridi e alle proteine dei fagociti);
- detriti di cellule necrotiche.
L‟essudato è dato da:
- Danno endoteliale lieve: risposta ritardata prolungata (chinine);
- Danno endoteliale grave: risposta immediata prolungata, con andamento non bifasico.
1) ESSUDATO SIEROSO:
- composizione simile al plasma (soprattutto albumine), con basso contenuto proteico (inferiore a 3
g/L) e povero di fibrina;
- ricco di mucopolisaccaridi;
- scarso contenuto di cellule;
- causato da un aumento della permeabilità e da una diminuzione del drenaggio linfatico;
- tipico delle cavità sierose e mucose (es. flittene da ustione).
2) ESSUDATO SIERO-FIBRINOSO:
- sieroso con coaguli di fibrina (per fuoriuscita di fibrinogeno quando c‟è danno endoteliale);
- infiltrazione in sierose (pleurite, pericardite) o in mucose (pseudomembrana difterica).
3) ESSUDATO SIERO-CATARRALE (raffreddore):
- alta viscosità/densità (mucopolisaccaridi, fucomucine, sialomucine);
- elevato contenuto di cellule (neutrofili e monociti);
- mucose dell‟apparato respiratorio, digerente, genitale femminile.
4) ESSUDATO PURULENTO:
- alta viscosità (pus);
- elevato contenuto cellulare (in particolare è elevato l‟infiltrato granulocitario neutrofilo, detti piociti,
ma sono presenti anche monociti);
- agenti responsabili di queste forme di infiltrato sono i batteri piogeni (stafilococco, meningococco) e
parassiti;
- pH basso per mucopolisaccaridi e enzimi lisosomiali rilasciati da fagociti; tali enzimi lisosomiali sono
spesso causa di danno tissutale di gravità variabile. La necrosi tissutale determina la formazione di una
cavità nella quale si raccoglie il pus denominata “ascesso”. La porzione centrale è occupata da
granulociti neutrofili e materiale necrotico, circondato da uno strato reattivo con proliferazione di
elementi parenchimatosi e fibroblasti (membrana piogenica). Più esternamente è presente uno strato di
connettivo molto vascolarizzato che delimita l‟ascesso e ne previene l‟ulteriore diffusione.
5) ESSUDATO EMORRAGICO:
- presenza di eritrociti;
- bacillo del carbonchio, peste.
N.B. Nelle forme si essudato che caratterizzano le mucose, il processo infiammatorio è caratterizzato
da un essudato di densità più elevata a causa dell‟aumentata secrezione mucosa (essudato
siero-catarrale), che nelle forme più aggressive si accompagna ad un forte infiltrato neutrofilo (essudato
muco-purulento). Negli organi parenchimatosi l‟essudato è esclusivamente di derivazione plasmatica,
mentre nelle forme che interessano le cavità peritoneale, pleurica, pericardica o articolari sono presenti
anche prodotti di secrezione di cellule mesoteliali.
Nelle forme infiammatorie più severe, a carico di cavità, è frequente osservare l‟essudazione di grosse
quantità di proteine plasmatiche. In questi casi, il fibrinogeno viene convertito in sede extravascolare in
fibrina, che si deposita sulle sierose sotto forma di una fitta rete filamentosa. A volte questi depositi di
fibrina, vengono eliminati normalmente mediante semplici processi di fibrinolisi; vi sono casi però in
cui la fibrinolisi è inefficiente per cui si ha deposito aumentato di fibrina, cui segue una ricca
infiltrazione di fibroblasti, produzione di bottoni vascolari e trasformazione del deposito fibrinico in
tessuto connettivo organizzato. Tale processo porta ad ispessimento della sierosa, con perdita di
elasticità (sierosite secca), e nei casi più estremi, totale occlusione della cavità sierosa.
Alcune forme di essudato poi, sono caratterizzate da un abbondante infiltrato neutrofilo che va incontro
a fenomeni apoptotici, modificando l‟essudato, che assume una elevata densità e un colore
caratteristico e viene indicato con il termine “pus”. Gli agenti più frequentemente associati a queste
forme infiammatorie sono i batteri piogeni, per cui il pus è frequentemente settico (essudato purulento).
Con la formazione dell‟essudato, la perdita di proteine plasmatiche riduce la pressione osmotica
all‟interno dei vasi e aumenta la pressione osmotica dei liquidi interstiziali. Questo fenomeno, in
associazione all‟aumento della pressione idrostatica, dovuta alla vasodilatazione e alla riduzione della
pressione colloido-osmotica, provoca una notevole fuoriuscita di liquidi nei tessuti interstiziali a livello
delle arteriole precapillari e una riduzione del rientro di liquidi a livello delle venule post-capillari.
QUINDI, l‟evento centrale per la formazione di edema infiammatorio è l‟aumento della permeabilità
dell‟endotelio che può avvenire in seguito a molteplici eventi, il più comune dei quali è rappresentato
dalla formazione di aperture tra le cellule endoteliali delle venule in seguito all‟azione dei mediatori
chimici dell‟infiammazione (es. istamina, bradichinina, leucotrieni e sostanza P). Tale fenomeno è di
breve durata e si risolve nell‟arco di 15-30 minuti.
Esiste poi un altro esempio, che però si risolve con cinetica ritardata (4-6 ore) spiegato dal fatto che il
sito infiammatorio è caratterizzato dalla secrezione di citochine infiammatorie quali TNF ed IL-1;
queste ultime hanno un profondo impatto sull‟endotelio vascolare, e provocano, fra l‟altro la
riorganizzazione del citoscheletro di queste cellule con conseguente “retrazione” endoteliale. Anche
questo fenomeno, come il primo, porta alla formazione di aperture endoteliali, anche se con più tempo.
Infine l‟aumento della permeabilità dei vasi può essere indotta ad es. da un danno diretto causato da
stimoli lesivi necrotizzanti, quali ustioni gravi e infezioni batteriche, oppure a eccessiva attivazione dei
leucociti reclutati nel sito infiammatorio.
Da ricordare: A livello del sito infiammatorio vengono attivati meccanismi di riparo del letto
vascolare. Questi includono la formazione di nuovi vasi mediante il processo di angiogenesi, che
consiste nella gemmazione di nuovi vasi dovuta all‟azione di stimoli angiogenetici (es. VEGF).
Reclutamento leucocitario: Il reclutamento dei leucociti dal circolo sanguigno e il loro accumulo nei
tessuti costituiscono un processo a più stadi che coinvolge un primo momento di rotolamento e
adesione all‟endotelio vascolare, cui fa seguito il passaggio attraverso l‟endotelio e la membrana
basale.
La fuoriuscita dal torrente ematico è controllata essenzialmente dalle proprietà dell‟endotelio vascolare
e dai segnali chemotattici di origine tissutale capaci di indurre la migrazione direzionale dei leucociti.
I segnali chemotattici classici sono costituiti da peptidi formilati di origine batterica, e da prodotti della
cascata del complemento, in particolare C5a.
In generale l‟adesione dei leucociti all‟endotelio è un processo fisiologico; vi sono casi però in cui i
leucociti aderiscono e infiltrano i tessuti a seguito di reazioni di tipo immunitario e infiammatorio.
L‟endotelio contribuisce a questi processi essenzialmente liberando sostanze chemotattiche, in grado di
richiamare e di attivare i leucociti nella zona di infiammazione, esprimendo sulla membrana molecole
adesive per i leucociti e producendo mediatori (PGI2 e NO) che causano vasodilatazione.
In assenza di stimoli l‟endotelio vascolare esprime alcune molecole adesive, in particolare ICAM-1 e
ICAM-2; queste, che normalmente assicurano un tono adesivo in grado di indurre la fuoriuscita di
leucociti in condizioni fisiologiche, assicurano anche il reclutamento iniziale durante le prime fasi
dell‟infiammazione.
In seguito a stimoli diversi, come IL-1 e TNF, l‟endotelio esprime sulla propria membrana molecole
adesive per i leucociti polimorfonucleati, i monociti e i linfociti. Alcune di queste molecole compaiono
solo dopo diverse ore (perché neosintetizzate) e persistono per tempi relativamente lunghi (24-48 ore);
altre invece compaiono sulla superficie endoteliale già dopo pochi minuti dopo la stimolazione, per
scomparire poi rapidamente. Questi fenomeni sono legati alla necessità di avere un reclutamento
iniziale rapido che possa poi venire stabilizzato da molecole diverse ed essere seguito dalla migrazione
dei leucociti negli strati extravascolari.
In particolare il rolling dei leucociti avviene inizialmente grazie a espressione sui leucociti dei ligandi
delle P ed E selectine (P sempre pronta, E neosintetizzata); questo tipo di adesione però è un‟adesione
debole. Per avere un‟adesione forte è necessaria l‟espressione sul leucocita di LFA-1 e ICAM-1
sull‟endotelio. Poi attraverso PECAM, avviene l‟attraversamento (o transmigrazione leucocitaria).
RECLUTAMENTO LEUCOCITARIO FASE PER FASE
Si conoscono quattro fasi: la fase del rotolamento, la fase dell‟attivazione, la fase dell‟adesione e la
diapedesi.
Quando un leucocita del sangue giunge in un sito infiammatorio, il flusso rallentato, lo porta ad
assumere una posizione marginale rispetto alla superficie dell‟endotelio. Questa situazione permette al
leucocita di interagire in modo blando con l‟endotelio tramite l‟ingaggio delle selectine con i loro
controrecettori.
Questa interazione è debole, per cui è solo in grado di rallentare, ma non di fermare il leucocita, per cui
si assiste a un vero e proprio rotolamento della cellula sull‟endotelio vascolare.
Questa interazione blanda, però, consente ai recettori chemotattici espressi dal leucocita di i fattori
chemotattici presenti sulla membrana dell‟endotelio. L‟attivazione del recettore chemotattico, attiva la
cellula, che aumenta l‟avidità di legame delle integrine con i controrecettori espressi dall‟endotelio
attivato.
Questa interazione produce l‟adesione stabile del leucocita sull‟endotelio e l‟inizio della diapedesi, cioè
il passaggio della cellula attraverso la parete vascolare guidato dal gradiente di fattori chemotattici.
Queste quattro fasi del reclutamento sono sequenziali e il blocco di ognuna di queste porta
all‟inibizione dell‟intero processo del reclutamento.
N.B. Nel reclutamento le prime cellule ad essere reclutate sono i granulociti neutrofili seguiti dai
monociti e per ultimi dai linfociti. Inoltre gli eosinofili si accumulano preferenzialmente nelle sedi delle
reazioni allergiche.
N.B.(2) Le chemochine causano:
- aumento dell‟avidità e dell‟affinità delle integrine;
- aumento della produzione di TNF e IL-1;
- aumento di espressione di molecole di adesione (E-selectina e ICAM-1).
Fagocitosi: Il fine del reclutamento leucocitario al sito di infiammazione è inizialmente quello di
accumulare in loco le cellule dell‟immunità innata deputate alla neutralizzazione degli agenti patogeni
e successivamente quello di indirizzare gli effettori dell‟immunità specifica. Gli stimoli chemotattici
sono in grado, quando associati a citochine pro-infiammatorie come IL-1 e TNF, di promuovere
l‟attivazione dei meccanismi citotossici delle cellule fagocitiche che per prime raggiungono il sito
infiammatorio: i polimorfonucleati neutrofili e i monociti (nelle fasi iniziali neutrofili (a breve
emivita: 8 ore); nelle fasi tardive macrofagi .
I fagociti esprimono sulla loro membrana proteine in grado di riconoscere i pattern molecolari tipici
degli agenti patogeni. Alcune di queste proteine servono per attivare la cellula (es. recettori Toll like),
altri assolvono anche il ruolo di stimolare la fagocitosi (es. recettore per il mannosio e il CD14).
Ad ogni modo il processo di fagocitosi può essere suddiviso in tre fasi:
1) FASE DI RICONOSCIMENTO E ADESIONE DEL FAGOCITA AL PATOGENO, O AL
MATERIALE CHE DEVE ESSERE FAGOCITATO: il riconoscimento dei patogeni o del materiale da
fagocitare risulta facilitato quando questo è rivestito da opsonine (opsonizzato), che sono riconosciute
da recettori specifici e servono per il riconoscimento da parte dei macrofagi e dei neutrofili.
Le opsonine più comuni sono: IgG riconosciute dai recettori Fc R espressi sui fagociti; C3b, C3d, C4b,
che sono frammenti della cascata del complemento riconosciuti dai recettori CR1, CR2, CR3.
2) FASE DI INGESTIONE: avviene attraverso un processo di endocitosi, e le cellule utilizzano diverse
“strategie” per attuare questo processo. In ogni caso comunque, si ha la formazione di fagosomi, le cui
membrane, si fonderanno poi con dei lisosomi, a formare i cosiddetti fagolisosomi.
3) FASE DI UCCISIONE E DEGRADAZIONE: all‟interno dei fagolisosomi, i lisosomi riversano il
loro contenuto di materiale citotossico che sarà responsabile dell‟uccisione e degradazione del
materiale fagocitato.
I lisosomi contengono diverse proteine responsabili dell‟uccisione dei batteri. I neutrofili possiedono
due principali tipi di granuli che contengono sostanze citotossiche: i granuli specifici (o secondari), che
contengono lisozima, collagenasi, gelatinasi, lattoferrina, l‟attivatore del plasminogeno e la fosfatasi
alcalina; e granuli azzurrofili (o primari) che contengono mieloperossidasi, lisozima, defensine, idrolasi
acide e proteasi neutre (elastasi, catepsina G).
Infine i fagociti possono operare la cosiddetta “fagocitosi frustrata”, liberando all‟esterno mediante un
fenomeno di esocitosi, principalmente intermedi reattivi dell‟ossigeno; questo avviene quando ci si
trova di fronte a particelle eccessivamente adese e grandi, o in presenza di un singolo tessuto.
MEDIATORI DELL’INFIAMMAZIONE RILASCIATI IN SEGUITO AL DANNO
Durante il processo infiammatorio si assiste alla sintesi di un ampio spettro di sostanze chimiche che
vengono liberate e svolgono compiti importanti nel condizionare vari aspetti dell‟infiammazione.
a) Mediatori vasoattivi: PLASMATICI (preformati) prodotti dal fegato sotto forma di precursori
attivati nella risposta infiammatoria grazie a taglio proteolitico. Sono: fattori della coagulazione,
chinine e complemento.
b) Mediatori chemotattici: CELLULARI, si dividono in mediatori preformati quali istamina e
serotonina; e mediatori di nuova sintesi quali prostaglandine, leucotrieni, PAF, e citochine.
AMINE VASOATTIVE
Istamina: E‟ contenuta nei granuli dei mastociti, dei basofili e delle piastrine, e viene rilasciata in
seguito all‟esposizione di queste cellule a stimoli lesivi, quali trauma o calore, o chimici, quali le
anafilotossine (c3a, c5a), crosslinking dei recettori per la frazione cristallizzabile delle Ig, o
l‟attivazione da parte di stimoli chemotattici o dai neuropeptidi.
L‟istamina interagendo con i recettori di tipo H1 rappresenta il principale stimolo responsabile della
vasodilatazione periferica e dell‟aumento della permeabilità vascolare che porta alla formazione
dell‟edema. Questo è un processo transitorio perché l‟istamina viene inattivata rapidamente.
Inoltre l‟istamina svolge un ruolo nel reclutamento leucocitario inducendo l‟espressione di P-selectina
sulle cellule endoteliali.
Altri ruoli sono: contrazione della muscolatura liscia broncopolmonare; attività chemotattica per
neutrofili.
Serotonina: Contenuta nei granuli delle piastrine e nelle cellule enterocromaffine. Ha azione
vasoattiva, ma ha effetti secondari rispetto a quelli dell‟istamina.
PROTEASI PLASMATICHE
Sistema del complemento: Attraverso la via alternativa e la via classica si ha attivazione di C3
convertasi, che agisce su C3 da cui si formano C3a (anafilotossina) e C3b (opsonina); e di C5
convertasi che agisce su C5 formando C5a e C5b.
Chinine: Peptidi plasmatici prodotti per attivazione di enzimi proteolitici (callicreine). Attraverso
l‟attivazione della via delle chinine (a partire dal fattore di Hageman) si ha la formazione di
bradichinina. La bradichinina è un potente mediatore in grado di attivare la permeabilità vascolare e la
contrazione della muscolatura liscia.
METABOLITI DELL‟ACIDO ARACHIDONICO
Il processo infiammatorio comporta un rimodellamento dei fosfolipidi di membrana dovuto
all‟attivazione di fosfolipasi causata da stimoli meccanici/fisici e da mediatori infiammatori, come il
C5a. L‟attivazione dei diversi tipi di fosfolipasi A2 causa la liberazione di acido arachidonico legato in
posizione 2 in diverse specie di fosfolipidi di membrana. L‟acido arachidonico libero viene
rapidamente metabolizzato in altri lipidi biologicamente attivi ad opera di due principali sistemi
enzimatici:
1) la via della ciclossigenasi;
2) la via della lipossigenasi.
- La via metabolica della ciclossigenasi è costituita da due enzimi: la ciclossigenasi-1 e la
ciclossigenasi-2 (COX-1 e COX-2) che sono responsabili per la sintesi di prostaglandine e trombossani.
La COX-1 è costitutivamente espressa in molte cellule, mentre la COX-2 è espressa prevalentemente
da cellule del sistema immunitario in conseguenza a stimoli infiammatori.
Quindi COX-1 interviene nelle primissime fasi della risposta infiammatoria, mentre COX-2 è
responsabile della sintesi dei prostanoidi in fasi più avanzate e nell‟ambito dell‟infiammazione cronica.
Le prostaglandine più importanti sono: PGE1, PGE2, PGD2, PGF2 e PGI2 (prostaciclina), mentre il
trombossano più importante è TXA2.
La prostaciclina ha azione antitrombotica, in quanto inibisce l‟aggegazione piastrinica, e ha capacità di
aumentare la permeabilità vascolare e di indurre vasodilatazione. Il trombossano è invece un
vasocostrittore che promuove l‟aggregazione piastrinica.
N.B. COX-1 e COX-2 sono bersaglio di molti farmaci non steroidei come l‟aspirina.
- La via metabolica della lipossigenasi raggruppa l‟azione di diverse forme enzimatiche. Nei neutrofili
l‟attivazione della 5-lipossigenasi è responsabile della formazione di composti noti come leucotrieni,
dotati di azione attivatoria a livello delle piastrine e dei leucociti e sono in grado di indurre
vasocostrizione e broncospasmo.
Inoltre la via delle lipossigenasi porta alla formazione di lipidi ad azione anti-infiammatoria; infatti
l‟attivazione della 12-lipossigenasi genera lipossina A4 e lipossina B4, le quali inibiscono l‟adesività
dei neutrofili all‟endotelio attivato e la loro risposta chemotattica.
Inoltre le lipossine hanno azione vasodilatatrice e sono in grado di inibire la produzione di leucotrieni.
MONOSSIDO DI AZOTO (NO)
Induce vasodilatazione agendo sulla muscolatura liscia dei vasi. Viene prodotto dalla L-arginina per
azione di tre diversi enzimi: le NOS di tipo endoteliale (eNOS), neuronale (nNOS), e inducibile
(iNOS).
La eNOS e la nNOS sono espresse costruttivamente, mentre la iNOS viene espressa in seguito ad
azione di citochine infiammatorie su cellule endoteliali e macrofagi.
In generale l‟NO riduce l‟adesione e l‟aggregazione piastrinica, e la chemiotassi.
FATTORE ATTIVANTE LE PIASTRINE (PAF)
E‟ prodotto dall‟idrolisi dei fosfolipidi di membrana grazie all‟azione della fosfolipasi A2. Rilasciato
dai leucociti induce: contrazione della muscolatura liscia; vasodilatazione e aumento della permeabilità
dei vasi; chemiotassi di neutrofili, monociti ed eosinofili; attivazione di cellule dell‟infiammazione;
degranulazione leucocitaria e burst ossidativo.
INFIAMMAZIONE CRONICA
Dall‟infiammazione acuta si può avere:
1) RISOLUZIONE: cessa lo stimolo infiammatorio; si ha il catabolismo dei mediatori; rimpinzamento
delle cellule danneggiate; ripresa della normale funzione.
2) INCAPSULAMENTO DELL‟ESSUDATO: ascesso.
3) FIBROSI: sostituzione del connettivo vascolarizzato con tessuto fibrotico (fibroblasti + matrice
extracellulare), cui segue una perdita di funzione.
4) INFIAMMAZIONE CRONICA: determinata in alcuni casi dall‟esposizione ripetuta nel tempo ad un
agente lesivo acuto, ma più frequentemente la causa è da ricercare nella mancata eradicazione
dell‟agente lesivo, con conseguente persistente attivazione di processi reattivi primariamente atti ad
eliminare l‟agente, ma che rappresentano frequentemente una concausa del danno tissutale, e di
processi di riparo tissutale.
La mancata eradicazione del patogeno, in genere è dovuta a “condizioni locali”, quali la persistenza del
materiale di danno, oppure “condizioni dipendenti dall‟ospite”, come deficit immunologici che
compromettono la capacità di fagocitosi o di uccisione del patogeno.
Quando un processo da acuto diventa cronico, si accompagna ad un graduale modificarsi degli
eventi tissutali e dell‟infiltrato leucocitario: infatti nell‟infiammazione cronica si ha una netta
predominanza di cellule macrofagiche, ed un contributo di altri tipi leucocitari (linfociti, plasmacellule,
eosinofili), variabile a seconda dell‟agente lesivo.
N.B. Nell‟infiammazione cronica c‟è prevalenza di fenomeni cellulari, per questo è detta anche
“istoflogosi”, a differenza dell‟infiammazione acuta che è detta “angioflogosi”.
Sono minori rispetto all‟infiammazione acuta anche le reazioni vascolari, anche se nelle primissime fasi
si assiste alla proliferazione dei piccoli vasi (angiogenesi), ed una reazione fibroblastica che porta a
sostituzione del parenchima danneggiato con tessuto connettivo (fibrosi).
Esistono poi delle forme infiammatorie cosiddette: “primariamente croniche”, e in genere sono dovute
a due tipi di cause:
1) reazioni infiammatorie croniche che si accompagnano a malattie autoimmuni, in cui i tessuti che
esprimono l‟autoantigene vengono danneggiati da un meccanismo di ipersensibilità di tipo II (es.
sclerodermia ), mentre nel caso di coinvolgimento di tessuti per la precipitazione di immunocomplessi
agiscono meccanismi immuno-mediati di ipersensibilità di tipo III (es. lupus eritematoso).
2) reazioni infiammatorie croniche dovute ad agenti infettivi caratterizzati da bassa tossicità e dalla
resistenza alla eradicazione (es. micobatteri, funghi) che determinano una risposta infiammatoria
cronica con un meccanismo cellulo-mediato (ipersensibilità di tipo IV).
In queste forme, in mancanza di una fase acuta evidente, il quadro è dominato da rilevanti
alterazioni strutturali del tessuto per reazione fibrosa e dalla costante presenza nell‟infiltrato
leucocitario di linfociti e plasmacellule, al fianco di macrofagi o cellule di derivazione macrofagica che
dominano il processo fin dall‟esordio.
INFIAMMAZIONE GRANULOMATOSA
Quando l‟agente lesivo non causa danno al tessuto circostante, ma agisce in modo localizzato, la
risposta infiammatoria cronica si organizza sotto forma di un nodulo di tessuto infiammatorio ben
circoscritto dal tessuto circostante, denominato granuloma.
1) La presenza di materiale inerte, non eliminabile dal sistema dei fagociti determina la formazione di
un primo tipo di granuloma definito: ”non immunologico”. In queste forme al centro del granuloma è
presente il corpo estraneo, costituito da materiale inerte non degradabile da parte dei macrofagi per
dimensione, natura chimica, o materiale dotato di attività tossica sui macrofagi.
Sono assenti cellule infiltranti di natura linfocitaria; il corpo estraneo è circondato da macrofagi e al
margine del granuloma è presente una reazione fibrosa che tende ad isolarlo dal tessuto circostante.
Inoltre, nelle forme in cui sono presenti corpi estranei di grosse dimensioni si trovano anche cellule
giganti multinucleate derivate dalla fusione sinciziale di macrofagi tissutali, caratterizzate da spiccata
attività fagocitica e ridotta attività secretoria e da una distribuzione irregolare dei nuclei nel citoplasma.
2) In presenza di agenti non degradabili dotati di un corredo antigenico si sviluppano invece i
cosiddetti: “granulomi immunologici”, per la maggior parte dei casi causati da agenti infettivi a bassa
virulenza, che vengono fagocitati dal macrofago ma sopravvivono in sede intracellulare e sono
difficilmente eradicabili in assenza dell‟intervento di una risposta immunitaria specifica.
Tali forme granulomatosa sono caratterizzate dalla presenza di un grande infiltrato linfocitario sia nella
porzione centrale del granuloma, in stretta connessione con i macrofagi, sia nella porzione più
periferica.
In queste forma i macrofagi infiltranti sono caratterizzati da un aspetto a “palizzata” con RE rugoso e
prominente, che supporta un‟intensa attività secretoria (secernono citochine responsabili del
reclutamento e dell„attivazione dei linfociti T), con ridotta attività fagocitica, e vengono detti “cellule
epitelioidi”. Spesso le cellule epiteliodi danno vita per fusione sinciziale, alla formazione di cellule
giganti multinucleate in cui i nuclei assumono una caratteristica distribuzione periferica a ferro di
cavallo (cellule di Langhans) o una distribuzione disorganizzata (cellule da corpo estraneo), con scarsa
attività secretoria e scarsa attività fagocitica.
La stimolazione dei linfociti T helper porta alla piena attivazione macrofagica e alla polarizzazione
della risposta infiammatoria (vedi oltre).
Il granuloma in questo caso è caratterizzato da una capsula fibrosa che lo circonda, mentre nelle
porzioni centrali sono spesso osservabili fenomeni necrotici, come nel caso della necrosi caseosa per i
granulomi tubercolari o della gomma luetica nella sifilide.
TIPI DI GRANULOMA
1) TUBERCOLARE:
- Causato dalla risposta da ipersensibilità ritardata di IV tipo nei confronti del micobatteri tubercolare,
difficilmente eradicabile per la sua capacità di sopravvivere all‟interno dei fagociti.
- In periferia: linfociti T e fibroblasti;
- Al centro: macrofagi e cellule epitelioidi;
- Ancora più al centro: cellule giganti di Langhans.
La zona centrale va incontro a necrosi caseosa.
Evoluzione: calcificazione; colliquazione della zona centrale con diffusione dell‟infezione e
formazione di caverne, tipiche dell‟infezione tubercolare, quando la necrosi caseosa viene colliquata
ulteriormente.
2) LUETICO (sifilide):
- Meno ordinato;
- Disposizione perivasale;
- Poche cellule giganti;
- Presenza di linfociti B e plasmacellule;
- Necrosi colliquativa, tipica della gomma luetica.
3) GRANULOMA DELLA LEBBRA:
- Scarsa necrosi;
TUBERCOLOIDE: infiltrato linfocitario;
LEPROMATOSO: scarso infiltrato linfocitario.
4) SARCOIDOSI:
Si genera in seno a diversi organi a causa di una risposta cellulo-mediata Th1 dipendente verso un
antigene ignoto che caratterizza la sarcoidosi.
- Di tipo immunologico;
- Eziologia sconosciuta;
- Presenza di cellule giganti di Langhans;
Evoluzione: fibrosi, ma non necrosi.
5) DA CORPO ESTRANEO:
- Assenza di infiltrato linfocitario;
- Poche o assenti cellule epitelioidi;
Evoluzione: fibrosi.
Esempi: asbestosi, antracosi, silicosi.
6) ARTRITE REUMATOIDE:
- Alto infiltrato linfocitario;
- Scarsa fibrosi.
CELLULE DELL‟INFIAMMAZIONE CRONICA
- Monociti;
- Cellule epitelioidi: aspetto a palizzata con RE prominente, fenotipo secretorio (citochine), scarsa
attività fagocitica;
- Cellule giganti: scarsa attività secretoria, scarsa attività fagocitica; di due tipi: di tipo Langhans:
disposizione dei nuclei a ferro di cavallo; tipo da corpo estraneo: nuclei disorganizzati.
- Linfociti B;
- Linfociti T che rilasciano linfochine (IFN );
- Mastociti e Basofili che rilasciano mediatori;
- Eosinofili: che rilasciano mediatori;
- Neutrofili: rilascio di enzimi lisosomiali; ruolo nella colliquazione della necrosi;
- Fibroblasti.
MEDIATORI CELLULARI E MOLECOLARI DELL‟INFIAMMAZIONE CRONICA
1) L‟infiltrato macrofagico: il protagonista cellulare della risposta infiammatoria cronica è il
macrofago, che deriva dalla spontanea extravasazione di monociti circolanti nel connettivo i quali
vanno incontro a processi di differenziazione terminale da cui derivano differenti tipi cellulari, che, in
assenza di stimoli flogistici, permangono nel tessuto quiescienti.
In condizioni infiammatorie, i mediatori proinfiammatori locali determinano un aumento del numero di
macrofagi infiltranti dovuto al reclutamento di monociti circolanti da parte di agenti chemotattici
indotti da citochine proinfiammatorie primarie (in particolare chemochine CC infiammatorie). Un ruolo
minore è svolto dall‟aumento dell‟emivita macrofagica sostenuto dall‟IL-1 e TNF.
L‟azione di mediatori proinfiammatori locali e l‟attivazione di recettori in grado di riconoscere
molecole derivate dal patogeno inducono nel macrofago uno stato di attivazione detto “innato”,
caratterizzato dalla produzione di vari mediatori solubili fra cui:
- citochine proinfiammatorie primarie che sostengono la risposta infiammatoria locale e le
manifestazioni sistemiche;
- chemochine e agenti chemotattici che potenziano e differenziano l‟infiltrato leucocitario;
- fattori coinvolti nel rimaneggiamento tissutale.
Nelle risposte infiammatorie croniche in cui non sono coinvolti linfociti e loro prodotti di secrezione, il
processo di attivazione macrofagica si esaurisce a questo livello.
Nello spegnimento della risposta infiammatoria, infine, subentrano mediatori anti-infiammatori e
molecole che sostengono i processi di angiogenesi e fibrosi tissutale.
2) I linfociti T helper e la polarizzazione delle risposte infiammatorie croniche: sono riconoscibili due
varianti polarizzate di risposta infiammatoria, definite dall‟interazione di macrofagi rispettivamente con
linfociti T helper1 o T helper2.
Un numero rilevante di variabili determinano l‟instaurarsi dell‟una o dell‟altra forma, in parte a carico
del patogeno (natura dell‟agente patogeno, via d‟esposizione, concomitanza con altri agenti), in parte a
carico dell‟ospite (modalità di presentazione dell‟antigene, predisposizione individuale su base
genetica).
N.B. Molte forme infiammatorie occupano una posizione intermedia.
3) Risposte polarizzate di tipo I: L‟esposizione a patogeni intracellulari (es. Mycobacterium, Lysteria,
miceti) determina l‟attivazione di una risposta immune specifica dominata da linfociti T helper1
caratterizzata dalla secrezione di IFN a seguito della stimolazione da parte dell‟antigene specifico e di
IL-12 derivata dai macrofagi attivati.
L‟IFN ha sui macrofagi una molteplicità di azioni.
4) Risposte polarizzate di tipo II: L‟esposizione a protozoi extracellulari (es. schistosoma) e le
patologie su base allergica, si associano ad attivazione di una risposta immune specifica, dominata da
linfociti T helper2 la cui caratteristica distintiva è la secrezione di IL-4/IL-13 e di IL-5. In
concomitanza con la stimolazione del recettore per l‟antigene specifico, IL-4 e IL-13 inducono
attivazione dei linfociti T helper2 e la conseguente polarizzazione della risposta immune verso una
risposta polarizzata di tipo 2. Hanno inoltre attività antagonista a IFN , sui linfociti T helper1 e
determinano lo Switch isotipico verso IgE.
GUARIGIONE DELLE FERITE
La gravità e l‟estensione del danno modulano la sequenza di eventi:
- Se l‟agente lesivo è poco aggressivo, segue risoluzione con riassorbimento dell‟essudato e ripristino
morfo-funzionale del tessuto; non si ha necrosi.
- Se l‟agente lesivo è molto aggressivo, si ha perdita netta dei tessuti biologici (necrosi), e guarigione
per prima o seconda intenzione.
DANNO
INFIAMMAZIONE
ESSUDATO:
1) RISOLUZIONE;
2) NECROSI:
- Limitata: guarigione per prima intenzione;
- Estesa: guarigione per seconda intenzione.
(la necrosi è proporzionale al danno!)
La guarigione è una combinazione di due eventi:
1) RIGENERAZIONE: proliferazione ove possibile di cellule dello stesso tessuto che è stato lesionato
(ricostruzione della normale architettura);
2) RIPARAZIONE o REINTEGRAZIONE CONNETTIVALE: sostituzione strutturale e non
funzionale del tessuto di origine con tessuto connettivo che diventerà poi tessuto cicatriziale.
Le cellule stabili hanno solo questo tipo di riparazione (es.cardiociti).
Distinguiamo:
- Cellule labili o ciclanti: si dividono continuamente, sono in fase S (es. epidermide e epitelio
gastrointestinale).
- Cellule stabili o perenni: sono fuori dal ciclo (es. neuroni o cardiociti).
- Cellule quiescienti: sono in fase G0, ma in seguito a uno stimolo come la lesione entrano in ciclo e si
rigenerano (es. epatociti).
Le cellule labili e quiescienti riparano il tessuto, ma se il danno è grande la rigenerazione non è
sufficiente per riparare il tutto, allora compare un pò di tessuto cicatriziale.
Le cellule stabili danno quasi sempre luogo a tessuto cicatriziale (es. miocardiociti: dopo infarto infatti
dalle cellule necrotiche si forma tessuto cicatriziale con conseguente perdita della funzionalità
cardiaca).
Aspetto chiave della guarigione è la capacità proliferativa delle cellule danneggiate. Nei tessuti
adulti la popolazione cellulare è determinata dall‟equilibrio fra: divisione cellulare, differenziamento,
morte cellulare per apoptosi. Quindi, anche l‟età incide nella guarigione infatti nei bambini una ferita
scompare meglio e più velocemente.
E‟ importante vedere quali cellule hanno subito danno, cioè la sede e il tipo delle cellule (ciclanti,
quiescienti o stabili).
La ricostruzione integrale del tessuto distrutto è possibile solo per organi parenchimatosi costituiti da
cellule labili e cellule stabili. Per le cellule perenni è importante garantire la continuità morfologica
dell‟organo, ma non il ripristino funzionale.
RESTITUTIO AD INTEGRUM
Grado di recupero funzionale completo dopo lesione tissutale; tiene conto anche della capacità
proliferativa.
Dipende da:
1) Rapporto rigenerazione/riparazione;
2) Gravità del danno e capacità rigenerativa del tessuto leso; capacità proliferativa delle cellule
sopravvissute nell‟area danneggiata (cellule epiteliali > epatociti > neuroni);
STIMOLO LESIVO
MORTE CELLULARE
INFIAMMAZIONE:
1) Popolazione di cellule perenni riparazioni organizzate cicatrizzazione;
2) Popolazione di cellule rinnovabili (labili) o potenzialmente rinnovabili (stabili): - architettura del tessuto connettivo intatto;
- architettura del tessuto connettivo parzialmente o totalmente distrutta organizzazione, più
o meno rigenerazione disordinata cicatrizzazione.
Il processo sopra descritto è indipendente dal tessuto coinvolto.
Durante il processo riparativo entrano in gioco vari tipi di cellule:
1) Cellule specifiche del tessuto interessato (es. cheratinociti nella pelle);
2) Cellule la cui presenza è ubiquitaria in tutti i tessuti (es. fibroblasti che formano lo stroma e cellule
endoteliali che formano i vasi);
3) Cellule che caratterizzano la riparazione indipendentemente dal distretto lesionato (es. piastrine e
leucociti);
4) Componenti della ECM.
L‟ECM è formata da: sostanza fondamentale (liquido interstiziale, proteoglicani, glicoproteina, acido
jaluronico), cellule (fibroblasti, macrofagi, plasmacellule, granulociti), proteine fibrose (collagene,
elastina, fibronectina, laminine), citochine e fattori di crescita.
Le funzioni della ECM sono:
1) Sequestro di acqua e minerali;
2) Serbatoio per fattori di crescita;
3) Substrato per interazione fra cellule;
4) Substrato per proliferazione e migrazione cellulare.
LESIONI CUTANEE
Modello ottimale per definire i processi di riparazione: a seconda dell‟estensione dell‟area lesionata
(necrosi) il processo di guarigione può avvenire per prima intenzione o seconda intenzione.
GUARIGIONE PER PRIMA INTENZIONE:
Ferita a margini giustapposti con poca perdita di sostanza, assenza di infezioni significative (es. ferita
chirurgica):
- Primo giorno:
1) Interruzione della continuità della membrana basale epiteliale;
2) Formazione del coagulo di fibrina (disidratandosi forma la crosta);
3) Degranulazione delle piastrine;
4) Richiamo dei neutrofili presso i margini della lesione per proteggere da infezioni (reazione
infiammatoria limitata).
Non si possono separare o ordinare singolarmente gli eventi in quanto sono tutti connessi; In genere si
studiano secondo diversi intervalli di tempo.
- Terzo/Settimo giorno:
1) Sostituzione dei neutrofili con macrofagi;
2) Migrazione/proliferazione dei cheratinociti con ripristino della membrana basale (collagene di tipo
IV e laminina). Quando si incontrano cellule dei due margini della ferita, si ha inibizione da contatto,
ma continua la proliferazione per formare più strati, cioè più spessore. Sui cheratinociti per maggiore
proliferazione e migrazione agiscono TGF , EGF e KGF.
3) Migrazione/proliferazione dei fibroblasti e deposito di ECM (collagene di tipo III);
4) Orientamento verticale delle fibre di collagene (poco ordinato, serve come “pista“ per le cellule che
devono passare;
5) Neoangiogenesi;
6) Formazione di tessuto di granulazione (più neoangiogenesi, più tessuto di granulazione!).
- Dopo settimane:
1) Ulteriore proliferazione dei fibroblasti;
2) Ulteriore accumulo di collagene (disposizione a ponte: collagene di tipo I con struttura più ordinata);
3) Regressione dei vasi;
4) Organizzazione della cicatrice.
GUARIGIONE PER SECONDA INTENZIONE
Ferita a margini separati (lacero-contusa); estesa perdita di tessuto; possibili infezioni significativi; pus;
tessuto di granulazione.
- Primo giorno:
1) Ampia perdita di tessuto;
2) Coagulo più vasto;
3) Maggiore risposta infiammatoria con numero più alto di neutrofili (in quanto devono essere rimosse
cellule necrotiche);
4) Maggiore quantità di residui necrotici/essudato;
5) Maggiore rischio di infezioni.
- Terzo/Settimo giorno:
1) Maggiore richiamo di macrofagi;
2) Maggiore quantità di tessuto di granulazione;
3) Elevata neovascolarizzazione.
- Dopo settimane:
1) Comparsa di miofibroblasti contrazione della ferita;
2) Rimodellamento del collagene (da tipo III utile per il passaggio cellulare a tipo I più resistente);
3) Formazione di cicatrice evidente (minor recupero morfo-funzionale.
Quindi la guarigione di una ferita cutanea si divide in tre fasi in parte sovrapponibili:
1) INFIAMMATORIA;
2) TESSUTO DI GRANULAZIONE;
3) CONTRAZIONE, RIMODELLAMENTO E CICATRIZZAZIONE.
I vari eventi possono variare nel tempo in base all‟estensione della lesione.
FASE INFIAMMATORIA (ore)
Funzioni del coagulo di fibrina:
1) Serve come barriera protettiva contro i microrganismi;
2) Serve da matrice provvisoria per le cellule che contribuiscono alla riparazione;
3) Serve da “reservoir” per i vari fattori di crescita richiesti per le fasi successive.
La degranulazione delle piastrine libera PDGF e TGF che richiamano per chemiotassi leucociti (prima
neutrofili e poi macrofagi) che attraverso proteasi o ROS provvedono alla pulizia delle ferite
(digestione controllata del coagulo) e fibroblasti che proliferano, migrano nello stroma temporaneo e
depositano ECM.
FASE DI RIGENERAZIONE EPITELIALE O RIEPITELIZZAZIONE (giorni)
1) Migrazione e proliferazione dei cheratinociti mediata da: EGF, TGF , KGF e GMCSF;
2) Avanzamento del margine libero verso l‟interno della ferita e deposito di componenti di una nuova
ECM;
3) Arresto della migrazione quando i cheratinociti si incontrano al centro della ferita;
4) Arresto della proliferazione quando si ripristina lo spessore originario dell‟epidermide.
FORMAZIONE DEL TESSUTO DI GRANULAZIONE (10 giorni)
Il tessuto di granulazione è un tessuto fibrovascolare con aspetto rosato e granulare a causa della
proliferazione dei fibroblasti e dell‟intensa neovascolarizzazione della zona lesa.
Si forma grazie a:
1) Macrofagi che rilasciano PDGF e TGF , i quali stimolano fibroplasia e neoangiogenesi e continuano
l‟azione digestiva iniziata dai neutrofili;
2) Fibroblasti che producono nuova ECM stimolati da PDGF e TGF (inizialmente ECM provvisoria
collagene di tipo III, in seguito rimodellamento collagene di tipo I);
3) Cellule endoteliali che formano nuovi vasi per portare ossigeno e nutrienti stimolate da VEGF e
BFGF.
NEOANGIOGENESI
1) Proteolisi ECM;
2) Migrazione e chemiotassi;
3) Proliferazione;
4) Formazione del lume, maturazione e inibizione della crescita;
5) Aumento della permeabilità dovuto a fenestrature;
6) Proliferazione e migrazione delle cellule endoteliali verso il letto della ferita e digestione del coagulo
con proteasi (confluenza di fattori endoteliali).
Si parte da fattori già esistenti per gemmazione.
ANGIOGENESI:
a) per mobilizzazione dei precursori delle cellule endoteliali (EPC) da parte del midollo osseo;
b) per proliferazione e migrazione delle cellule endoteliali da vasi preesistenti.
VEGF
1) Mobilizzazione, proliferazione e differenziazione da precursori di cellule endoteliali:
VASCULOGENESI;
2) Mobilizzazione, proliferazione da cellule endoteliali di vasi preesistenti: NEOANGIOGENESI.
Altri fattori di angiogenesi sono: BFGF che stimola le cellule endoteliali, ANGIOPOIETINE, PDGF
e TGF : tutti e tre stimolano i periciti.
CONTRAZIONE DELLA FERITA
I miofibroblasti derivano da fibroblasti per azione di TGF ; contengono proteine contrattili; si
contraggono permanentemente causando una riduzione dello spazio tra i margini (che può arrivare fino
al 50% in meno) e possibile cambiamento di forma della cicatrice per raggiungere il massimo grado di
resistenza.
RIMODELLAMENTO TISSUTALE:
Il tessuto di granulazione viene rimpiazzato dalla cicatrice che è relativamente acellulare, con
degenerazione dei vasi del tessuto di granulazione e riassorbimento dell‟edema.
La matrice definitiva ha molto collagene (legami inter e intra-fibrillari fra fibrille collagene) e
sostituisce la matrice provvisoria grazie a:
- metallo-proteasi (collagenasi; gelatinasi; ADAM con attività proteolitica, ancorate alla membrana
plasmatica);
- TIMP (inibitori delle metallo-proteasi), agiscono quando tutto è finito e si deve smettere di riparare la
ferita;
- attivatore del plasminogeno che a sua volta attiva la plasmina che agisce su collagenasi e i loro
inibitori.
ESITI ANOMALI DELLA RIPARAZIONE DELLE FERITE
1) Mancato controllo della fase di riepitilizzazione iper-proliferazione dei cheratinociti (non c‟è
inibizione da contatto) formazione di cisti epidermidi;
2) Eccessivo deposito di collagene cicatrice ipertrofica fino al cheloide (cicatrice deturpante che
invade il tessuto circostante della ferita.
Fattori predisponenti la formazione del cheloide sono:
a) Razza nera;
b) Squilibri nella produzione di alcune citochine;
c) Estensione della ferita.
Fattori in grado di interferire con un corretto processo di guarigione: fattori locali come infezioni
batteriche (iper-proliferazione cellule epiteliali e fibroblasti), insufficiente apporto ematico, notevole
estensione dell‟area lesionata, presenza di corpi estranei (prolungato stato infiammatorio) e fattori
sistemici come età (fisiologico calo della capacità proliferativa del tessuto leso), patologie che
compromettono la vascolarizzazione dell‟area lesionata (aterosclerosi, diabete mellito, trombosi
necrose), malnutrizioni e ipoprotidemia che rallentano la riparazione alterando la deposizione del
collagene.
LESIONI GASTRO-INTESTINALI
- Uguali a ferite cutanee;
- Presenza di peptidi trifoglio con ponti disolfuro che resistono agli acidi.
www.slidetube.it
http://slidetube.jimdo.com