APPUNTI DI CHIMICA
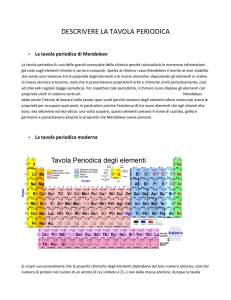
Tavola periodica
Prof.ssa Patrizia Moscatelli Liceo Scientifico Statale Vito Volterra Pagina 1 di 13
1 . Primi tentativi di classificazione
Fino al 1600 erano conosciuti solo pochi elementi, gli
elementi “nativi”, come ferro, rame, oro, argento,
mercurio, carbonio, piombo, arsenico e pochi altri. Gli
alchimisti per rappresentarli usavano simboli astratti e
complessi, estremamente variabili da luogo a luogo e nel
tempo. Solo ai primi dell'ottocento (1803), lo scienziato
inglese Dalton elaborò una prima teoria atomica (atomo di
Dalton, indivisibile) e cercò di dare un ordine agli elementi
allora conosciuti, organizzando una prima rudimentale
tavola periodica, nella quale sistemò i vari atomi in
base ai loro pesi atomici riferiti all'idrogeno (calcolati
però in modo ancora rudimentale); Dalton cercò anche una
rappresentazione più semplice degli atomi, inscrivendo in
un cerchietto simboli diversi per i diversi elementi. Per tale
lavoro e per il lavoro sulle leggi ponderali (legge delle
proporzioni multiple) Dalton è detto “il padre della
chimica”.
Johann Wolfgang Döbereiner
Fra i primi scienziati che tentarono di mettere ordine fra gli elementi noti vi fu il
chimico tedesco Johann Wolfgang Döbereiner (1780-1849). Egli nel 1828 aveva
osservato che il bromo, un elemento scoperto due anni prima, era dotato di proprietà
che sembravano essere intermedie fra quelle del cloro e quelle dello iodio. Non solo si
notava in questi tre elementi una graduale variazione di alcune proprietà come il
colore e la reattività, ma si era osservato anche che il peso atomico del bromo si
trovava a metà strada fra quello del cloro e quello dello iodio. Poteva trattarsi di una
coincidenza? Döbereiner andò alla ricerca di altri gruppi di tre elementi le cui
proprietà si disponessero secondo una variazione regolare e in effetti notò che si
assomigliavano fra loro anche litio, sodio e potassio, magnesio, calcio e stronzio.
Propose allora la "teoria delle triadi" ma non riuscì a catalogare tutti gli elementi allora
conosciuti (poco più di cinquanta) in triadi e molte masse atomiche erano ancora
incerte, pertanto il suo lavoro non fu molto apprezzato anche perchè questo tipo di
classificazione non aveva carattere generale in quanto si limitava all'analisi separata di
pochi gruppi di elementi.
APPUNTI DI CHIMICA
Tavola periodica
Prof.ssa Patrizia Moscatelli Liceo Scientifico Statale Vito Volterra Pagina 2 di 13
Primo Congresso Chimico Internazionale
Dopo i primi infruttuosi tentativi nella prima metà del diciannovesimo secolo ci
si rese conto che sperare di mettere ordine fra gli elementi era illusorio, in quanto vi
era molta confusione relativamente ai loro pesi e al numero degli atomi presenti all’interno dei composti tanto che, spesso per uno stesso composto, venivano proposte
formule del tutto diverse. Per fare chiarezza sull’argomento si
decise allora di organizzare una conferenza di chimici di tutta Europa. Nel 1860 fu pertanto indetto, per la prima volta nella storia
della scienza, un convegno internazionale che prese il nome di
Primo Congresso Chimico Internazionale e si tenne a Karlsruhe in
Germania. Vi presero parte circa centotrenta delegati i quali
tuttavia si limitarono a discutere problemi generali della chimica
che non portarono ad alcuna decisione positiva. In mezzo a tanto
grigiore ebbe però notevole successo la relazione di Stanislao
Cannizzaro, professore di chimica presso la Regia Università di Genova, il quale
difese il principio di Avogadro (1811) che affermava:
- Volumi uguali di gas diversi, nelle stesse condizioni di
pressione e temperatura contengono lo stesso numero di
molecole.
Sulla base di tale principio Cannizzaro determinava il
peso atomico degli elementi, rapportandolo con quello
dell’idrogeno preso come riferimento. Tale metodo permetteva di raggiungere risultati
estremamente precisi.
Alla fine del congresso, quando i chimici si accinsero a tornare ai loro paesi nello
stesso stato di confusione di idee di quando erano arrivati, Cannizzaro distribuì le
dispense che utilizzava durante il corso di chimica che teneva a Genova. In esse erano
espressi chiaramente i risultati a cui si sarebbe pervenuti accettando l’ipotesi di
Avogadro nella sua totalità. “Fu come se un velo mi fosse calato dagli occhi –
commentò il celebre chimico tedesco Julius Lothar Meyer (1830-1895), – sparirono in
me tutte le incertezze e al loro posto subentrava la chiarezza piena di armonia”.
J. A. Reina Newlands
E fu proprio in seguito ai risultati scaturiti dal Congresso di Karlsruhe che il chimico
inglese J. A. Reina Newlands (1837-1898) propose un sistema di classificazione
basato sul peso atomico. Egli,
disponendo gli elementi per peso
atomico crescente, aveva notato
che, con cadenza regolare, ad
ogni otto di essi si ripetevano
proprietà simili. Newlands, che
aveva
avuto
un’educazione
musicale,
chiamò
questa
relazione "Legge delle ottave"
per analogia con la scala
musicale in cui l'ottava nota dà
una percezione simile alla prima. Disponendo gli elementi in colonne verticali di sette
unità quelli simili si venivano a trovare sistemati sulle stesse righe orizzontali. Il
potassio, ad esempio, veniva a trovarsi vicino al sodio, il cloro cadeva sulla stessa riga
APPUNTI DI CHIMICA
Tavola periodica
Prof.ssa Patrizia Moscatelli Liceo Scientifico Statale Vito Volterra Pagina 3 di 13
di bromo e iodio e il magnesio si sistemava a fianco del calcio. In altre parole, le triadi
scoperte da Döbereiner si posizionavano spontaneamente su righe orizzontali. La sua
proposta però venne accolta con scetticismo, da qualcuno addirittura ridicolizzata, e
alla fine fu scartata, anche perché non tutte le righe contenevano elementi con
proprietà effettivamente simili.
Tale classificazione conteneva invece il germe del criterio ordinatore che in seguito
si sarebbe dimostrato quello giusto e infatti, molti anni più tardi, quando la Tavola
Periodica di Mendeleev era stata universalmente accettata, il lavoro del chimico
inglese
ebbe
riconoscimento
ufficiale.
Julius Lothar Meyer
Non conseguì miglior fortuna il
chimico tedesco Meyer il quale,
mettendo in correlazione la massa atomica con i volumi atomici
(in pratica con le dimensioni degli atomi), ottenne un grafico nel
quale un certo numero di proprietà fisiche relative ai singoli elementi si ripetevano con regolarità. Il grafico difatti presentava
con regolarità picchi massimi e
minimi e gli elementi che occupano sia i punti di valore massimo che quelli minimi mostravano comportamenti chimici analoghi. Purtroppo Meyer
non riuscì però a spiegarne il
motivo. Nel rispetto comunque di
tale periodicità riscontrata, ordinò
gli elementi conosciuti rispettando
la massa atomica crescente e
lasciando spazi vuoti per quelli non
conosciuti. Il suo lavoro, per un
ritardo nella pubblicazione, fu noto
solo nel 1870: troppo tardi, perché
un anno prima il chimico russo
Dimitri
Ivanovich
Mendeleev
(1834-1907) aveva pubblicato un lavoro analogo.
Dmitrij Ivanovič Mendeleev
Nel 1869 infatti Mendeleev pubblicò la sua "Tavola Periodica", una costruzione
scientifica che rappresentò un lavoro di enorme importanza sia dal punto di vista
pratico che teorico.
-
Pratico perchè l'opera di Mendeleev costituì la base della chimica moderna, fornendo non solo un quadro sintetico di tutti gli elementi noti, ma considerando anche analogie e differenze di comportamento in modo schematico
Teorico per il modello di indubbio valore e significato scientifico. (Si consideri che
venne prodotta quando le conoscenze sulla struttura intima della materia erano
APPUNTI DI CHIMICA
Tavola periodica
Prof.ssa Patrizia Moscatelli Liceo Scientifico Statale Vito Volterra Pagina 4 di 13
ancora molto scarse)
Il merito della scoperta
della Tavola Periodica venne
attribuito a Mendeleev invece
che a Meyer non già per una
semplice questione legata al
ritardo della pubblicazione da
parte dell’editore, ma per l’uso
sensazionale che il chimico
russo seppe fare del suo lavoro. Egli, con i pochi dati di osservazione di cui disponeva,
dimostrando però doti di intuito veramente sorprendenti,
riuscì ad ordinare i sessantatre elementi chimici noti a quel tempo in modo logico e
coerente. Dallo schema proposto da Mendeleev trasse poi origine tutta una serie di
applicazioni e di ricerche chimiche di gran lunga superiore alle poche nozioni
sperimentali su cui il sistema stesso era stato edificato.
Si riconosce a Mendeleev di:
1) aver pensato, come effettivamente sarà, che le righe (periodi) non avrebbero
dovuto avere tutte la stessa lunghezza
2) aver per prima cosa considerato le proprietà chimiche degli elementi, nella loro effettiva distribuzione lungo le righe, anche quando questa disposizione appariva in
contrasto con l’ordine di massa atomica
3) aver previsto l’esistenza e alcune proprietà di
scoperti
elementi chimici allora non ancora
2 . Il sistema periodico di Mendeleev
Mendeleev, disponendo gli elementi in funzione del loro peso atomico crescente, notò
che si venivano a formare spontaneamente, ad intervalli fissi e ricorrenti, gruppi di
essi con proprietà chimiche e fisiche comuni. Mendeleev racconta di avere scritto le
proprietà degli atomi (densità, peso atomico, temperature di fusione e ebollizione) su
cartoncini, e di avere riflettuto continuando a mescolare i cartoncini nei suoi viaggi in
treno in Russia, facendo una sorta di “solitario chimico”, come lo chiamava lui, alla
ricerca di una qualche correlazione. Fu però solo dopo il convegno di Karlsruhe nel
1860, grazie al metodo utilizzato da Cannizzaro, che Mendeleev riuscì, con grande
pazienza, a misurare i pesi atomici esatti di molti elementi ed a organizzarli: si dice
che Mendeleev la notte del 16 febbraio 1869 abbia sognato gli atomi fino ad allora
conosciuti (circa una sessantina) disposti in una grande tavola, e il giorno dopo
elaborò la sua prima tavola, ordinando gli elementi per gruppi nel rispetto di proprietà
simili. Ad esempio pose il sodio sotto il litio ed il potassio sotto il sodio, e così via.
Da allora si riscontrarono moltissime proprietà periodiche, ragion per cui la tavola
periodica è chiamata “tavola periodica degli elementi” o “tavola di Mendeleev”, in onore allo scienziato.
La tavola periodica di Mendeleev ordinava ancora gli elementi in base alla massa
atomica (ossia a quante volte pesavano di più rispetto all'idrogeno), e li incolonnava
in base alle caratteristiche simili privilegiando però, in alcuni casi, le analogie del
APPUNTI DI CHIMICA
Tavola periodica
Prof.ssa Patrizia Moscatelli Liceo Scientifico Statale Vito Volterra Pagina 5 di 13
gruppo rispetto al peso. Ciò voleva dire che inconsapevolmente lo scienziato russo
suggeriva (nonostante come già detto non si sapesse nulla in quel periodo della
struttura atomica) che l'atomo non poteva considerarsi un semplice blocchetto di
materia inerte, ma doveva possedere una struttura interna ordinata, poiché solo in
questo modo si potevano giustificare le variazioni graduali delle proprietà chimiche e
fisiche degli elementi al crescere del loro peso. Per esempio, litio, sodio e potassio,
che stanno su righe diverse, ma nella stessa colonna, hanno proprietà simili, che non
possono essere spiegate appellandosi semplicemente al crescere del loro peso.
Per capire come Mendeleev operò nella classificazione, confrontiamo la sequenza degli
elementi in una tavola periodica moderna e in quella di Mendeleev.
I
II
III IV
V VI VII VIII
H
Li Be
B C N O F
Na Mg
Al Si P S Cl
K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br
TAVOLA MODERNA
I
II
III IV
V
VI VII
VIII
He
Ne
Ar
Kr
e
e
e
valenza 1
valenza 2
valenza 3
valenza 4
0
H
Li
Na
K
Cu
H
He
elem.di transizione
Be B C N O F
Ne
e
valenza 1
Mg Al Si P S Cl
Ar
e
valenza 2
Ca Sc Ti V Cr Mn Fe Co Ni
e
valenza 3
Zn Ga Ge As Se Br
Kr
valenza 4
TAVOLA di MENDELEEV
Nella prima riga pose da solo l’idrogeno, nella seconda i sette elementi Li, Be, B, C,
N, O, F nel rispetto della massa atomica crescente. Aveva notato che il Litio reagiva
una sola volta con l’Idrogeno (aveva quindi valenza uno. A quell’epoca per valenza si
intendeva quante volte un elemento reagiva con un atomo di idrogeno). Il Berillio
aveva valenza due, il Boro tre, il Carbonio quattro. Dopo tale valore la valenza andava
a decrescere. L’Azoto quindi tre, l’Ossigeno due, il Fluoro uno. Gli elementi successivi
Na, Mg, Al, Si, P, S, Cl venivano disposti in terza fila rispettando le analogie di
valenza con quelli della colonna di appartenenza: così il Sodio (Na) sotto il Litio in
quanto aveva valenza uno, il Magnesio (Mg) sotto il Berillio per la valenza due e via
dicendo. Al quarto periodo il Potassio (K) sotto il sodio, il Calcio (Ca) sotto il Magnesio,
lo Scandio (Sc) ancora non si conosceva ed il Titanio (Ti) a valenza quattro non si
allineava sotto l’alluminio, pertanto Mendeleev lasciò uno spazio vuoto, proseguendo
con Ti, V, Cr, Mn.
La triade ferro, nichel e cobalto presentava caratteristiche fisiche e
chimiche tanto simili da indurre il chimico russo a sistemarli tutti e
tre in un'unica casella, dopo il manganese, inaugurando, in questo
modo, un'ottava colonna. Lo studio accurato di questi tre elementi e dei loro composti
lo indusse inoltre ad invertire di posto nichel e cobalto, sistemando nell'ottava colonna
i tre elementi nel seguente ordine: ferro, cobalto e nichel. Il criterio di privilegiare le
caratteristiche chimiche piuttosto che la sequenza crescente delle masse atomiche fu
applicato anche in altri casi come ad esempio per lo iodio ed il tellurio.
Dopo la triade venivano in sequenza rame (Cu) e zinco (Zn) che furono
ordinati rispettivamente al primo e secondo gruppo, nel rispetto del
APPUNTI DI CHIMICA
Tavola periodica
Prof.ssa Patrizia Moscatelli Liceo Scientifico Statale Vito Volterra Pagina 6 di 13
criterio di valenza già adottato, anche se le caratteristiche di questi elementi erano
molto lontane da quelle del gruppo di appartenenza. Pose di seguito due spazi vuoti
per gli elementi allora sconosciuti Gallio e Germanio e completò il periodo con As, Se e
Br.
Questa iniziale classificazione fu successivamente rettificata perché gli elementi dallo
scandio allo zinco, in tutto dieci, male si incolonnavano nei sette gruppi iniziali,
pertanto Mendeleev ritenne opportuno spostare leggermente detti elementi,
sdoppiando in pratica ciascun gruppo in due sottogruppi. Agli elementi di questo
secondo gruppo fu dato il nome di elementi di transizione.
Un’ulteriore conferma della validità del Sistema Periodico di Mendeleev si ebbe
quando vennero scoperti gli elementi mancanti per i quali era stata già prevista la
sistemazione. Questi elementi vennero chiamati scandio (Sc) (nominato da Mendeleev
l’eka-boro perché reagiva tre volte con l’idrogeno come il boro), gallio (Ga) (l’ekaalluminio) e germanio (Ge) (l’eka-silicio) in onore della patria dei loro scopritori,
rispettivamente la Scandinavia, la Francia e la Germania.
Negli anni a seguire vennero scoperti nuovi elementi chimici tra cui alcuni gas
nobili come (He, Ne e Ar), e quindi venne aggiunto alla tavola periodica il gruppo O,
dove in seguito vennero situati tutti i gas nobili che via via vennero scoperti.
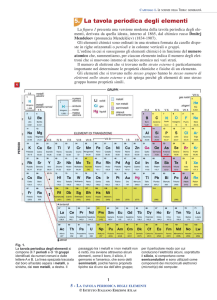
3 . Il sistema periodico in forma moderna
La moderna Tavola Periodica degli elementi è stata ottenuta tenendo conto anche
delle conoscenze della struttura atomica effettuate
all'inizio dello scorso secolo. Essa ricalca, nelle linee
essenziali, la precedente Tavola di Mendeleev,
conservando la suddivisione in periodi e gruppi, ma
si arricchisce ulteriormente di una struttura a
blocchi.
Nel 1968 Seaborg scorporò dalla tavola gli elementi
delle terre rare (lantanidi ed attinidi), dandole la
struttura moderna. Molti elementi vengono tutt'ora
scoperti, generandoli per pochi secondi negli
acceleratori di particelle (Acceleratore Lhc di
Ginevra), anche se sono fortemente instabili e
riescono a sopravvivere solo per pochi secondi.
La tavola periodica è organizzata in colonne dette
gruppi ed in righe dette periodi. Lungo ogni gruppo troviamo elementi che
presentano caratteristiche chimico fisiche analoghe, e questo è ovvio se consideriamo
che hanno stessa configurazione elettronica esterna; così gli elementi del primo
gruppo avranno un solo elettrone all’ultimo livello, quelli del secondo due, quelli del
terzo tre…
Il periodo invece corrisponde all’ultimo livello energetico occupato dagli elettroni,
chiaramente va da uno a sette, analogamente con il numero quantico principale n. Gli
elementi sono ordinati per numero atomico crescente, cioè dall’idrogeno che ha un
solo elettrone all’elio che ne ha due, al litio che ne ha tre e via dicendo.
APPUNTI DI CHIMICA
Tavola periodica
Prof.ssa Patrizia Moscatelli Liceo Scientifico Statale Vito Volterra Pagina 7 di 13
Come gli elettroni rispettano i criteri
energetici per il riempimento degli
orbitali, così nella tavola troveremo a
sinistra lungo la prima e seconda
colonna (primo e secondo gruppo) gli
elementi che riempiono il sottolivello
s, a destra quelli che riempiono il
sottolivello p, al centro quelli che
riempiono i sottolivelli d ed f.
I gruppi vengono indicati in due modi
diversi, o con i numeri arabi, pertanto
partendo da sinistra la numerazione
procede da 1 a 18, oppure con numeri arabi seguiti dalla lettera A o B. I blocchi “s” e
“p” vengono numerati da IA ad VIIIA partendo da sinistra, quelli “d” da IB ad VIIIB.
Per la numerazione del blocco B c’è da fare una nota. Si inizia con il IIIB, in quanto gli
elementi di tale colonna come quelli del gruppo IIIA perdono facilmente tre elettroni,
segue il IVB per l’analogia
con gli elementi del gruppo
IVA in quanto facilmente
gli elementi di tale colonna
perdono quattro elettroni,
così via fino al VIIB.
L'VIIIB comprende le tre
colonne del Fe-Co-Ni, data
la similitudine tra i tre,
come già indicato da
Mendellev, segue il IB i
cui elementi tendono a
perdere 1 elettrone e IIB
che tende a perderne due.
Nomi particolari di gruppi e periodi
Nella tavola alcuni gruppi hanno anche nomi particolari, che derivano dalla storia della
chimica.
Gli elementi del I gruppo sono
detti anche “metalli alcalini”,
metalli in quanto facilmente cedono elettroni dell’ultimo livello,
alcalini per il loro carattere basico.
Sono presenti nelle pile alcaline
(es. Na, Li); quelli del II gruppo
“metalli alcalino-terrosi” per
l'abbondanza nella terra (es.
calcare); quelli del III gruppo
“terrosi”; “pnicogeni” da generatori di asfissia; “calcogeni” dal greco rame o ottone in quanto tali metalli si
ricavavano da ossidi e solfuri, quelli del VII gruppo “alogeni” , termine che in greco
significa “generatori di sali”, infatti molti sali come il sale da cucina, cloruro di sodio,
derivano dalla facile reazione di questi elementi con diversi metalli. Infine gli elementi
APPUNTI DI CHIMICA
Tavola periodica
Prof.ssa Patrizia Moscatelli Liceo Scientifico Statale Vito Volterra Pagina 8 di 13
dell' VIII gruppo “gas nobili” (o gas inerti, per la scarsa tendenza a combinarsi con
altri elementi.
I II
EL. TRANSUR.
III IV V VI VII VIII
*
°
1
2
3
4
5
6
7
*
°
6 LANTANIDI (TERRE RARE)
7 ATTINIDI
U
PERIODO PICCOLISSIMO
PERIODO PICCOLO
PERIODO PICCOLO
PERIODO LUNGO
PERIODO LUNGO
PERIODO LUNGHISSIMO
P.LUNGHISSIMO (INCOMPL.)
I periodi non hanno nomi particolari a parte:
- i metalli del blocco d, che sono detti “elementi di transizione”, perché presentano
proprietà intermedie agli elementi dell'estrema destra e sinistra della tavola
- Gli elementi del blocco f, che sono detti “elementi di transizione interni”. In tale
blocco si evidenziano due periodi: lantanidi detti anche elementi delle “terre rare” e
gli attinidi in quanto seguono rispettivamente il lantanio e l’attinio, inserendosi
quindi al sesto e settimo periodo.
Il primo periodo è detto piccolissimo (o cortissimo) ed è formato di soli due
elementi, l'idrogeno e l'elio; nei rispettivi atomi gli elettroni occupano l'orbitale s del
primo livello energetico.
Il secondo e terzo periodo sono detti piccoli (o corti) e sono formati di otto
elementi ciascuno. Nei rispettivi atomi gli elettroni occupano i tre orbitali p del
secondo e del terzo livello energetico, oltre che gli orbitali di tipo s più interni.
Entrambi questi periodi iniziano con un metallo alcalino (litio e sodio, rispettivamente)
e terminano con un gas inerte (neo e argo), con configurazione elettronica esterna
s²p6, identica per entrambi.
Seguono due grandi (o lunghi) periodi di 18 elementi ciascuno. Il primo di questi (il
quarto in assoluto) inizia con il potassio (metallo alcalino) e termina con il kripto (gas
nobile), mentre il secondo (il quinto in assoluto) va dal rubidio (metallo alcalino) allo
xeno (gas nobile). In queste successioni di atomi, tra gli orbitali s e p, si inseriscono
gli orbitali di tipo d che possono accogliere 10 elettroni. Ad essi corrispondono 10
elementi: i cosiddetti elementi di transizione. Si ricorderà che nella rappresentazione
di Mendeleev gli elementi di transizione si trovavano in posizione atipica, mentre ora,
come si può vedere, risultano organicamente inquadrati fra gli altri.
Il sesto periodo viene designato con il nome di grandissimo (o lunghissimo) e
contiene 32 elementi. Qui compaiono atomi che presentano elettroni sugli orbitali di
tipo f. Gli orbitali di tipo f sono 7 e possono accogliere complessivamente 14 elettroni.
Ad essi corrispondono 14 elementi, i cosiddetti Lantanidi, che presentano
caratteristiche molto simili fra loro, tanto che a rigore dovrebbero occupare tutti la
stessa casella, cioè quella del lantanio, il 57° elemento.
Le terre rare, o lantanidi, costituiscono una serie di elementi che in questi ultimi anni
stanno assumendo grande importanza commerciale e industriale per la produzione di
magneti permanenti, di componenti dei televisori, di telefoni cellulari, ecc… Per
esempio, l'indio è utilizzato per smartphone e pannelli fotovoltaici.
APPUNTI DI CHIMICA
Tavola periodica
Prof.ssa Patrizia Moscatelli Liceo Scientifico Statale Vito Volterra Pagina 9 di 13
La lampadina a risparmio energetico
illumina perché ha un rivestimento
interno di lantanio, cerio, europio e
terbio. Il lantanio viene utilizzato
anche per obiettivi di macchine
fotografiche ed altre lenti (vedi immagine dove operaio della Mongolia
versa il lantanio). Lo schermo
touch-screen è possibile
grazie
all'indio, che è trasparente e, contemporaneamente, conduce l'elettricità; pesa poco perchè c'è l'afnio
utilizzato per chip sempre più piccoli
e il tantalio per immagazzinare l'energia. Il televisore è a colori grazie
all'europio (dà il rosso e il blu), il terbio (giallo e verde) con la collaborazione
dell'ittrio. Il personal computer è così sottile e leggero, grazie al neodimio per i
magneti, il tantalio per conservare energia, il disprosio per l'hard disc. E le tonnellate
di bit che si ricevono le dobbiamo soprattutto all'erbio che accelera le comunicazioni
via fibra ottica.
La loro nomenclatura non deve in ogni caso trarre in inganno, in quanto le terre rare
non sono poi così introvabili sulla superficie terrestre. In genere questi minerali, sono
difficili da estrarre sia perché necessitano di procedure inquinanti per la loro
raffinazione, sia perché sono mischiati ad elementi radioattivi.
Per questo motivo nei Paesi occidentali è stata sospesa la loro estrazione, mentre la
Cina (solo quest’ultima è disposta ad affrontare i costi e i vincoli di inquinamento
ambientale che comporta l’estrazione) ha aumentato la propria produzione divenendo
un Paese monopolista a livello globale. E’ per tale motivo che le sorti attuali
dell’approvvigionamento mondiale di terre rare, sono in buona misura legate al
monopolio cinese dell’estrazione e della produzione di questi minerali.
Questa situazione, nell’arco di un decennio, sta diventando insostenibile in quanto la
Cina utilizza il monopolio acquisito come arma economica nei confronti degli altri
concorrenti. Inoltre, innalzando i prezzi delle terre rare, il Paese asiatico intende
preservare le sue riserve.
Vi sono quindi ragioni di tipo politico ed economico che spingono diversi Paesi tra cui
Stati Uniti, Giappone, Corea del Sud ed Unione Europea, alla ricerca di fonti
alternative a questi materiali.
Oltre che negli stessi Stati Uniti, le ricerche di fonti alternative di terre rare si stanno
concentrando in Brasile, in alcuni Paesi asiatici come il Vietnam, e in Australia
L'ultimo periodo, il settimo, è detto incompleto perché dovrebbe contenere 32
elementi come quello precedente, ma per il momento risulta monco. Esso inizia, come
tutti gli altri periodi con un metallo alcalino, il francio, ma termina prima di arrivare al
gas nobile, elemento che dovrebbe avere il numero 118.
4 . Proprietà periodiche nella tavola
Si analizzeranno nella tavola le variazioni di volume, di energia e di reattività degli
elementi lungo i gruppi ed i periodi.
APPUNTI DI CHIMICA
Tavola periodica
Prof.ssa Patrizia Moscatelli Liceo Scientifico Statale Vito Volterra Pagina 10 di 13
Raggio atomico
Procedendo
lungo
un
gruppo il raggio atomico
aumenta.
Ciò è ovvio se si pensa
che lungo un gruppo aumenta il livello energetico,
gli elettroni sono quindi
più lontani dal nucleo.
Lungo un periodo invece il
volume
diminuisce.
Ci
muoviamo nell’ambito dello stesso livello energetico, ma proseguendo verso destra, aumentano gli
elettroni da elemento ad
elemento.
Allo
stesso
tempo aumentano anche
le cariche positive del nucleo, che esercitano un’attrazione sempre maggiore
nei riguardi degli elettroni esterni.
Nel
passaggio
da
specie
atomica neutra a ione positivo
o catione il volume diminuisce,
perché non solo aumenta
l’attrazione del nucleo nei
riguardi degli elettroni che
sono in numero minore, ma
anche perché spesso l’atomo
elimina tutti gli elettroni del
livello esterno.
In questo
modo lo ione acquisisce una
maggiore stabilità in quanto
mantiene una configurazione
elettronica estena completa al
livello energetico inferiore.
Nel
passaggio
da
specie
atomica neutra a ione negativo o anione il volume aumenta, in quanto i protoni,
inferiori di numero agli elettroni, esercitano su questi una forza attrattiva minore.
Energia di ionizzazione
Si definisce energia di ionizzazione o potenziale di ionizzazione l’energia necessaria
per allontanare uno o più elettroni dal livello energetico esterno.
Lungo un gruppo, come abbiamo già detto, il volume atomico aumenta. Gli elettroni,
con il crescere del numero atomico ocupano livelli a contenuto energetico sempre
maggiore e quindi a distanze dal nucleo crescenti. L’azione attrattiva dei protoni
APPUNTI DI CHIMICA
Tavola periodica
Prof.ssa Patrizia Moscatelli Liceo Scientifico Statale Vito Volterra Pagina 11 di 13
agisce quindi con minore
intensità, pertanto allontanare l’elettrone esterno risulta
sempre meno dispendioso
sotto il profilo energetico.
Lungo il periodo, la diminuzione del volume è responsabile di una maggiore forza
attrattiva del nucleo. L’energia di ionizzazione richiesta
aumenta man mano che il
volume atomico si riduce.
Possiamo affermare che l’energia di ionizzazione è pertanto inversamente proporzionale al volume.
I gas perfetti, avendo l’ultimo livello energetico completo, hanno una stabilità che
contrasta l’allontanamento degli elettroni, pertanto richiedono un’altissima energia di
ionizzazione.
Si definisce energia di seconda o di terza ionizzazione l’energia che occorre per
allontanare un secondo o un ulteriore terzo elettrone. E’ chiaro che, per uno stesso
elemento, l’energia di seconda o terza ionizzazione aumenta con l’aumentare degli
elettroni sottratti al guscio esterno, in quanto, avendo già sottratto un elettrone, la
specie non si presenta più neutra ma con carica positiva, pertanto le operazioni
successive di allontanamento degli elettroni, risulteranno sempre più difficili.
Elettronegatività
Si definisce elettronegatività la capacità che ha un atomo
di attirare a sé gli elettroni di legame.
A differenza dell’energia di ionizzazione e dell’affinità
elettronica che sono proprietà periodiche riguardanti una
specie isolata, qui l’elettronegatività riguarda specie
associate e quindi entità che non sono singole. Nelle
specie isolate gli elettroni girano in orbitali atomici,
quando contraggono un legame mettendo in comune gli
elettroni dell’ultimo livello, gli elettroni ruoteranno intorno
a tutta la molecola e quindi in orbitali molecolari. Gli
elettroni condivisi ruotando intorno alle due specie
chimiche saranno attratti dal nucleo più vicino rispetto a
quello più lontano e quindi dall’elemento a volume
atomico minore. Diremo quindi che lungo un gruppo l’elettronegatività diminuisce,
lungo un periodo aumenta. E’ inversamente proporzionale al volume come nel caso
del potenziale di ionizzazione.
Dobbiamo però fare attenzione. Le scale che riportano i valori di elettronegatività sono
basate sul confronto di molecole biatomiche associate con l’idrogeno. Si prende
l’idrogeno come riferimento per il suo valore intermedio di elettronegatività tra metalli
e non metalli (2,1 sulla scala di Pauling). Qualora dovessero legarsi specie chimiche
diverse dall’idrogeno, la scala va utilizzata qualitativamente, cioè permetterà di capire
quali tra i due elementi ha più elettronegatività, ma non rispetterà quantitativamente i
valori riportati dalla tavola dato che l’elettronegatività di un elemento varia a seconda
di quali e quanti elementi gli sono legati. Secondo le modalità descritte di variazione di
elettronegatività nella tavola, possiamo affermare che gli elementi meno
APPUNTI DI CHIMICA
Tavola periodica
Prof.ssa Patrizia Moscatelli Liceo Scientifico Statale Vito Volterra Pagina 12 di 13
elettronegativi saranno posizionati in
basso
a
sinistra
e
quelli
più
elettronegativi in alto a destra (Non si
considerano i gas perfetti che hanno
elettronegatività zero). I comportamenti
risultano più sfumati nelle zone centrali
ed in quelle di confine tra metalli e non
metalli. I metalli saranno sempre
caratterizzati da bassa elettronegatività e
i non metalli da alta.
Affinità elettronica
E’ l’energia sviluppata quando un atomo accetta un elettrone.
Un valore positivo dell’affinità elettronica indica che tale energia viene rilasciata quando l’elettrone si lega a un atomo, mentre un valore negativo dice che per aggiungere
l’elettrone all’atomo è necessario fornire energia.
La figura mostra come varia l’affinità elettronica nell’ambito dei gruppi e dei periodi;
si noterà che l’andamento è meno chiaramente periodico rispetto ai casi del raggio e
dell’energia di ionizzazione. La tendenza è comunque percepibile, fatta eccezione per i
gas nobili:
le affinità elettroniche decrescono lungo un gruppo e aumentano lungo un periodo,
difatti sono più elevate verso la porzione superiore destra della tavola periodica.
Il motivo è legato alla configurazione elettronica esterna oltre alla distanza dell’elettrone dal nucleo. E’ chiaro che più l’elettrone è vicino al nucleo e maggiore sarà la
tendenza di accettarlo, l’atomo in questo caso si stabilizza portandosi a bassi livelli
energetici, cioè cedendo energia. Parallelamente va considerato che, se ad un
elemento manca un elettrone
per
completare
il
livello
l’atomo avrà una maggiore
tendenza ad accettarlo.
L’andamento difatti è particolarmente visibile nella parte
superiore in prossimità dell’ossigeno, dello zolfo e degli alogeni. I gas nobili manifestano
affinità elettronica negativa
perché un elettrone che vi si
addizioni dovrà occupare un
orbitale esterno a un livello
completo e lontano dal nucleo:
tale processo richiede energia,
e quindi l’affinità elettronica
risulta negativa.
Gli atomi del gruppo 16/VI co-me O o S hanno due singoletti negli orbitali p del
proprio strato di valenza e possono perciò accettare ben due elettroni. L’affinità
elettronica primaria è positiva, perché nel momento in cui l’elettrone si lega a O o a S
si libera energia. Al contrario, l’aggiunta del secondo elettrone richiede energia, a
causa della repulsione esercitata dalla carica negativa già presente in O– e in S–. Di
fatto, quando all’atomo (neutro) O si lega il primo elettrone formando O–, si liberano
141 kJ · mol–1, mentre occorrono 844 kJ · mol–1 per aggiungere il secondo elettrone e
formare O2–; in ultima analisi, per formare O2– da O occorrono 703 kJ · mol–1.
APPUNTI DI CHIMICA
Tavola periodica
Prof.ssa Patrizia Moscatelli Liceo Scientifico Statale Vito Volterra Pagina 13 di 13
Carattere metallico
Un'altra proprietà che nella tavola varia con periodicità è il carattere metallico. In
chimica il carattere metallico è la capacità di un elemento di cedere elettroni, pertanto
aumenta lungo un gruppo e diminuisce lungo il periodo essendo direttamente
proporzionale al volume.
Hanno quindi bassa affinità elettronica e basso potenziale di ionizzazione.
CARATTERISTICHE DEI METALLI E DEI NON METALLI
Metalli
Non metalli
Proprietà fisiche
Buoni conduttori di calore e elettricità
Cattivi conduttori di calore e elettricità
Malleabili
Non malleabili
Duttili
Non duttili
Lucenti
Non lucenti
Generalmente solidi
Solidi, liquidi o gas
Alti punti di fusione
Bassi punti d fusione
Poco volatili
Volatili
Proprietà chimiche
Reagiscono con gli acidi
Non reagiscono con gli acidi
Formano cationi
Formano anioni
Sono metalli quindi gli elementi del primo e secondo gruppo e gli elementi di
transizione. Non metalli quelli dal IV al VII.
Una prova del fatto che scendendo nel gruppo il carattere metallico aumenta è lo stato
fisico degli alogeni, gli elementi del VII gruppo: scendendo nel VII gruppo si passa
infatti dal fluoro e cloro (gassosi, tipici non metalli) al bromo (liquido) allo iodio un
solido metallico, anche se ancora con forte carattere non metallico.
Gli elementi del III gruppo hanno carattere intermedio , pertanto sono definiti
semimetalli o anfoteri. La linea “a gradini”, un po' calcata, detta “linea degli anfoteri”,
divide i metalli (a sinistra) dai non metalli (a destra).
Tutti gli elementi che toccano tale linea sono detti “anfoteri” o “semimetalli”,