DESCRIVERE LA TAVOLA PERIODICA •
La tavola periodica di Mendeleev La tavola periodica fu una delle grandi concquiste della chimica perchè razionalizzò le numerose informazioni già note sugli elementi chimici e sui loro composti. Spetta al chimico russo Mendeleev il merito di aver stabilito che esiste una relazione trà le proprietà degli elementi e le masse atomiche; disponendo gli elementi in ordine di massa atomica crescente, notò che si presentavano proprietà fisiche e chimiche simili periodicamente, cioè ad intervalli regolari (legge periodica). Per rispettare tale periodicità, il chimico russo dispose gli elementi con proprietà simili in colonne verticali. Mendeleev ebbe anche l'intuito di lasciare nella tavola spazi vuoti perchè nessuno degli elementi allora conosciuti aveva le proprietà per occupare quei posti; in particolare previse l'esistenza di tre nuovi elementi che egli chiamò eka-­‐
boro, eka-­‐alluminio ed eka-­‐silicio: una volta scoperti, questi elementi presero il nome di scandio, gallio e germanio e presentavano proprio le proprietà che Mendeleev aveva previsto. •
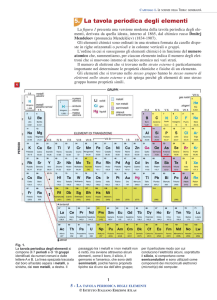
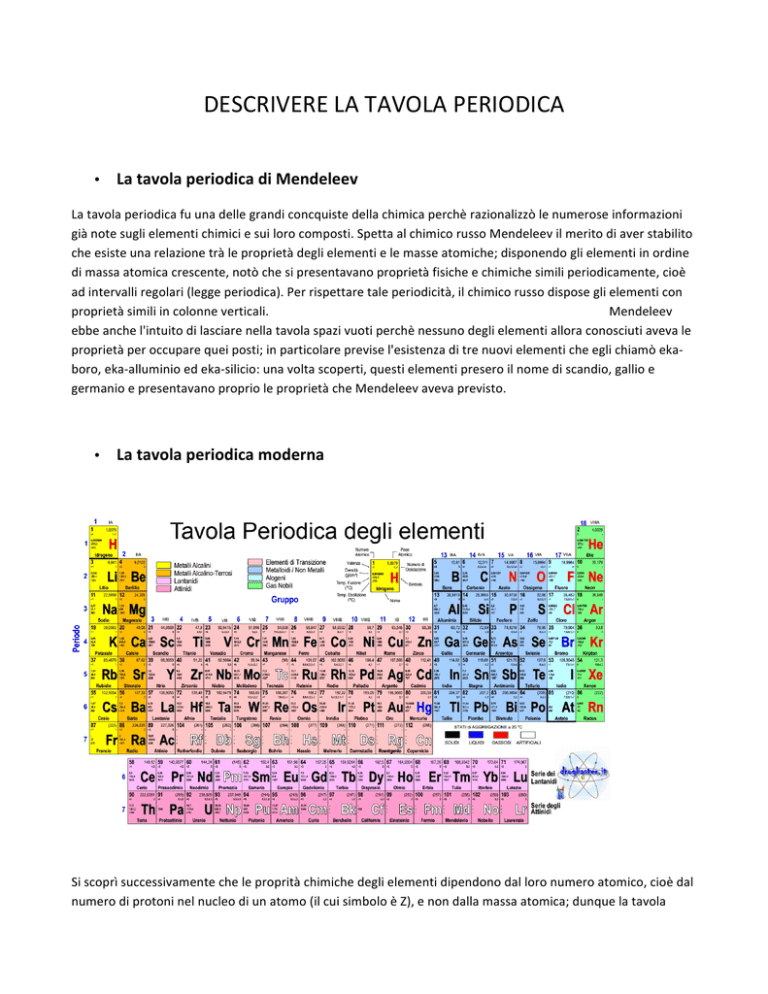
La tavola periodica moderna Si scoprì successivamente che le proprità chimiche degli elementi dipendono dal loro numero atomico, cioè dal numero di protoni nel nucleo di un atomo (il cui simbolo è Z), e non dalla massa atomica; dunque la tavola periodica moderna è stata preparata disponendo gli elementi, rappresentati da un simbolo chimico, secondo il numero atomico crescente. Nelle righe orizzontali della tavola, chiamate periodi, le proprietà degli elementi variano con continuità. Ogni colonna verticale della tavola, detta gruppo, contiene elementi con la stessa configurazione elettronica nel livello più estrerno e, quindi, con proprietà simili. Alcuni gruppi della tavola periodica assumono nomi particolari: -­‐metalli alcalini, gli elementi del gruppo 1A; -­‐metalli alcalino-­‐terrosi, gli elementi del gruppo 2A; -­‐alogeni, gli elementi del gruppo 7A; -­‐gas nobili, gli elementi del gruppo 8A. Nella tavola periodica una linea di demarcazione a "gradini" permette di classificare gli elementi in tre categorie: metalli, non metalli e semimetalli. -­‐ i metalli, alla sinistra della linea di demarcazione, rappresentano la maggior parte degli elementi e sono caratterizzati da proprietà fisiche come: ottima conducibilità termica ed elettrica; malleabilità e duttilità; lucentezza metallica. -­‐ i non metalli, alla destra della linea di demarcazione, sono caratterizzati da propietà opposte a quelle dei metalli. Molti non metalli sono gassosi come l'ossigeno, l'azoto, l'elio, ecc., il bromo è liquido, mentre altri, cone il carbonio o il fosforo, sono solidi. -­‐ gli elementi adiacenti alla linea di demarcazione, che sono chiamati matalloidi o semimetalli, includono il boro, il silicio, il germanio, l'antimonio, il tellurio e l'arsenico. Questi elementi hanno alcune proprietà dei metalli ed altre dei non metalli. La tavola periodica può anche essere suddivisa in elementi dei gruppi principali, collocati in colonne identificate da un numero e dalla lettera A e di cui è possibile prevedere le proprietà basandosi sulla loro posizione nella tavola periodica, ed elementi di transizione, collocati invece in colonne etichettate da un numero e dalla lettera B e le cui proprietà sono meno facilmente deducibili. Durante una reazione chimica gli atomi possono spesso perdere o acquistare elettroni formando degli ioni, ovvero particelle cariche positivamente o negativamente: gli ioni carichi positivamente sono chiamati cationi, mentre quelli carichi negativamente sono chiamati anioni. Se parliamo dei gruppi principali possiamo usare la tavola periodica per prevedere quanti elettroni tendono ad essere persi o acquistati quando si ionizza un atomo di un particolare elemento. Il numero associato con la lettera A a ciascuna colonna dei gruppi principali (da 1 a 8) rappresenta il numero degli elettroni di valenza per gli elementi di quella colonna, cioè gli elettroni più esterni di un atomo che partecipano alla formazione dei legami chimici. Una importante eccezione a tale regola è l'elio che, pur trovandosi nella colonna 8A, ha solo due elettroni di valenza. La chiave per prevedere la carica acquistata da un elemento quando di ionizza è la sua posizione nella tavola periodica rispetto ai gas nobili: gli elementi dei gruppi principali tandono a formare ioni che hanno lo stesso numero di elettroni di valenza del gas nobile più vicino. Quando cerchiamo il gas nobile più vicino possiamo muoverci avanti e indietro nella tavola periodica. In accordo con tale principio, i metalli alcalini (gruppo 1A) tendono a perdere 1 elettrone e a formare ioni 1+, mentre gli alcalino-­‐terrosi (gruppo 2A) tendono a perdere 2 elettroni e quindi a formare ioni 2+. Gli alogeni (gruppo 7A) tendono invece ad acquistare 1 elettrone e a formare ioni 1-­‐.