Prova scritta di CHIMICA E LABORATORIO per geologia del 10-02-2015 (Prof.ssa S. Tuti)
Nome…………………………………..
Cognome……………………………
Matricola……………………………..… e-mail……………………………….
Domanda preliminare. Se non si scrivono correttamente almeno 7 composti il compito non viene
corretto. (10 formule esatte = 3 punti)
acido ipofosforoso, superossido di litio, silicato
di mercurio(II), idrogenosolfato di ammonio, iodito di alluminio, solfuro ferrico, tetraidruro di
carbonio, nitrito rameoso, cianuro di sodio, acido solfidrico
Scrivere la formula chimica dei seguenti composti:
1. Una soluzione formata da 250,0 ml di acqua (d=1.01 g/ml) e 17.2 g di un composto organico X ha una
temperatura di congelamento -0.774°C. La sostanza X è composta dai seguenti elementi nelle percentuali in
peso: C 57.1%, H 4.8%, O 38.1%. Determinare la formula minima e la formula molecolare del composto X
sapendo che la costante crioscopica dell’acqua è 1.86°C mol-1 kg.
T= m kcr i
m = T/Kcr i
Per un composto organico i=1
m = T/Kcr = 0.774 / 1.86 = 0.416
m = g/(MM)(massa solvente)
MM= g /(massa solvente) m = 17.2/(250x1.01)x10-3 * 0.416 = 163.7 g
Moli C = 57.1/12.01 = 4.754
Moli H = 4.8/1.01 = 4.752
Moli O = 38.1/16.00 = 2.381
R= 4.754/2.381=1.997
R= 4.752/2.381=1.996
R= 2.381/2.381=1.000
Formula minima C2H2O MM = 24.02+2.02+16.00 = 42.04g
MM f. molecolare/MM f. minima = 163.7/42.04= 3.89 4
Formula minima C8H8O4
2. Un volume di 15.0 ml di una soluzione acquosa di ammoniaca ha richiesto l’aggiunta di 18.0 mL di
soluzione di acido nitrico 0.25 M per arrivare al punto di equivalenza. Calcolare il pH delle due soluzioni di
partenza. (Kb ammoniaca =1.8x10-5)
Moli H+ = moli OH- = 0.018 x 0.25 = 4.50x10-3
Per la soluzione di acido nitrico (acido forte):
[H+]= [HNO3] = 0.25 M
pH = - log 0.25 = 0.60
per la soluzione di ammoniaca:
[NH3] = 4,50 x10-3/0.015 = 0.300
NH3 + H2O ↔ NH4+ + OHPosso calcolare con approssimazione:
[OH] = √ 0.300*1.8x10-5 = 2.32x10-3
pOH = 2.63
pH = 14-2.63 = 11.37
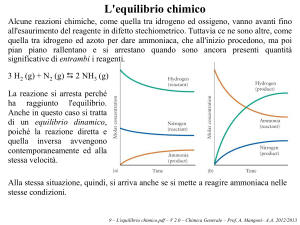
3. In un recipiente inizialmente vuoto viene introdotta una certa quantità di PCl5. A 200°C si dissocia in PCl3
e Cl2. All’equilibrio la miscela contiene il 38% in moli di Cl2 e si trova alla pressione totale di 1.95 atmosfere.
In seguito la pressione viene portata a 10.0 atm. Calcolare la nuova frazione molare dei componenti.
PCl5 ↔ PCl3 + Cl2
38%
38%
24%
Cl2 = (nCl2/ntot) = 38/100 = 0.38
1
PCl3 = n PCl3/ntot = 38/100 = 0.38
PCl5 = n PCl5/ntot = 24/100 = 0.24
Kp = pPCl3 * pCl2 / pPCl5 = (PCl3 *Cl2 / PCl5) P = (( 0.38)2/0.24) 1.95 = 1.17
Aumentando la pressione la reazione si sposta verso i reagenti:
PCl5 ↔ PCl3 + Cl2
0.24+x
0.38-x 0.38-x
Kp = ((0.38-x)2/(0.24+x)] 10.0 = 1.17
(0.38-x)2= 1.17(0.24+x)/10.0
0.144+x2-0.76x=0.0281 + 0.117x
x2 - 0.877x + 0.116 = 0
x1= 0.16 soluzione
x2= 0.71
Cl2 = 0.38–x = 0.38-0.16 = 0.22
PCl3 = 0.38-x = 0.38 – 0.16 = 0.22
PCl5 = 0.24+x = 0.24 + 0.16 = 0.40
4. calcolare l’entalpia della reazione di sintesi del propano C 3H8(g) utilizzando le entalpie delle sequenti
reazioni di combustione :
C3H8(g) + 5 O2
H° = -2220 kJ
C(s) + O2
H° = -394 kJ
H2(g) + ½ O2
H° = -286 kJ
Occorre scrivere la reazione di formazione (o sintesi) del propano: 3C(s) + 4 H2(g) C3H8(g)
E trovare un percorso per ottenerla a partire dalle reazioni di combustione:
3C(s) + 3 O2 3CO2
3CO2(g) + 4 H2O C3H8(g) + 5 O2
4H2(g) + 2 O2 4 H2O
3C(s) + 4 H2(g) C3H8(g)
H°
H°
H°
H°
= 3(-394) = -1182 kJ
= + 2220 kJ
= 4( -286) = - 1144 kJ
= - 106 kJ
5. Calcolare se precipita Zn(OH)2 aggiungendo 1.36 mg di cloruro di zinco a 500 ml di soluzione acquosa a
pH=8. Il prodotto di solubilità dell’idrossido di zinco è 2.0x10-17
[ZnCl] = [Zn+2] = g/MM*V = 1.36x10-3/136,305*0.500=2.00x10-5
pOH = 14-8 = 6
[OH-] = 1.0x10-6
Q = [Zn+][OH-]2 = 2.0x10-5 * 1.0x10-12 = 2.0x10-17 = Kps
Il sistema si trova all’equilibrio: Soluzione satura, quantità massima di sale solubile.
7. Utilizzando il metodo di Lewis (calcolo del numero di legami nella molecola e calcolo della carica formale)
e con il criterio VSEPR si determini la formula e si descriva la geometria molecolare dei seguenti composti:
HNO2, SO3, SnCl2
2