Scheda di autoapprendimento n.10
Soluzione dei quesiti
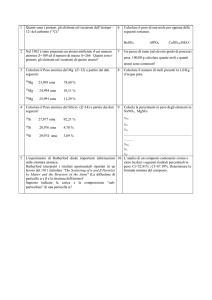
Calcoliamo innanzitutto il numero di moli di ossigeno (nO2) e di azoto (nN2) contenute
nella miscela gassosa. Ricordando che le masse molecolari sono MO2=32 uma e MN2=28
uma, sarà
nO2=20g/(32g/mole)=0,625 moli ; nN2=24g/(28g/mole)=0,857 moli
Usiamo quindi l'equazione di stato dei gas ideali pV=nRT per ricavare la pressione
parziale dei due gas nella bombola, avendo cura di esprimere tutte le grandezze nelle
unità di misura del SI (V=10l=10·10-3m3=10-2m3 e T=25oC=298oK). Quindi
pO2=nO2RT/V= 0,625·8,31·298/10-2 Pa = 1,5·105 Pa
pN2=nN2RT/V= 0,857·8,31·298/10-2 Pa = 2,1·105 Pa
Infine, la pressione totale nella bombola sarà ottenuta come somma delle pressioni
parziali
p=pO2+pN2=3,6·105 Pa atm
Il tempo di dimezzamento di una sorgente radioattiva è quel tempo dopo il quale l'attività
della sorgente diviene la metà. Poichè 1/8 = 1/2·1/2·1/2, l'attività del campione sarà 1/8 di
quella iniziale dopo tre tempi di dimezzamento, ovvero dopo 24 giorni.
Ricordiamo che frequenza f e lunghezza d'onda sono legate dalla relazione f·c, dove
c=3·108 m/s rappresenta la velocità della luce. Pertanto
f=c/3·108m/s)/(10-12m) = 3·1020s-1= 3·1020Hz
L'energia trasportata da un fotone è legata alla frequenza f attraverso la relazione E=h·f,
ove h=6,6·10-34 J·s è la costante di Planck. Quindi
E=h·f=3·1020s-1· 6,6·10-34J·s = 19.8·10-14J = 12,4·105eV = 1,24 MeV
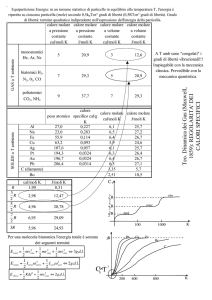
Scriviamo la condizione di conservazione del calore scambiato
c·m1·(70oC-Tf) = c·m2·(Tf-30oC)
dove c rappresenta il calore specifico dell'acqua, m1 ed m2 le masse corrispondenti
rispettivamente ad 1litro e 0,5 litri d'acqua e Tf la temperatura finale all'equilibrio.
Ricordando che m=d·V (d rappresenta la densità dell'acqua e V il volume), si ottiene con
un po di algebra:
Tf=(m1·70oC+ m2·30oC)/(m1+m2) = (V1·70oC+ V2·30oC)/(V1+V2) = 56,67 oC