TUMORI
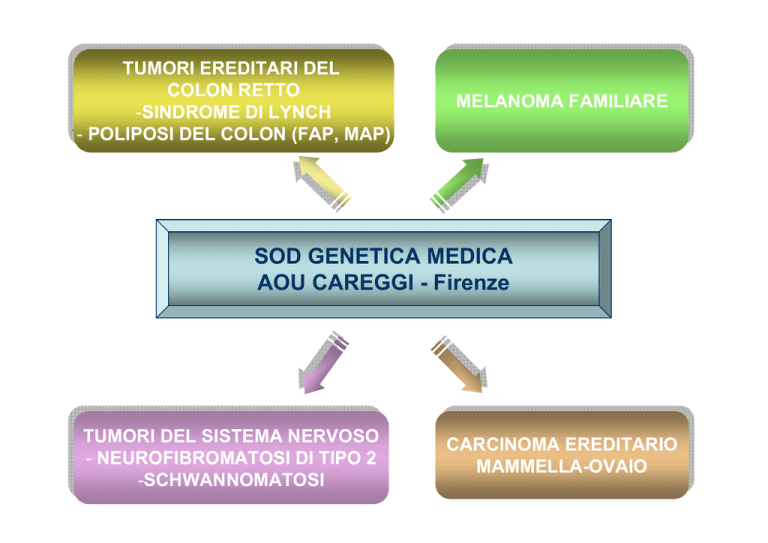
TUMORIEREDITARI
EREDITARIDEL
DEL
COLON
COLONRETTO
RETTO
-SINDROME
-SINDROMEDI
DILYNCH
LYNCH
--POLIPOSI
POLIPOSIDEL
DELCOLON
COLON(FAP,
(FAP,MAP)
MAP)
MELANOMAFAMILIARE
FAMILIARE
MELANOMA
SOD GENETICA MEDICA
AOU CAREGGI - Firenze
TUMORI
TUMORIDEL
DELSISTEMA
SISTEMANERVOSO
NERVOSO
--NEUROFIBROMATOSI
NEUROFIBROMATOSIDI
DITIPO
TIPO22
-SCHWANNOMATOSI
-SCHWANNOMATOSI
CARCINOMAEREDITARIO
EREDITARIO
CARCINOMA
MAMMELLA-OVAIO
MAMMELLA-OVAIO
La maggior parte dei tumori
non è ereditaria
10-15% familiari
5-10% ereditari
75-85% sporadici
INDIVIDUAZIONE SOGGETTI A
RISCHIO
RIDUZIONE MORTALITA
MORTALITA’’
• PREVENZIONE PRIMARIA
– Interventi chirurgici profilattici
– Chemioprevenzione
• PREVENZIONE SECONDARIA
– Programmi specifici di sorveglianza
Sindrome di Lynch
Melanoma Familiare
GENETICA MEDICA
Consulenza genetica
Test instabilità dei
microsatelliti
Ricerca mutazioni geni MLH1
e MSH2
GENETICA MEDICA
Consulenza genetica
Ricerca mutazioni gene
CDKN2A
SORVEGLIANZA CLINICA
Clinica dermatologica
Chirurgia Plastica
SORVEGLIANZA CLINICA
Oncologo o chirurgo di
riferimento
Neurofibromatosi tipo 2, Schwannomatosi
GENETICA MEDICA
Consulenza genetica
Ricerca mutazioni geni NF2 e
SMARCB1
CONSULENTI
Oculisti
Neurochirurghi
Neuroradiologi
UTENTI ESTERNI
AOUC
SCREENING
UTENTI ESTERNI
FOLLOW-UP
AOUC
BREAST UNIT
CORD MAMMELLA
ISPO
CONSULENZA GENETICA
ISPO
SORVEGLIANZA
CLINICA
ISPO
CONSULENZA
PSICOLOGICA
Chirurgoplastico
plastico
Chirurgo
ISPO
EPIDEMIOLOGIA
Ginecologo
Ginecologo
Laparoscopista
Laparoscopista
Chi è a rischio di tumore?
La chiave è nella storia familiare…
INDIZI ………
Aggregazione familiare di specifici tumori
(es. mammella/ovaio; colon/endometrio; ca. midollare della
tiroide/feocromocitoma)
Insorgenza in età precoce
Neoplasie multiple nello stesso individuo
Segni fenotipici caratteristici (cutanei/viscerali)
ATTENZIONE
…..
La storia familiare è inaffidabile ……
Molti pazienti non conoscono i dettagli
– Organo di origine del tumore è spesso
sconosciuto
– Età di esordio spesso non nota
Le informazioni devono essere
verificate per poter stabilire il rischio
con accuratezza.
Pedigree iniziale
Stomach
Ca
Bone Ca Prostate
d. 48 problems
Dopo revisione delle
cartelle
Ovarian Ca
dx 43, d. 49
Breast Ca
dx 45 Prostate Ca
dx 50
d. 48
La storia familiare è dinamica ……
Con il passare del tempo possono
essere state effettuate ulteriori
diagnosi tumorali.
I cambiamenti possono influenzare la
probabilità di una forma ereditaria di
tumore.
Storia iniziale
2 anni dopo ….
Colon Ca, 50
Colon Ca, 50
Endometrial
Ca, 44
Colon polyps, 48
Autosomico Dominante - Penetranza Incompleta
Normale
Carrier
Carrier, affetto
Tumore sporadico
La penetranza è spesso incompleta
Ci può essere un salto di generazione
Gli individui ereditano un “gene di suscettibilità” al tumore,
non il cancro!
CONSULENZA GENETICA
“atto medico che ha come finalità
di informare un individuo o una
famiglia, che sono o ritengono di
essere a rischio di malattia
genetica, sugli aspetti medici e
genetici, sulla diagnosi, prognosi,
terapia della condizione e sul
rischio che la malattia si manifesti
in altri membri della famiglia”
American Society of Human Genetics, 1975
CONSULENZA GENETICA
ONCOLOGICA
SI EREDITA LA PREDISPOSIZIONE
ALLO SVILUPPO DI UNA PARTICOLARE
NEOPLASIA
OBIETTIVI DELLA CONSULENZA
GENETICA ONCOLOGICA
Valutare il rischio individuale di tumore sulla base delle
attuali conoscenze, inclusi i test genetici ove disponibili
Programmare le eventuali misure di sorveglianza clinicostrumentali
Aiutare la persona che la richiede a comprendere le basi
scientifiche su cui si basano sia la stima del rischio sia le
misure di sorveglianza, e ad integrare nel modo migliore
queste informazioni nel proprio vissuto
personale/familiare e nel proprio progetto di vita
CONSULENZA GENETICA
Dalla consulenza genetica scaturiscono scelte complesse:
scelte riproduttive in situazione di rischio;
decisione di conoscere o non conoscere le proprie
caratteristiche genetiche e quindi il rischio di malattia.
Tali scelte non possono essere delegate ad alcuna figura
professionale e richiedono la piena autonomia decisionale,
come condizione essenziale perché l’esito di tali scelte quale che sia – venga integrato nel mondo psicologico ed
etico dell’individuo.
CONSULENZA
CONSULENZA NON
NON DIRETTIVA
DIRETTIVA
Perché viene richiesta la consulenza
genetica oncologica?
Persone sane richiedono la consulenza perché, sulla base
della loro storia familiare, percepiscono il rischio di
sviluppare e/o trasmettere la malattia ai discendenti.
A seconda delle condizioni cliniche i benefici percepiti
dall’individuo di effettuare una consulenza ed un eventuale
test genetico sono:
Medici:
Trattamento precoce
Misure preventive
Se NON a rischio: interruzione delle misure di prevenzione
Personali:
certezza di essere/non essere portatori
Pianificare le scelte di vita
Per il beneficio che ne può derivare ad altri membri della
famiglia
C
O
N
S
U
L
E
N
Z
A
G
E
N
E
T
I
C
A
Anamnesi familiare e personale
Verifica documentazione clinica
Esame obiettivo, indagini di laboratorio/strumentali
Diagnosi
Formulazione rischio a priori
e informazione su storia naturale e aspetti genetici
(Sessione “Educativa”)
Test disponibile
Test non disponibile
PREDISPOSIZIONE
GENETICA A TUMORI
UPDATE APRILE 2004
72 geni clonati
↓
46 condizioni
TUMORE MAMMARIO
Il tumore mammario è frequente .…
In Italia, 1 donna su 10 si ammalerà di tumore
alla mammella nel corso della vita.
Idee sbagliate ……
• I TUMORI DAL LATO PATERNO NON
CONTANO
Metà delle donne ereditano il rischio dal loro padre
• IL CANCRO OVARICO NON RAPPRESENTA
UN FATTORE DI RISCHIO PER QUELLO
MAMMARIO
Il cancro ovarico è un importante indicatore di rischio
ereditario, anche se non sempre è presente
• IL FATTORE PIÙ IMPORTANTE È IL NUMERO
DI DONNE AFFETTE DA TUMORE MAMMARIO
L’età di esordio è più importante
Cause di suscettibilità ereditaria ai
tumori della mammella e dell’ovaio
Sporadico
Ereditario
70%
8%
2%
20%
BRCA1
BRCA2
HNPCC
Single gene disorders
Cause di suscettibilità ereditaria ai
tumori della mammella e dell’ovaio
SINDROME
GENE
TRASMISSIONE
BRCA1
BRCA2
(PALB2)
(BRIP1)
AD
Li-Fraumeni
TP53
AD
Cowden
PTEN
AD
Peutz-Jegher
STK11
AD
HNPCC
MSH2
MLH1
MSH6
PMS2
AD
Hereditary BRC/OvC
TUMORE EREDITARIO DELLA
MAMMELLA - OVAIO
17q21
BRCA1
13q12
BRCA2
BRCA1
BASSO RISCHIO
DI OVC
1
224
ALTO RISCHIO
800
DI OVC
1358
1365
BASSO RISCHIO
DI OVC
1864
BRCA2
BASSO RISCHIO
DI OVC
1
265
637
ALTO RISCHIO
936
DI OVC
2134
2281
BASSO RISCHIO
DI OVC
3419
BRCA1-Associated Cancers:
Risk by age 70
Breast cancer 50-85% (often early age at onset)
Second primary breast cancer 20%-60%
Ovarian cancer 15-45%
Possible increased risk of other
cancers (e.g., prostate)
BRCA2-Associated Cancers:
Risk by age 70
breast cancer
(50-85%) male breast cancer
(6%)
ovarian cancer
(10-20%)
Increased risk of prostate,
laryngeal, and pancreatic
cancers (magnitude unknown)
Rischio relativo (RR) di tumori a varie sedi nei
portatori di mutazioni in BRCA2
(da Breast Cancer Linkage Consortium, 1999)
Rischio Relativo
(95% CI)
P
Cavità orale e faringe
2,26
(1,09-4,58)
0,06
Stomaco
2,59
(1,46-4,61)
0,012
Cistifellea e dotti biliari
4,97
(1,50-16,52)
0,03
Pancreas
3,51
(1,87-6,58)
0,0012
Melanoma maligno
2,58
(1,28-5,17)
0,01
Prostata
4,65
(3,48-6,22)
<0,0001
Tutti i tumori eccetto mammella, ovaio,
e cutanei (non melanomi)
2,45
(2,15-2,78)
<0,0001
Anamnesi familiare e personale
RICOSTRUZIONE DELL’ALBERO
GENEALOGICO
Breast, dx 40
d. 43
d. 83
Ovary, dx 45
d. 47
Prostate, dx 58
Unaffected
44
Breast, dx 33
42
Affected
with cancer
40
Anamnesi familiare e personale
Verifica documentazione clinica
BR 62
BR 62
OvC 70
Metastasi di BRC
75
BR 45
46
BR 45
50
BR 34
Fibroadenoma 34
50
46
TUMORI MAMMARI
BRCA1- associati
BRCA2- associati
Morfologia
Duttali (75%)
Midollari atipici (10%)
Duttali (75%)
Midollari atipici (<5%)
Grado
Alto (grado 3: 75%)
Medio (grado 2: 45%)
Alto (grado 3: 45%)
Recettori estrogeni
Negativi (75%)
Positivi (75%)
Espressione di ERBB2
Negativi (95%)
Negativi (95%)
Espressione di p53
Positivi (50%)
Positivi (40%)
Espressione di ciclina D1
Negativi (90%)
Positivi (60%)
Carcinoma in situ
Raro
Comune
TUMORI MAMMARI
Sporadici
(%)
BRCA1
(%)
BRCA2
(%)
ER Negativi
23
69.1
27.6
PR Negativi
37.2
71.2
34.5
Her-2/Neu Negativi
(IHC)
85.8
97.4
95.8
Non tripli negativi
86.2
42.9
76.7
Tripli negativi
13.8
57.1
23.3
Recettori
TUMORI OVARICI
• Eccesso di adenocarcinomi sierosi nelle
donne con mutazioni in BRCA1 (>90%)
rispetto ai controlli (50%).
• Gli adenocarcinomi sierosi sono spesso di
alto grado e frequentemente bilaterali
Histological subtypes of female adnexal and
peritoneal cancers. Piek et al, Familial Cancer 2: 73–
73–78, 2003.
Study group
Number (%)
Reference groupa
Number (%)
Serous
42 (84%)
2,750 (54.0%)
Mucinous
01 (2.0%)
0,829 (16.3%)
Endometrioid
01 (2.0%)
0,517 (10.2%)
Clear cell
00 (0%)
0,234 (4.6%)
Serous borderline tumor
01 (2.0%)
0,363 (7.1%)
Serous
03 (6.0%)
00,86 (1.7%)
Mixed
00 (0%)
00,09 (0.2%)
02 (4.0%)
0,300 (5.9%)
00 (0%)
0,404c
Epithelial ovarian cancer
Epithelial tubal cancer
Epithelial peritoneal cancer
Serous
Non-epithelial and stromal cell malignancies
a
Epithelial ovarian cancer in the Netherlands, 1989–1993
Anamnesi familiare e personale
Verifica documentazione clinica
Esame obiettivo, indagini di laboratorio/strumentali
Anamnesi familiare e personale
Verifica documentazione clinica
Esame obiettivo, indagini di laboratorio/strumentali
Sindrome di
Cowden
Sindrome di Peutz-Jegher
Anamnesi familiare e personale
Verifica documentazione clinica
Esame obiettivo, indagini di laboratorio/strumentali
Diagnosi
Formulazione rischio a priori
e informazione su storia naturale e aspetti genetici
(Sessione “Educativa”)
CATEGORIE DI RISCHIO
• Basso-normale
• Moderato
• Elevato
Rischio di sviluppare tumore della
mammella/ovaio
• Probabilità di sviluppare un cancro della
mammella:
– Gail model
– Claus model
• Probabilità di avere una mutazione in BRCA1/2
– Myriad risk tables
– BRCAPRO, BOADICEA
• Probabilità di altre sindromi (Cowden, Li
Fraumeni)
– Analisi del pedigree
Probabilità cumulativa di sviluppare Ca. Mammario per
una donna sana con 2 parenti di 1° grado affette da
Ca. Mammario (secondo Claus)
Età di esordio del parente 1
60-69
60-69
20-29 20-29
Età
Età di esordio del parente 2
(anni)
20-29
30-39
40-49
50-59
60-69
70-79
60-69
70-79
29
.021
.020
.018
.016
.014
.012
.004
.003
39
.069
.066
.061
.055
.048
.041
.016
.012
49
.166
.157
.146
.133
.117
.099
.041
.030
59
.295
.279
.261
.238
.210
.179
.080
.061
69
.412
.391
.366
.335
.297
.256
.122
.098
79
.484
460
.434
.397
.354
.308
.156
.128
Probabilità cumulativa di sviluppare Ca. Mammario per una
donna sana con 1 parente di 1° grado affetta da Ca.
Ovarico e 1 affetta da Ca. Mammario (secondo Claus)
Parente di 1° grado con diagnosi di Ca. Mammario in età compresa tra:
Età (anni) 20-29 30-39 40-49 50-59 60-69 70-79 80-89
29
.017
.015
.013
.010
.007
.005
.004
39
.057
.050
.042
.034
.025
.019
.014
49
.136
.122
.103
.082
.063
.048
.036
59
.244
.219
.186
.151
.118
.091
.072
69
.343
.309
.266
.218
.174
.138
.112
79
.406
.367
.319
.265
.214
.174
.144
89
.434
.394
.344
.298
.236
.193
.163
BOADICEA
Genetic status
Mutation carrier
probabilities
No mutation
0.1217
BRCA1
0.5866
BRCA2
0.2916
Genetic status
Mutation carrier
probabilities
No mutation
0
BRCA1
1
BRCA2
0
Age
BRC risks
OvC risks
39
0.0183
0.0042
40
0.0372
0.0098
41
0.0568
0.0176
42
0.0778
0.0258
43
0.1000
0.0344
48
0.2247
0.0813
53
0.3521
0.1317
58
0.4552
0.1894
63
0.5299
0.2507
68
0.5817
0.3108
73
0.6199
0.3666
78
0.6497
0.4151
80
0.6594
0.4323
BRCA1/2 Mutation Prob in a
Woman with Breast Ca <50
Any relative
with
Br Ca < 50?
Any
relative
with Ov
Ca?
Proband with
Bilateral Br or
Ov Ca?
Probability
(%)
8
25
44
55
62
81
Anamnesi familiare e personale
Verifica documentazione clinica
Esame obiettivo, indagini di laboratorio/strumentali
Diagnosi
Formulazione rischio a priori
e informazione su storia naturale e aspetti genetici
(Sessione “Educativa”)
Test disponibile
Test non disponibile
CATEGORIE DI TEST GENETICI
ONCOLOGICI E POSSIBILI ESITI
• Test di ricerca della mutazione
– positivo
– non informativo
• Variante a significato incerto
• No mutazione (altro gene? Mut non
evidenziata?)
SOGGETTO
MALATO!
• Test predittivo
» positivo
» (vero) negativo
SOGGETTO
SANO!
Benefici e Limiti del Test per
BRCA
Benefici
Rischi e Limiti
Identifica gli individui a
rischio
NON identifica tutte le
mutazioni
Identifica i non portatori
nelle famiglie con
mutazione nota
Rimane il rischio di tumore
sporadico
Permette una diagnosi
precoce e strategie di
prevenzione
Efficacia degli interventi non
provata
Può determinare una
riduzione dell’ansia
Può determinare danno
psicologico
BRCA1
1499insA
BR 50
BRCA1
OvC 64
OvC 61
BR 69
BR 45
BR 40
1499insA
BR 51
BR 39 BR 42
BR 58 OvC 53
FENOCOPIA
Pistoia
Prato
Florence
Pisa
Arezzo
Siena
3228_3229delAG
3285delA
5062_5064delTGT
1377_1378insA
1377_1378insA (Marroni et al, 2008)
Anamnesi familiare e personale
Verifica documentazione clinica
Esame obiettivo, indagini di laboratorio/strumentali
Diagnosi
Formulazione rischio a priori e informazione su storia naturale e aspetti genetici (Sessione “Educativa”)
Test disponibile
Test eseguito
Positivo
Test non disponibile
Test rifiutato
Non informativo
Negativo
Sorveglianza
popolazione generale
Offerta protocollo specifico
di sorveglianza
UTENTI ESTERNI
AOUC
SCREENING
UTENTI ESTERNI
FOLLOW-UP
AOUC
BREAST UNIT
CORD MAMMELLA
ISPO
CONSULENZA GENETICA
INF. PROFESSIONALE
ISPO
SORVEGLIANZA
CLINICA
ISPO
CONSULENZA
PSICOLOGICA
Chirurgoplastico
plastico
Chirurgo
ISPO
EPIDEMIOLOGIA
Ginecologo
Ginecologo
Laparoscopista
Laparoscopista
PREVENZIONE
• PRIMARIA
– Mastectomia bilaterale
– Annessiectomia bilaterale
– Chemioprevenzione
• SECONDARIA
– Sorveglianza clinica
• Mammella
• Ovaio
MASTECTOMIA BILATERALE
PROFILATTICA
Riduzione del rischio di carcinoma
mammario dopo mastectomia bilaterale è
del 90% e arriva al 95% se abbinata o
preceduta dall’ovariectomia.
Più dell’80% delle donne americane
eterozigoti BRCA1/BRCA2 opta
per la mastectomia profilattica
bilaterale;
in Italia <5%
Annessiectomia profilattica
(ovaio e tube)
• Riduce il rischio di tumore annessiale del 98%
(rischio di tumore primitivo peritoneale)*
• Riduce il rischio di tumore mammario del 63%
se fatta prima dei 40 anni e del 50% fatta prima
dei 50 anni
• Induce menopausa chirurgica
• Laparoscopia
* 5-10% dei carriers ha un tumore occulto al momento
dell’intervento, soprattutto delle tube
Rebbeck NEJM 346(21):1660, 2002; Kauf NEJM 346(21):1660, 2002
SORVEGLIANZA MAMMARIA
Fra i 25 anni e i 35 anni:
- visita clinica semestrale
- ecografi a mammaria semestrale
- RM annuale
- Mammografia annuale (>30 anni) a bassissima dose
Fra i 35 e i 50 anni:
- visita clinica semestrale
- ecografia annuale (semestrale se “seni densi” alla mammografia)
- mammografia annuale a bassa dose
- RM annuale
Al di sopra dei 50 anni:
- visita clinica semestrale
- mammografia annuale standard
- ecografia mammaria (a giudizio del Radiologo)
- RM annuale
SORVEGLIANZA OVARICA
• Ecografia transvaginale ogni 6 mesi iniziando
all’età di 30-35 anni (o 5-10 anni prima rispetto
all’età più giovane di dx nella famiglia)
• Dosaggio del CA-125 serico
“There are no data demonstrating that screening
these high-risk women reduces their mortality from ovarian
cancer. Nonetheless, [these measures] are
recommended.”*
*NIH Consensus Conference, JAMA 273:491, 1995
CONSULENZA PSICOLOGICA
La competenza psicologica fornisce un
aiuto per comprendere i bisogni emotivi
delle persone, per tenerne conto in ogni
interazione, in ogni comunicazione.
CONSULENZA PSICOLOGICA
Un supporto specificamente psicologico
viene offerto:
alle persone che nei colloqui con il genetista o
nelle visite previste dal programma di
sorveglianza manifestano difficoltà emotive
alle persone che, consapevoli di tali difficoltà,
lo richiedono spontaneamente.
Caso 1: Anna
Anna: donna di 45 anni con diagnosi
di BRC. La sua preoccupazione
principale riguarda il rischio delle figlie
di 18 e 22 anni.
Storia familiare:
– Lato materno: negativa per tumori
– Lato paterno: anamnesi significativa
• Zia paterna con OvC a 55 aa
• Nonna paterna BRC a 42 aa
Caso 1: Pedigree
Dx 42
82 yrs
60
58
Dx 55
d. 56
Key
Ruth
45
22
37
28
-Breast CA
-Ovarian CA
18
Rischio di mutazione in BRCA1/2: 36-44%
Caso 1: Pedigree
Dx 42
82 yrs
Dx 55
d. 56
60
58
Key
BRCA1 2800delAA
BRCA1 +ive
Entrambe negative
per la mutazione 22
Ruth
45
18
42
35 BRCA1 +ive
-Breast CA
-Ovarian CA
50% rischio alle figlie
Caso 1
• Anna
– Considera se effettuare annessiectomia
• Figlie
– Rischio della pop generale
– Non possono passare l’alterazione ai figli
• Sorella
– Sorveglianza clinica/riduzione chirurgica del rischio
• Cugina
– Sorveglianza clinica/riduzione chirurgica del rischio
Caso 1: Impatto psicologico del
risultato
• Anna è sollevata per il risultato delle figlie ma
percepisce il rischio di sviluppare OvC superiore
a quello reale
• Le figlie di Anna sono contente
• La sorella di Anna sente di avere il potere di
combattere il cancro
• L’altra sorella non vuole avere niente a che fare
con l’analisi e non vuole vedere dottori
Caso 1: Messaggi
• Il test genetico fornisce informazioni al
paziente e alla famiglia
– Alcuni membri della famiglia vogliono
l’informazione ed altri no
• Il test genetico, se informativo può aiutare
l’individuo a prendere le decisioni
• Può diminuire l’ansia
• Necessario il supporto per il Follow-up
Caso 2: Alice
Donna sana di 40 anni.
Storia familiare
– Madre: BRC a 58 aa
– Zia Materna: BRC a 65 aa
– Nonna Paterna: BRC a 79 aa
Alice pensa che con questa storia
familiare sia inevitabile sviluppare un
BRC
Case 2: Pedigree
Dx 79
d.81
Dx 58
65
Dx 65
71
Key:
Alison
40 yr
15
-Breast CA
Caso 2: Calcolo del Rischio
• Gail Model:
– Rischio di BRC a 5 aa: 1.2%; Rischio cumulativo:
20.4%
• Claus Model:
– Rischio cumulativo per BRC: 18.8%
• Myriad table:
– Rischio di mutazione in BRCA1/2 3.4%
• Pedigree analysis:
– Non indicazioni per altre sindromi
“Medio Rischio”
• Vari casi nella famiglia
• Eordio non giovanile
• Aumento del rischio per I familiari
– Rischio dipende dal numero degli affetti,
relazione di parentela, età di esordio
• Geni multipli a bassa penetranza
Case 2: Pedigree
Swedish / Finnish
Caucasian mix
Dx 79
d.81
Dx 58
65 yr
Dx 65
71 yr
Key:
Alison
40 yr
15 yr
-Breast CA
Caso 2
• BRC screening dall’età di 40 anni
• Non aumento del rischio di OvC
Caso 2: Messaggi
• Il numero di casi non è importante quento
l’età alla dx
• Il rischio percepito non sempre eguaglia il
rischio reale
• La consulenza genetica non sempre porta
al test genetico
Caso 3 - Vera
• Donna di 38 aa preoccupata per il rischio
di BRC
• Storia familiare di BRC e OvC in familiari
di 2° e 3° grado
• Vuole il test
Caso 3 - Pedigree
dx 31 R brca
dx 50 L brca
d. 75
dx 55
64
dx 55 colon
or ovarian ca
d. 56
[ ]
58
62
Vera
38
7
Caso 3
• Gail risk = 14.3%
• Claus = popolazione generale
• Rischio a priori di mutazione in Vera =
3.75-16%
• Rischio a priori di mutazione nella zia di
Vera = 15-64%
• Si raccomanda il test nella zia
Caso 3
• Vera non vuole contattare la zia
• Vera vuole eseguire il test
– Nella consulenza genetica si discutono rischi, benefici
e limiti del test
– Si cerca sempre di iniziare da un malato
• Risultato non conclusivo
– Negativo in Vera – non è vero negativo
– Varianti a significato incerto
Caso 3 – Risultati del Test
dx 31 R brca
dx 50 L brca
d. 75 CVA
dx 55
65
dx 55 colon
or ovarian ca
d. 56
[ ]
58
62
+ BRCA2 N517S
Vera
38
7
Variante a significato
incerto
VARIANTI A SIGNIFICATO
INCERTO (VUS)
• 10-12% delle persone testate per BRCA1/2
avrà una VUS
• Cercare di valutarne la patogenicità
– Incidenza nei controlli
– Cambiamento amino acidico e posizione nel
gene
– Segregazione nella famiglia
• La maggior parte non sono predisponenti a
BRC/OvC ma ci possono volere anni per
dimostrarlo
Caso 3
dx 31 R brca
dx 50 L brca
d. 75
dx 55
65
+ BRCA2 N517S
dx 55 colon
or ovarian ca
d. 56
[ ]
58
62
+ BRCA2 N517S
N517S è una mutazione vera
N517S non è una mutazione vera
(1 : 4 probabilità che casualmente
la condividano)
Vera
38
Considerare Vera a rischio
7
Caso 3
dx 31 R brca
dx 50 L brca
d. 75
dx 55 colon
or ovarian ca
d. 56
+ BRCA1 C61G
dx 55
65
+ BRCA2 N517S
[ ]
58
62
Decide di fare il
Test BRCA1/2
Vero negativo
+ BRCA2
N517S !
Vera
38
7
PAZIENTE AFFETTO DA CRC
POSITIVA
INSTABILITA’ DEI
MICROSATELLITI
Immunoistochimica per
MSH2, MLH1, MSH6
ANALISI DI
MUTAZIONE
Sequenziamento diretto del
gene indicato dall’indagine
IHC
+
65aa k
epatico?
+
81aa
75aa
76aa k prostata
51aa
48aa
38aa
65aa polipi?
49aa
47aa
47aa:
- Adenocarcinoma endometrio
- adenomi intestinali multipli
MYH esone 7: 494 A→
→G,
Tyr165Cys
Sequenza wild type
Sequenza mutata
ERRORI DI APPAIAMENTO:
Comparsa di alleli sovrannumerari nel DNA tumorale confrontato
con il DNA costituzionale
MUCOSA
TUMORE
INSTABILE
Bat 26
TUMORE
NEGATIVO
E
INFILTRATO
LINFOCITARIO
POSITIVO PER L’ANTICORPO
ANTI-MSH2
Bat 25
I
1
2
II
1
2
3
4
5
6
7
8
7
8
9
10
11
III
1
2
3
4
5
6
9
hMSH2, esone 10:
1549delGCinsT, Stop at
525