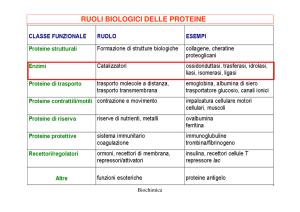
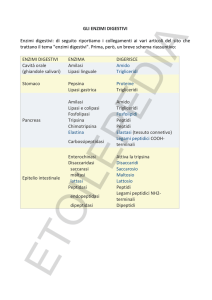
Enzimi come Biocatalizzatori: pregiudizi
• Gli enzimi sono delicati
• Gli enzimi sono costosi
• Gli enzimi sono attivi solo con i loro substrati naturali
• Gli enzimi lavorano solo in ambiente naturale
Enzimi come Biocatalizzatori: Vantaggi
Gli enzimi sono ecoeco-compatibili
A differenza dei metalli pesanti sono biodegradabili e quindi non tossici
per l’ambiente
Gli enzimi sono catalizzatori efficienti
Velocità
l
à di
d reazione 10
1 8-10
1 10 volte
l maggiori delle
d ll reazioni non
catalizzate.
Si usano basse quantità di catalizzatore (10-3-10-4%), per catalizzatori
artificiali (0.1
(0.1-1%).
Accelerazione delle reazioni catalizzate da enzimi
Più basso è il ∆G
G‡, più veloce è il processo
Equazione di Eyring
Teoria dello stato di transizione
Entalpia
Ent
lpi di attivazione:
tti
i n :
cambi nelle energie di legame e interazioni deboli
Entropia di attivazione:
costi di orientamento dei reagenti (minor disordine), perdita di
flessibilità comformazionale, effetti della concentrazione e solvente
L’enzima riesce a ridurre il ∆G
G‡ del processo stabilizzando lo
stato di transizione del rds e questo accelera la reazione.
Questo può essere fatto agendo su entrabi i contributi entalpici
ed entropici
Cinetiche di Michaelis Menten
PrePre
-steady state:
enzima, largo eccesso substrato, sistema non all’equilibrio
SteadySteady
-state:
lente variazioni degli intermedi reattivi
Cinetica di Michaelis Menten
Elevate concentrazioni di substrato
Basse concentrazioni di substrato
Relazione tra la kcat e la kcat/Km
kcat/Km ≤ k1
Enzimi come Biocatalizzatori: Vantaggi
Gli enzimi reagiscono in condizioni blande:
pH=5pH=5
pH
-8,, T=20T=20-40
40°
°C.. In questo
q
modo
m
reazioni collaterali (racemizzazioni,
(
m
,
isomerizzazioni, decomposizioni, riarrangiamenti) vengono minimizzate
Gli enzimi sono compatibili tra loro:
Lavorando in condizioni simili possono essere usati in reazioni a cascata
(cascade reactions) che evitano l’accumulo di prodotti instabili o permettono
di spostare
t
reazioni
i i di equilibrio
ilib i sfavorevoli
f
li
Gli enzimi non sono confinati al loro ruolo naturale:
Possono avere elevate tolleranze verso il substrato e lavorare in solventi
diversi dall’acqua.
Enzimi come Biocatalizzatori: Vantaggi
Gli enzimi catalizzano ampie classi di reazioni:
In quanto catalizzatori gli enzimi accelerano le reazioni ma non influiscono
sull’equilibrio
sull equilibrio termodinamico della reazione
reazione. Per cui alcune reazioni
catalizzare da enzimi possono essere fatte in entrambi i sensi
Vi sono enzimi per quasi tutte le reazioni organiche:
Idrolisi-Sintesi di esteri, ammidi, lattoni, lattami, eteri, anidridi di acidi,
Idrolisiepossidi, e nitrili.
OssidazioniOssidazioni
-Riduzioni di alcani, alcheni, aromatici, alcoli, aldeidi e chetoni,
solfuri e solfossidi.
Alogenazioni e dealogenazioni, alchilazioni e dealchilazioni, carbossilazioni e
decarbossilazioni, isomerizzazioni, reazioni aldoliche e addizioni di Michael.
Classificazione di enzimi (1987(1987-1999)
Nomenclatura
EC A.B.C.D
EC Enzyme Commission
A: denota il tipo principale di reazione
B. Denota il sottotipo, indicando il tipo di substrato o di
molecola
l
l che
h viene trasferita
f
C: indica la natura del coco-substrato
D: il numero individuale di enzima
Enzimi come Biocatalizzatori
Enzimi come Biocatalizzatori: Vantaggi
Gli enzimi sono selettivi:
Ch
Chemoselettivi:
l tti i grazie
i alla
ll loro
l
specificità
ifi ità riescono
i
a trasformare
t
f
un gruppo
funzionale in presenza di altri che reagiscono in condizioni confrontabili.
Regioselettivi: grazie alla loro struttura tridimensionale vengono riconosciuti
gruppi funzionali situati in posizioni diverse del substrato.
Stereoselettivi: Gli enzimi sono molecole chirali enantiopure e quindi sono
catalizzatori chirali. Possono quindi reagire in maniera diversa con gruppi
p producendo
p
molecole chirali con un certo grado
g
di arricchimento
enantiotopici
enantiomerico.
Enzimi come Biocatalizzatori: Svantaggi
Gli enzimi vengono prodotti in una sola forma enantiomerica:
Per via naturale non possono essere preparati enzimi composti da ammino acidi
della serie D. Per ottenere l’enantiomero opposto devono essere seguite vie
alternative.
Enzimi come Biocatalizzatori: Svantaggi
Gli enzimi richiedono condizioni di reazioni molto specifiche:
Il fatto che gli enzimi lavorino in condizioni blande non ci consente di
modificare troppo i parametri di reazione (temperatura, pH) per
forzare la reazione.
Gli enzimi forniscono la massima attività in acqua:
L’acqua, a causa dell’elevata temperatura di ebollizione e la bassa
volatilità, non è spesso il miglior solvente per le reazioni organiche.
Pochi solventi organici sono solubili con l’acqua.
Gli enzimi possono lavorare in solventi organici, ma la loro attività cala,
di solito di almeno un ordine di grandezza.
Enzimi come Biocatalizzatori: Svantaggi
Gli enzimi richiedono i loro cofattori naturali:
Mentre gli enzimi si sono rivelti molto flessibili nell’accettare substrati
non naturali, richiedono quasi esclusivamente i loro cofattori naturali.
Questi reagenti biologici sono relativamente instabili e troppo costosi
per essere usati in quantità stechiometriche. Sino ad ora non si sono
trovati sostituti sintetici validi.
Gli enzimi possono causare allergie:
Devono quindi essere maneggiati con cura, analogamente ai reagenti
chimici
chimici.
Gli enzimi sono proni alla disattivazione:
Molte reazioni enzimatiche possono essere inibite sia dai reagenti che
dai prodotti, il che comporta un forte calo di attività a concentrazioni
elevate di substrato o prodotto.
Enzimi come Biocatalizzatori: Svantaggi
Inibizione: competitiva (C); non competitiva (NC),
incompetitiva (UC).
(UC)
Grafici di LineweaverLineweaver-Burk
P= prodotto;
S= substrato
Inibizione competitiva: l’inibitore si lega
al sito attivo impedendo al substrato di
coordinarsi nel modo corretto o di
coordinarsi del tutto.
Km aumenta all’aumentare dell’inibitore;
Vmax (o kcat) non cambiano.
Aumentando la concentrazione di S Vmax
può essere raggiunta
P= prodotto;
S= substrato
Inibizione non competitiva: l’inibitore si
lega ad un altro sito dell’enzima. Viene
modificata la Vmax ma non la Km.
La coordinazione dell’inibitore causa per
p
esempio modifiche nella geometria del sito
attivo.. Possiamo avere coordinazione sia
attivo
all’enzima che al complesso enzimaenzimasubstrato
Inibizione incompetitiva: l’inibitore
influenza sia la Vmax che la Km.
Questo può essere causato da una
preferenziale coordinazione al
complesso enzimaenzima-substrato o dalla
m difi
modificazione
i n d
dell
ll’enzima
n im stesso
t
L’inibizione non competitiva e la combinazione di diverse inibizioni sono
il problema più serio per l’applicazione
l applicazione sintetica di enzimi
enzimi, perché sono
problemi che non possono essere risolti per semplice aumento della
concentrazione del substrato.
Enzimi isolati vs cellule
La forma in cui vogliamo usare un certo enzima
dipende
p
da molti
m
fattori
f
quali:
q
1) tipo di reazione,
2) possibilità di riciclo del cofattore;
3) scala in cui si effettua la reazione.
Enzimi isolati vs cellule
Enzimi isolati vs cellule
Enzymation: biotrasformazioni microbiche di substrati complessi
Enzymation:
che utilizzano alcuni o solamente un passaggio sintetico per
convertire prodotti non naturali nei prodotti desiderati.
Coenzimi
Molecole a basso peso molecolare, 15000 Da, piuttosto delicate e
decisamente costose per essere usate in quantità stechiometriche
Devono quindi essere riciclate
Riciclo necessario (+) o non necessario ((-).
Riciclo facile (++) o complesso (±)
( )
Fonti di Enzimi
La maggior parte degli enzimi usati nelle biotrasformazioni sono
usati nella forma non purificata e quindi sono relativamente
economici. Il contenuto varia (1
(1-30%) e la forma non purificata è
generalmente
n
lm nt più stabile.
t bil
Si ottengono:
• Industria della detergenza (lipasi e proteasi)
• Industria alimentare (proteasi e lipasi per la lavorazione della
carne, formaggio, grassi e olio. Per le fermentazione e la cottura
di dolci e p
pane vengono
g
usate delle glicosidasi
g
• Isolamento da organi (fegato, reni)
• Processi di fermentazione da batteri o funghi
• Origine vegetale (piante o frutti) abbastanza rari
• Gli enzimi purificati sono molto costosi. Esistono però mezzi di
purificazione sempre più efficaci ed economici.
.
Reazioni di Idrolisi
Trasformazioni idrolitiche di esteri e ammidi (proteasi, esterasi,
lipasi)
Vantaggi
Vantaggi:
gg : assenza di cofattori
f
sensibili,, disponibilità
p
di un largo
g
numero di enzimi non altamente specifici
specifici..
Ampio utilizzo in sintesi organica (2/3 delle biotrasformazioni)
Meccanismi
M
i i e aspetti
tti cinetici
i ti i
Meccanismo di idrolisi enzimatica di ammidi e esteri
Attacco nucleofilo da parte di un gruppo attivo dell’enzima alla gruppo
carbonilico dell’estere o ammide (idrolisi basica)
Gruppo attivo: -OH (serina) esterasi di fegato di maiale, lipasi microbiche
-COO- (acido aspartico) pepsina
-SH (cisteina) papaina
Meccanismo serina idrolasi
Meccanismo serina idrolasi
Idrolisi di proteine enzima catalizzata
istidina
serina
Acido aspartico
Enzima
Chimotripsina (serina proteasi)
Substrato
Complesso EnzimaEnzima-Substrato
Intermedio tetraedrico
Nuovo peptide N-terminale
In ambienti con basse concentrazioni di acqua
altri nucleofili competono con l’acqua:
9Acil transfer: reazione di un altro alcol (trans(trans-esterificazione)
9Amminolisi: reazione di RNH2 (ammide N
N-sostituita)
9Reazione con H2O2 (peracidi,
(peracidi RCOOOH)
9Reazione con tioli (tioesteri) non avviene
Sintesi enzimatica stereoselettiva
(substrati achirali)
Sintesi enzimatica stereoselettiva (substrati achirali)
Si genera un nuovo stereocentro grazie
alla tautomeria cheto enolica
Sintesi enzimatica stereoselettiva (substrati achirali)
Reagisce preferenzialmente uno dei gruppi enantiotopici
Si genera una nuova unità stereogenica
Sintesi enzimatica stereoselettiva (substrati achirali)
Processo ad uno stadio (diesteri)
Idrolisi dell diestere dell’acido malonico α,,α-disostituito ad opera
dell’αdell’
-chimotripsina o dell’esterasi di fegato di maiale (PLE)
La reazione si ferma dopo l’idrolisi del primo gruppo poiché il
prodotto è fortemente idrato in ambiente acquoso e non viene più
accettato dall’idrolasi
Cosa accade se la reazione procede? (seconda idrolisi)
Sintesi enzimatica stereoselettiva (substrati achirali)
Processo a due stadi (diacetato)
Il prodotto di mono
mono-idrolisi, monoacetato, è meno polare per cui si ottiene
anche il secondo processo che porta nuovamente ad un prodotto achirale.
La velocità però è inferiore (processo meno favorito) quindi si può
recuperare il monoestere chirale ad elevati ee
Sintesi enzimatica stereoselettiva (substrati achirali)
Composti meso (meso
(meso-trick
trick))
Sintesi enzimatica stereoselettiva (substrati achirali)
Composti meso (meso
(meso-trick
trick))
Processo a doppio stadio, diacetato
Cinetiche processi a singolo stadio
(reazione in ambiente acquoso, processo irreversibile)
Selettività
S= substrati achirale con gruppi enantiotopici
o composto meso
P,Q= prodotti enantiomerici
L’ ee dipende dal rapporto k1/k2, che è costante nel corso di tutta la reazione
Quindi l’ee non varia al variare della conversione, è costante
Cinetiche processi a doppio stadio
(reazione in ambiente acquoso, processo irreversibile)
Il secondo processo è una risoluzione
cinetica. Solitamente la selettività
dell’enzima è la stessa, per cui se k1>k2 k4
sarà maggiore di k3.
Con la conversione si otterrà un aumento
nell’ee del prodotto, mentre la resa in
prodotto diminuisce
Conversione
Cinetiche processi a doppio stadio
(reazione in ambiente acquoso, processo irreversibile)
Resa chimica dipende da:
Selettività dipende da:
Per avere alte rese in prodotto [Q+P]
Per avere alte stereoselezioni in prodotto [P]
Cinetiche processi a doppio stadio
(reazione in ambiente acquoso, processo irreversibile)
Enzimi come Biocatalizzatori
PLE pig liver esterase, PPL porcine pancreatic lipase
Cambiando enzima si ottiene opposta stereoselezione
(eePLE= 42%, eePPL=89%)
La risoluzione cinetica aumenta l’ee
Risoluzione cinetica
Primo esempio riportato risale al 1903
Nelle biobio-trasformazioni le risoluzioni cinetiche sono 4 volte più
frequenti delle trasformazioni stereoselettive
Risoluzione cinetica
Resa massima teorica: 50%
In alcuni casi kS>>kR, si trasforma solo uno dei due enantiomeri
Cinetiche di risoluzioni enzimatiche (Sih)
Selettività di una risoluzione = E = Enatiomeric Ratio
Eutomero:: enantiomero con la massima reattività
Eutomero
Distomero: enantiomero con bassa reattività o indesiderata
Distomero:
Risoluzione cinetica enzimatica
Costanti cinetiche sono
diffi ili d
difficili
da misurare
i
Si preferisce utilizzare
gli ee e la conversione
Dipendenza del valore di ee contro la conversione
Processo di risoluzione enzimatica a due stadi
I stadio: la reazione viene
bloccata al 40% per il quale il
prodotto
d tt h
ha un ee/resa
/
massimizzata (vicini al punto
X)
II stadio: il substrato viene
idrolizzato nuovamente fino
ad una conversione
complessiva del 60%, con un
recupero di reagente ee/resa
ottimale. Si sacrifica il 20%
di prodotto
Processo di risoluzione enzimatica reversibile
L’ee del substrato varia ha un p
profilo diverso rispetto
p
a quello
q
delle
reazioni irreversibili.
Ad alti livelli di conversione la reazione inversa diventa più importante.
Ovviamente sarà lo stesso enantiomero a reagire preferenzialmente,
portanto ad una diminuzione dell’ ee globale del substrato.
Per cui si deve operare in condizioni in cui la reazione sia irreversibile
(per esempio aumentando la concentrazione del nucleofilo)
Risoluzione biocatalitica sequenziale
Il substrato racemo ha due siti di reazione uguali, per cui la reazione
procede due volte con la formazione di un mono estere intermedio
In pratica il substrato deve coordinarsi al sito attivo e reagire due volte
Si ottengono selettività molto alte
Etot rappresenta la selettività che
un singolo processo dovrebbe avere
per ottenere questi ee
Risoluzione enzimatica sequenziale: idrolisi - esterificazione
Meccanismo
L’acetato racemo A e B viene idrolizzato per dare gli alcoli P e Q in un mezzo
organico contenente il minimo quantitativo di acqua.
Per cui, per azione della stessa lipasi, si ha l’esterificazione degli alcoli P e Q
ad opera dell’acido cicloesanoico presente nella miscela di reazione.
Il processo avviene quindi due volte con un notevole incremento della
stereoselezione del processo
Nel caso specifico si ottiene una Eapparente=400 utilizzando processi che hanno
E1=8 (idrolisi) e E2=97 per l’esterificazione di P/Q con l’acido cicloesanoico
Deracemizzazioni
Risoluzione cinetica: svantaggi
-Massima resa del 50%. Scarsa importanza dell’enantiomero non voluto
-Separazione del substrato dal prodotto può essere complessa e costosa
-Eccesso enantiomerico dei prodotti non ottimale
Per evitare questi svantaggi si possono utilizzare varie strategie:
Risoluzione Ripetuta
Inversione in
in-situ
Risoluzione Dinamica
Risoluzione Ripetuta
L’enantiomero non voluto (distomero), dopo separazione, viene racemizzato
e riutilizzato nel successivo ciclo di risoluzione cinetica
Approccio importante in processi industriali (sistemi in continuo)
Conversione totale nel prodotto voluto (virtuale)
Ciclo
Eutomero (%)
Distomero (%)
1
50
50
2
25
25
3
12.5
12.5
4
6.25
6.25
93.75
6.25
Dopo 4 cicli teorica resa del ca 94%
Rese reali più basse a causa delle condizioni energiche richieste per la racemizzazione
Uso di racemasi
Racemasi
In generale riescono a racemizzare:
-sistemi che contengono stereocentri con un protone
-sistemi nei quali il protone è vicino ad un gruppo elettron attrattore
ammino acidi
HR
H2N
HR
COOH
HO
COOH
α-idrossi
idrossiacidi,
acidi,
Classificazione in base ai siti basici nel sito attivo
Enzimi oneone-base (alanina racemasi)
Richiedono il piridossil fosfato (PLP) come cofattore
Racemasi e relativi substrati
Inversione in
in-situ
Utilizzabile con molecole che contengono un singolo stereocentro.
A seguito di una risoluzione cinetica il reagente e il prodotto vengono
ottenuti
tt n ti n
nelle
ll d
due f
forme
m enantiomeriche.
n nti m i h Il reagente
nt o il prodotto,
p d tt
opportunamente modificato, viene trasformato mediante un processo
stereospecifico, portando ad un derivato del prodotto o del reagente con
la stessa configurazione assoluta.
Esempio: idrolisi di esteri
In una reazione di idrolisi, l’alcol che si ottiene viene trasformato
in tosilato o triflato che viene poi idrolizzato con inversione di
configurazione. Nelle stesse condizione l’estere a opposta
configurazione viene idrolizzato con ritenzione di configurazione
Inversione in
in-situ
Poiché eeS e eeP dipendono dalla conversione,
la conversione deve essere calcolata in funzione del valore di E
(usualmente intorno al 50%)
Risoluzione Dinamica
La risoluzione avviene in condizioni nelle quali il substrato racemizza rapidamente.
Diverse reazioni avvengono contemporaneamente:
9 L’enzima deve avere un’elevata specificità per uno degli enantiomeri (kS>>kR o
kR>>kS)).
9 L’idrolisi non catalizzata deve essere trascurabile
9 La racemizzazione del substrato deve avvenire a velocità uguali e maggiori della
kR o kS) al fine di consentire concentrazioni
reazione enzimatica (kracSub≥k
sufficienti di enantiomero buono
9 La racemizzazione del prodotto deve essere trascurabile
Risoluzione Dinamica
diminuzione di eeP
a causa delle
risoluzione cinetica
Risoluzione Dinamica
con la risoluzione dinamica si possono ottenere elevati
valori di eeP solo per elevate stereoselezioni
E=19 eeP=90%; E=40 eeP=95%; E=100 eeP=98%
Idrolisi del legame ammidico
Idrolisi del legame ammidico
L’idrolisi delle ammidi è naturalmente legato al mondo
dei peptidi e ammino acidi
Produzione mondiale superiore ai 0.5 milioni di tonellate
Ammino acidi più importanti:
Acido
A id L
L-glutammico
l t
i
L-lisina
li i
D L-methionina
D,LD,L
thi i
Prodotti per fermentazione o per via sintetica
Idrolisi del legame ammidico
Ammino acidi D e L vengono prodotti con metodi enzimatici
Mercato globale USA 2004: 4.5 miliardi di USD
Applicazioni ammino acidi
Idrolisi del legame ammidico
Metodi più importanti per la produzione di ammino acidi
Risoluzione di substrati racemi via idrolisi con proteasi, esterasi e
lipasi: metodo più usato perché facile ed economico
Criteri generali
Idrolisi del legame ammidico
Generalmente il substrato con configurazione L viene accettato
dall’enzima e trasformato mentre il D non reagisce e viene recuperato
dal mezzo di reazione.
Se l’enantiomero
l enantiomero D è il prodotto desiderato lo si può ottenere
utilizzando opportuni gruppi protettori.
Con opportuni enzimi (idantoinasi) sono disponibili anche enzimi che
accettano preferenzialmente l’enantiomero D.
I due enantiomeri si separano agevolmente sfruttando le diverse
caratteristiche del reagente e del prodotto, per esempio solubilità a
diversi pH. Questo consente la separazione via estrazioni o
cromatografie con resine a scambio ionico.
Generalmente questi enzimi accettano solo ammino acidi α-sostituiti
Idrolisi del legame ammidico
Produzione di D e L ammino acidi con acilasi.
acilasi.
Utilizzato per L-metionina
metionina,, L-valina
valina,, acido L
L-α-amino butirrico,
D-fenil alanina
Risoluzioni con acilasi
Risoluzioni con idantoinasi
Idrolisi del legame ammidico
Idrolisi del legame ammidico
Utilizzato per L-metionina
metionina,, L-serina
serina,, D-ammino acidi aromatici (D
(D-fenil
glicina,, p-idrossi
glicina
idrossi-D-fenilglicina
fenilglicina))
Risoluzioni con lattamasi
Idrolisi del legame ammidico
Idrolisi di Esteri -Criteri generali
Idrolisi di esteri
Esistono molte poche esterasi che possono essere utilizzate per
l’idrolisi di esteri. Tra queste particolarmente importanti sono la
PLE (pig
p g liver esterase) HLE (horse liver esterase) e la ACE
(acetilcoline esterase) estratta dall’anguilla elettrica.
Possono essere anche utilizzare le cellule microbiche, ma questo limita
la variazione delle condizioni di reazione. Ampi screening per
individuare nuove esterasi e per esprimerle in microorganismi ospiti
sono in corso
Fortunatamente
F
t
t
t per queste
t reazioni
i i possono essere utilizzare
tili
anche
h le
l
proteasi.. Le più utilizzate sono la αproteasi
-chimotripsina e la subtilisina
subtilisina..
Vengono anche utilizzate, anche se in modo minore, la tripsina
tripsina,,
pepsina,, papaina e la penicillina acilasi
pepsina
In generale vengono idrolizzati gli esteri che mimano la configurazione
di un amminoacido L
Substrato tipo per esterasi e proteasi
Idrolisi di Esteri –Regole generali
Idrolisi di esteri
Idrolisi di esteri
9 Per entrambi i tipi di esteri lo stereocentro deve essere collegato
il più possibile vicino al centro reattivo per assicurare un
riconoscimento chirale massimo.
9 I gruppi R1 e R2 possono essere gruppi arilici o alchilici o sistemi
ciclici, ma la loro differenziazione sterica deve essere
massimizzata.
9 Non devono essere presenti gruppi carichi o polari (COOH, CONH2,
NH2) che sono fortemente idratati in ambiente acquoso. Per cui
devono essere opportunamente protetti.
9 Per
P i substrati
b
di
d tipo I la
l funzione
f
alcolica
l l
R3 deve
d
essere lla più
ù
piccola possibile (Me, Et). Questo vale anche per quelli di tipo II
(acetati o propionati).
9 In tutti i casi deve essere presente un protone legato allo
stereocentro.
Principali usi degli enzimi nelle biotrasformazioni
Principali enzimi usati nelle biotrasformazioni
Lipasi
Lipasi
Le lipasi sono enzimi che idrolizzano trigliceridi nei corrispondenti
acidi grassi e glicerolo.
Giocano un importante ruolo nelle biotecnologie poiché vengono
utilizzati in processi alimentari e per la preparazione di intermedi
chirali Più del 35% delle biochirali.
bio-trasformazioni vengono effettuate con
lipasi e per questo le lipasi sono gli enzimi più studiati.
Sono state clonate più di 30 lipasi e sono state risolte le strutture di
12 lipasi.
Il meccanismo con cui idrolizzano funzioni esteree è differente da
quello delle esterasi
Lipasi e Esterasi: cinetiche
Lipasi
Differente interazione fisico chimica con il substrato: l’enzima non mostra
attività finché il substrato è sciolto nel solvente in forma monomerica.
monomerica.
Quando la concentrazione aumenta tanto da formare una seconda fase
(lipofilica),
lipofilica), si ottiene un brusco innalzamento della reattività.
Attivazione all’interfaccia:
origina dal fatto che il
sistema diventa attivo solo
quanto la concentrazione
del substrato raggiunge la
CMC (concentrazione
micellare critica)
Attivazione all’interfaccia: la spiegazione a livello molecolare del
fenomeno è stato visto derivare da un riarrangiamento
dell’enzima: l’enzima in fase acquosa è inattivo poiché una sua
parte copre il sito attivo [Enz].
a contatto con la fasefase-bifasica un piccolo peptide in α-elica si
allontana e scopre il sito attivo e la lipasi si riarrangia nella forma
attiva [Enz]‡.
Per cui idrolisi catalizzare da lipasi devono essere condotte in
mezzi bifasici.
Il substrato può essere usato come tale o dissolto in solventi
organici immiscibili con l’H2O (esano, etere etilico, toluene).
Fenomeni di trasferimento di massa (per esempio agitazione)
influenzano notevolmente la reattività del sistema (rese in
prodotto)
Per determinare l’attività di una lipasi si utilizzano triacilgliceroli
quali la trioleina e tributilina mentre per le esterasi si utilizza il
p-nitroacetato
O CO R
O CO R
O CO R
OH
OH
OH
lipasi
+ 3 R-COOH
R= ?????
NO2
O
H2C
O
O
esterasi
H2C
OH
+ HO
NO2
Co-solventi miscibili con l’acqua attivano le esterasi mentre co
Cocosolventi immiscibili attivano le lipasi
Le lipasi sono sono state maggiormente utilizzate in risoluzioni
piuttosto che con composti meso, e con derivati di alcoli chirali,
vista la natura dei substrati naturali
In generali le stereoselezioni sono più elevate quando lo
stereocentro è vicino alla f
funzione carbossilica e in p
presenza di un
protone, (analogamente alle esterasi)
Criteri generali
Per substrati di tipo III la catena R3 deve essere sufficientemente
lunga (3,4 atomi di C) per conferire sufficiente lipofilicità al
substrato. D’altro canto catene troppo lunghe portano a substrati con
punto di ebollizionetroppo alto e alla formazione di schiume e
emulsioni.
emulsioni n
n-Butanoati sono normalmente gli esteri prescelti
Usualmente vengono idrolizzati preferibilmente
substrati con configurazione R allo stereocentro
alcolico. Molte proteasi (α( -chimistripsina,
subtilisina) mostrano stereoselezioni opposte.
Nelle strutture risolte ai raggi x si è osservato
che la disposizione della triade catalitica è
invertita nelle due classi di idrolasi. Questa
potrebbe essere l’origine dell’opposta
stereoselezione.
Criteri generali
Per substrati di tipo IV il residuo R3 dell’alcol deve essere
preferenzialmente una catena alifatica lunga (n(n-butanolo). Per qyesti
substrati si è osservata una preferenza nell’idrolisi di esteri S.
Funghi e batteri producono un elevato numero di lipasi. Poiché sono
enzimi extracellulari possono venire prodotti in elevate quantità su
larga scala.
Spesso vengono prodotti due isoenzimi (A e B), che sono strettamente
correlati. Solitamente mostrano la stesso senso di stereoselezione, ma
in alcuni casi si notano diversi valori di stereoselezione.
Estratti di lipasi usualmente contengono entrambe le forme. La loro
attività dipende dal quantitativo di enzima presente nella preparazione
e anche dal fornitore.
Source
Name
Human Pancreatic Lipase
Horse Pancreatic Lipase
Pig Pancreatic Lipase
Guinea Pig Pancreatic Lipase
Mammalian
Rhizomucor meihei
Pencillium cambertii
Humicola lanuginosa
Rhizopus oryzae
Candida rugosa
Candida antarctica Lipase A, Lipase B
Aspergillus niger
Geotrichium candidum
Fungal
Chromobacterium viscosum
Pseudomonas cepacia
Pseudomonas aeruginosa
Pseudomonas fluorescens
Pseudomonas fragi
Bacillus thermocate nulatus
Staphylococcus hyicus
Staphylococcus aereus
Bacterial
Brand Name
Main Application
Lipopan®
Baking industry
Lipozyme®
Oils and fats industry
Novozym® 27007
Pasta/Noodles
PalataseTM
Dairy industry
Clear-LensTM LIPO
Personal care industry
Greasex
Leather
LipolaseTM
Detergent industry
LipoPrime®
Detergent industry
NovoCorTM AD
Leather industry
Novozym® 735
Textile industry
Novozym® 871
Pet Food Industry
Requisiti Sterici per le Lipasi
Le lipasi più utilizzate possono essere classificate sulla base delle
caratteristiche del substrato naturale
Lipasi di Pancreas Suino (PPL)
E’ la lipasi più economica e quindi più utilizzata. L’estratto crudo
contiene una serie di altre idrolasi oltre alla PPL (la forma
parzialmente purificata è commerciale ad un prezzo molto più alto).
L’estratto
L
estratto commerciale che contiene ca 5% di PPL viene chiamato
pancreatina o steapsina. Contiene anche altre idrolasi (α( chimotripsina,, colesterol esterase
chimotripsina
esterase,, carbossipeptidasi B, fosfolipasi)
fosfolipasi)
per cui la reattività osservata può originare dalle diverse specie.
PPL è particolarmente attiva nell’idrolisi di esteri primari mentre αchimotripsina e colesterol esterase sia con esteri di alcoli primari che
secondari.
Idrolisi asimmetrica di derivati meso con PPL
Risultati complementare con l’idrolisi catalizzata da PLE
Ee maggiori con modificazioni del substrato –
sintesi di prostaglandine carbacicliche – trattamento della trombosi
Idrolisi asimmetrica di gliceroli con PPL
1,31,3
-propandioli achirali come substrato (fattori stereo
stereo-elettronici)
Migliori risultati con sistemi bifasici
Risoluzione di acetati biciclici
Reattività delle diverse idrolasi contenute nel PPL
L’elevata selettività è dovuta ad una nuova idrolasi isolata dal estratto di PPL
Candida sp. Lipasi
Sono disponibili diverse lipasi da lieviti tipo Candida.
I più utilizzati sono quelli di Candida lipolitica, C. antartica e C. rugosa.
Lipasi di Candida rugosa
Sono principalmente attivi con esteri di alcoli secondari ciclici
+ veloce
Modello del Substrato per Lipasi di C. Rugosa
L’estratto di CRL occasionalmente manifesta scarsa selettività con esteri
α-sostituiti. Questo è attribuibile alla presenza di due forme isomeriche
dell’enzima che operano con differenti selettività anche se hanno la
stessa enantiopreferenza
Forma A più selettiva e stabile
Modificazioni non covalenti di Lipasi di C. Rugosa
(trattamento con ii-PrOH)
Il semplice trattamento con ii-PrOH acquoso (50%) porta ad una lipasi
modificata che mostra un considerevole aumento di attività e
stereoselezione
Lipasi di Candida antartica
Questi enzimi sono stati trovati in Antartico nel corso di uno screening
effettuato per ottenere lipasi che operassero in condizioni estreme da
usare in f
formulazioni p
per la detergenza
g
I due isoenzimi sono abbastanza diversi:
isoenzima A: Ca2+ dipendente, termostabile, molto stabile con trigliceridi
in modo non specifico, non molto utile per sistemi non naturali.
isoenzima B: non è Ca2+ dipendente, meno termostabile, attivo con un
largo numero di substrati non naturali.
Entranbi sono stati clonati e sovraespressi in Aspergillus oryzae e sono
disponibili in larghe quantità
Tipici substrati per lipasi di Candida antartica
Meccanismo di Reazione della CALB
Meccanismo di Racemizzazione di alcoli ad opera di complessi di Ru